製品について ゾレアの用量設定と根拠
用法及び用量
1.気管支喘息
通常、オマリズマブ(遺伝子組換え)として1回75~600mgを2又は4週間毎に皮下に注射する。1回あたりの投与量並びに投与間隔は、初回投与前血清中総IgE濃度及び体重に基づき、下記の投与量換算表により設定する。
投与量換算表(1回投与量)
4週間毎投与

2週間毎投与
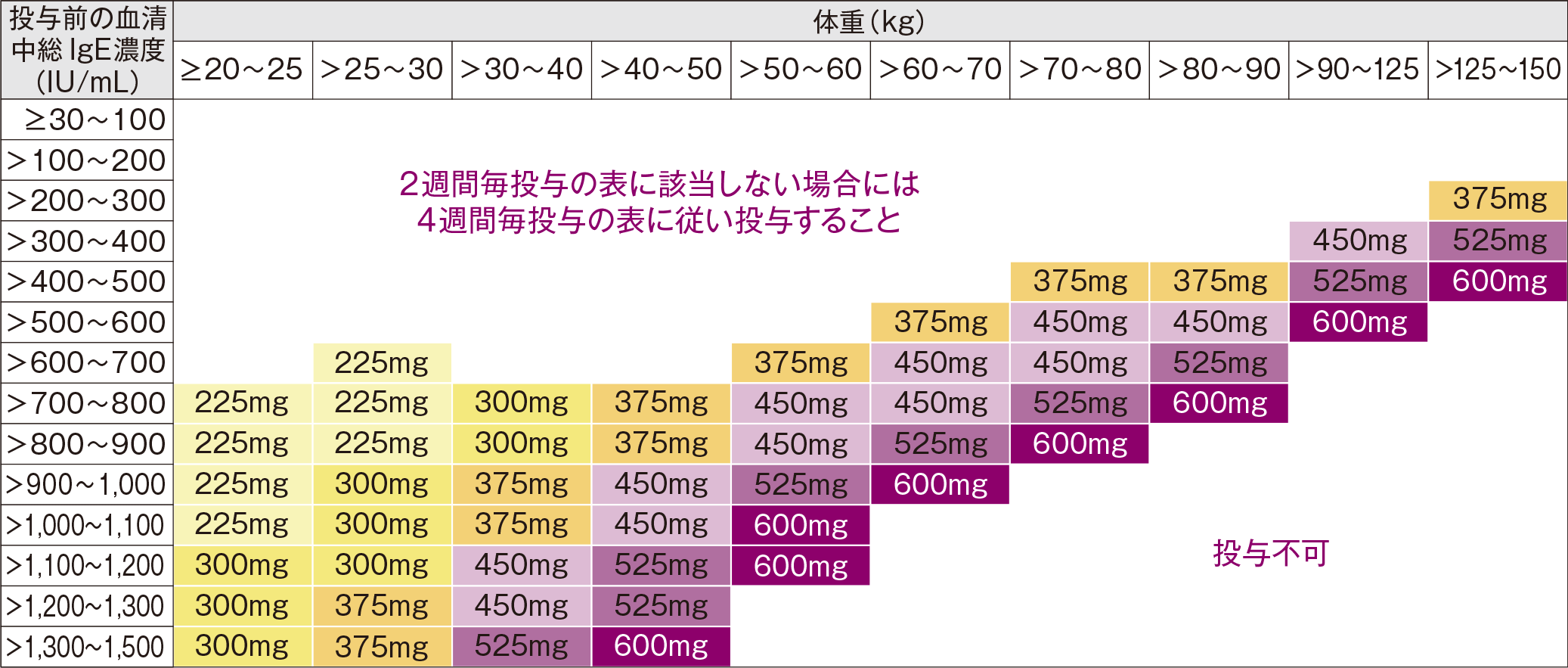
投与量換算表では、本剤の臨床推奨用量である0.008mg/kg/[IU/mL]以上(2週間間隔皮下投与時)又は0.016mg/kg/[IU/mL]以上(4週間間隔皮下投与時)となるよう投与量が設定されている。
薬力学(PD)
遊離IgE濃度の推移は下図の通りであった。
平均血清中遊離IgE濃度-時間推移
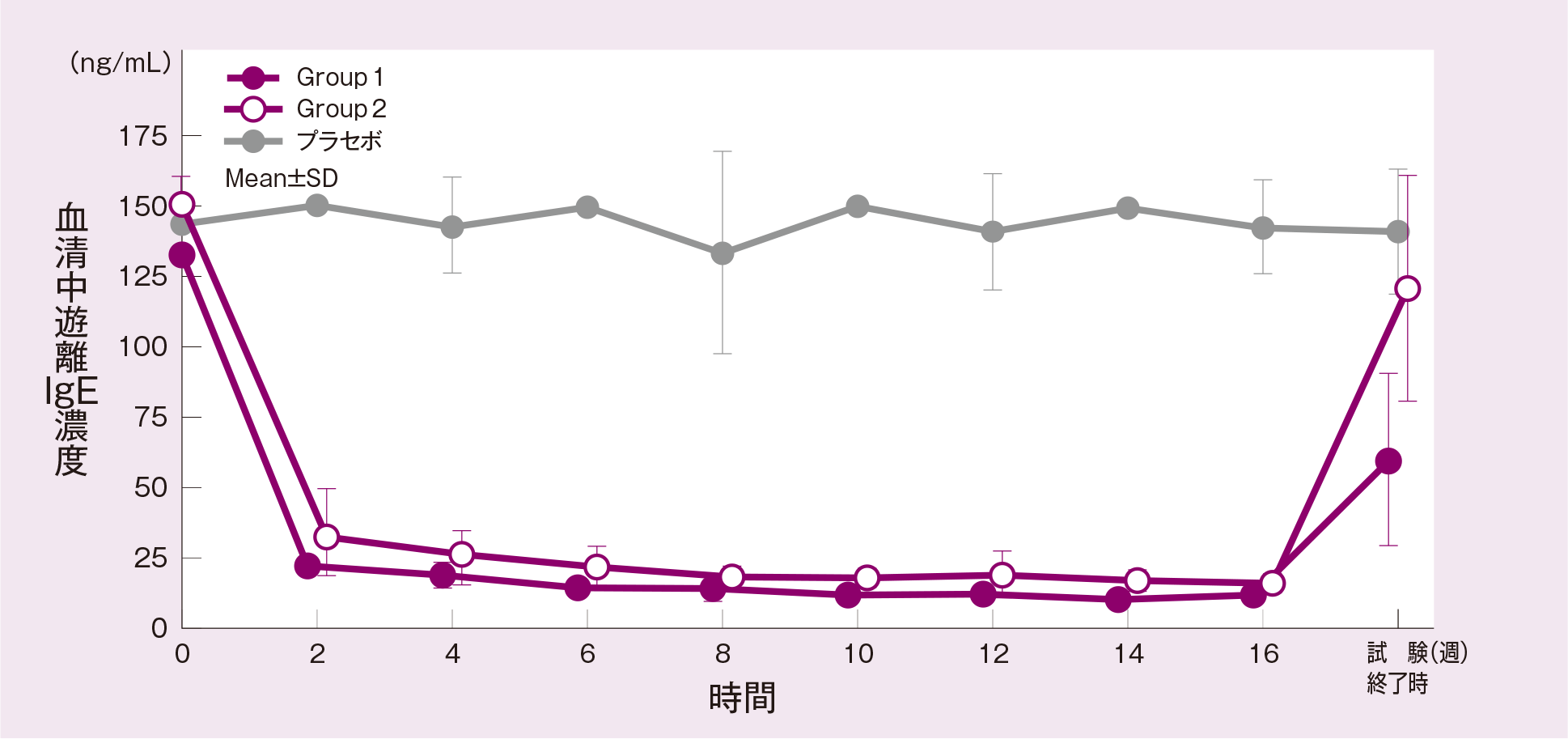
2.海外第Ⅳ相成人臨床試験(2210試験)(海外データ)1)
1) Zielen, S. et al.: Int. Arch. Allergy Immunol. 160(1), 102, 2013 〔XOLM01866〕 (承認時評価資料)
本試験は、ノバルティスの支援を受けた。本論文の著者のうち5 名は、ノバルティス及び関連施設に所属する者である。
| 本試験には国内承認内容対象外の症例(重症度の低い患者、血清中IgE濃度が>1,500~2,000IU/mLの患者)が含まれています。また本試験で用量設定に用いた投与量換算表は現在承認されている投与量換算表と異なるため、現在の承認内容とは異なる用量での成績が含まれますが、承認時に評価された資料であるため紹介します。 |
(1)試験デザイン
目的
ゾレア600mg以上を2週間隔で投与した際の、抗原誘発気管支収縮(ABP)テストを用いた即時型喘息反応(EAR)に対する効果と、治療前IgE値が2,000IU/mLまでのアレルギー性喘息患者に対する安全性を評価する。
試験方法
多施設共同、無作為化、プラセボ対照、二重盲検、並行群間比較試験
評価項目
有効性の主要評価項目は、ABP試験によるEAR(抗原吸入後10~30分のFEV1.0の最大低下率)とした。また、薬物動態(PK)及び薬力学(PD)を評価する。
また、副次評価項目は、ABPテストによる遅発型喘息反応(LAR)(抗原吸入後3~8時間以降のFEV1.0の最大低下率)、PK/PD、遊離IgE値、総IgE値、FENO、安全性(有害事象、臨床検査値、身体検査、バイタイルサイン、心電図等)を評価する。
対象
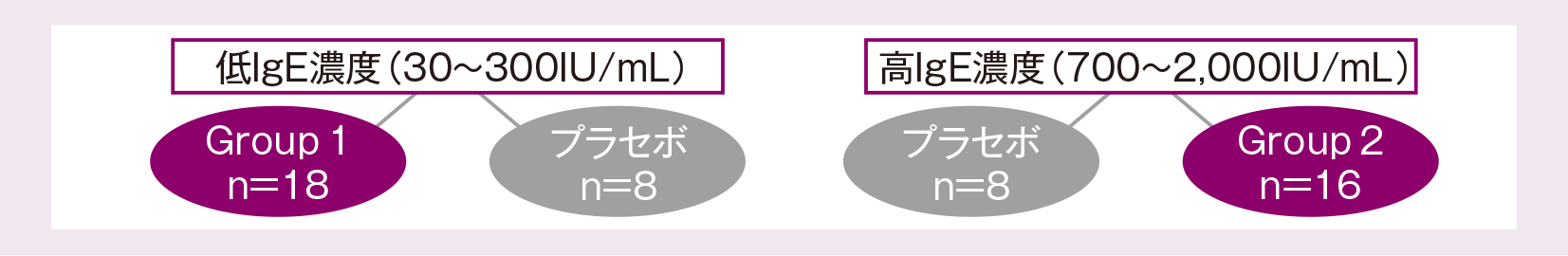
成人喘息患者(18~65歳、体重40~150kg)50例*1
(Group1:IgE濃度30~300IU/mL、Group2:同700~2,000IU/mL)
*1 本試験は、本邦の適応とは異なる重症度の対象で実施された。
投与方法
ゾレアの1回あたりの投与量並びに投与間隔は、初回投与前の体重と投与前の血清中総IgE値に基づき投与量換算表*2(なお、現在承認されている投与量換算表とは異なる)を用いて決定した。Group1の患者には、オマリズマブとして1回75~375mgを4又は2週間隔で皮下投与した。Group2の患者には、1回最大600mgを2週間隔で皮下投与した。
なお、本試験では、IgE濃度が承認された投与量換算表の上限を超えた2,000IU/mLの患者まで対象に含まれた(投与方法は1回600mgを2週間隔で投与)。
*2 Group1では、試験当時(2008年6月)EUにて既承認であった投与量換算表に基づく用量を設定した。
Group2では、シミュレーションに基づき、血清中遊離IgE濃度を11ng/mL(中央値)以下に低下させることができると推定される用量に設定した。
症例の内訳
(2)ABP試験によるEAR(即時型喘息反応)[ 主要評価項目 ]
投与8週目のEARは、プラセボ群で23.1%に対し、ゾレア投与群ではGroup1で9.3%、Group2で5.6%であり、いずれも有意な減少を示した(p=0.018及びp<0.001、ANCOVA)。投与16週目のEARは、プラセボ群で20.0%に対し、ゾレア投与群ではGroup1で11.8%、Group2で5.1%であった(p=0.087及びp<0.001、ANCOVA)。
4. 効能又は効果(抜粋) 〇 気管支喘息(既存治療によっても喘息症状をコントロールできない難治の患者に限る)
5. 効能又は効果に関連する注意(抜粋) <気管支喘息> 高用量の吸入ステロイド薬及び複数の喘息治療薬を併用しても症状が安定せず、通年性吸入抗原に対して陽性を示し、体重及び初回投与前血清中総IgE濃度が投与量換算表で定義される基準を満たす場合に本剤を追加して投与すること。症状が安定しないとは、下記の症状のいずれかが改善しないことを示す。 成人の場合
|
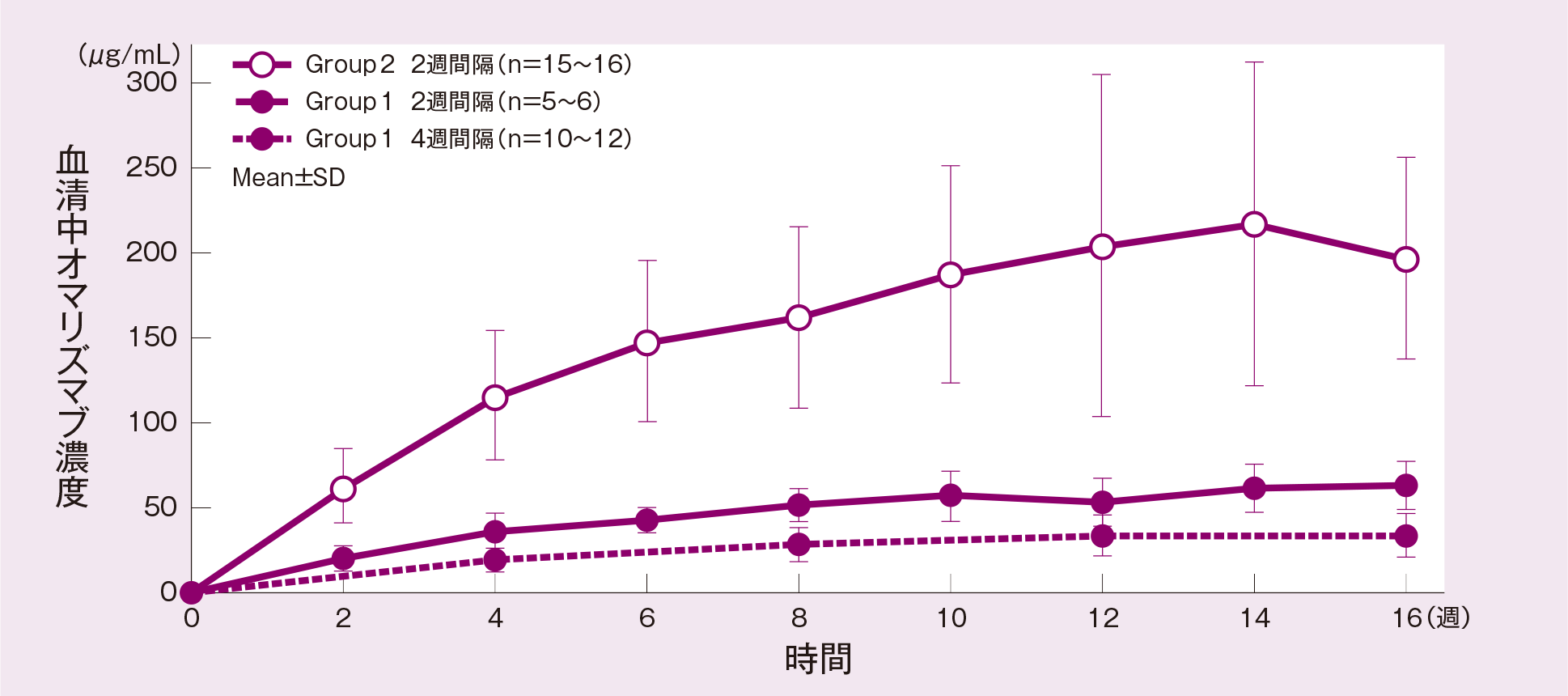
(3)薬物動態(PK)
反復投与時の血清中オマリズマブ濃度の推移は下図の通りであった。
平均血清中オマリズマブ濃度-時間推移
(4)安全性
本試験における有害事象は、Group1で50.0%(9/18例)、Group2で100.0%(16/16例)、プラセボ群で75.0%(12/16例)に認められた。主なものは鼻咽頭炎(Group1で3例16.7%、Group2で5例31.3%、プラセボ群で4例25.0%)であった。重篤な有害事象は、Group1の1例(5.6%)に乳頭腫、Group2の1例(6.3%)に悪性黒色腫が発現した。いずれも治験薬との関連は否定された。乳頭腫は消失したが、悪性黒色腫はデータベース固定時に継続中であった。中止に至った有害事象はゾレア群で2.9%(1/34例)及びプラセボ群で6.3%(1/16例)であり、事象はゾレア群で重篤な悪性黒色腫、プラセボ群で重度の気管支痙攣及び中等度の喘息増悪であった。死亡例は報告されなかった。
気管支喘息
製品について
疾患について

