ゾレア 製品について 有効性と安全性(成人)
| 「禁忌を含む使用上の注意」等はこちらをご参照ください。 |
※ ゾレア皮下注シリンジは、ゾレア皮下注用(凍結乾燥製剤)と薬物動態を比較した「生物学的同等性試験」の成績をもとに承認されたため、気管支喘息(既存治療によっても喘息症状をコントロールできない難治の患者に限る)及び特発性の慢性蕁麻疹(既存治療で効果不十分な患者に限る)の患者を対象とした国内臨床試験は実施されておりません。
成人に対する臨床効果
1.国内第Ⅲ相成人検証試験(1304試験)1) 2)
1) 社内資料:喘息患者を対象とした国内検証試験 1304 試験 〔XOLU00002〕 (承認時評価資料)
2) Ohta, K. et al.: Respirology 14(8), 1156, 2009 〔XOLJ00021〕
本研究はノバルティスが実施しました。試験デザイン、データ収集、データ解析、中断、レポートの執筆の役割を担いました。
| 本試験で用量設定に用いた投与量換算表は現在承認されている投与量換算表と異なるため、現在の承認内容とは異なる用量での成績が含まれますが、承認時に評価された資料であるため紹介します。 |
(1)試験デザイン
目的
気管支喘息患者を対象に、ゾレア投与群のプラセボ群に対する有効性を検証するとともに、安全性も検討する。
試験方法
多施設共同(73施設)、無作為化、プラセボ対照、二重盲検、並行群間比較試験
主要評価項目
ピークフローメーターで測定した朝のピークフロー(PEF)の最終評価時のベースラインからの平均変化量
副次評価項目
スパイロメーターによる呼吸機能検査値(投与16週又は中止時のFEV1.0のベースラインからの平均変化量など)など
対象
JGL(喘息予防・管理ガイドライン)1998改訂版で推奨されている長期管理薬*1では十分にコントロールできていない*2中等症から重症の気管支喘息患者315例(ゾレア群151例、プラセボ群164例)
*1 ベクロメタゾンプロピオン酸エステル(CFC-BDP)換算で800μg/日以上*3の吸入ステロイド薬を使用し、さらに1剤以上(経口ステロイド、β2刺激薬、徐放性テオフィリン薬、ロイコトリエン拮抗薬/トロンボキサンA2阻害・拮抗薬のいずれか。ただし、レスキュー薬としての短時間作用性吸入β2刺激薬を除く)を使用している。前観察期開始1ヵ月前から喘息管理のための治療薬の種類及び用法・用量の変更がなかったこととする。
*2 次のいずれかに該当する患者
- 喘息症状により夜間眠れない(1日以上/週)
- 喘息症状により日常活動が制限される
- レスキュー薬(短時間作用性吸入β2刺激薬)が必要な症状がある(1日以上/週)
- PEFの日内変動が20%以上ある(1日以上/週)
- FEV1.0あるいはPEF平均値が予測正常値に対して40~80%である(前観察期)
*3 ベクロメタゾンプロピオン酸エステル(BDP)の成人における本邦承認用量は800μg/日までである。
投与方法
ゾレア群は、オマリズマブ(遺伝子組換え)として1 回150~375mgを4又は2週間隔で16週にわたり皮下に注射した。1回あたりの投与量並びに投与間隔は、初回投与前の血清中総IgE濃度及び体重に基づき、投与量換算表(なお、現在承認されている投与量換算表とは異なる)により設定した。
解析計画
本試験では主要な解析対象をFull analysis set(最大の解析対象集団:FAS)とした。
さらに、FAS解析対象のうち、国内で承認された効能・効果に合致する部分集団(より重症度の高い患者に絞り込んだ患者集団)をサブグループ解析対象とした。朝のPEFの平均変化量とFEV1.0は、投与群、投与間隔及びベースライン値を共変量とした共分散分析(ANCOVA)モデルを用いて評価した。なお、試験を中止した被験者の場合は、LOCF法を適用した。
投与スケジュール

4. 効能又は効果(抜粋) 〇 気管支喘息(既存治療によっても喘息症状をコントロールできない難治の患者に限る)
5. 効能又は効果に関連する注意(抜粋) <気管支喘息> 5.1 高用量の吸入ステロイド薬及び複数の喘息治療薬を併用しても症状が安定せず、通年性吸入抗原に対して陽性を示し、体重及び初回投与前血清中総IgE濃度が投与量換算表で定義される基準を満たす場合に本剤を追加して投与すること。症状が安定しないとは、下記の症状のいずれかが改善しないことを示す。 成人の場合
<気管支喘息> 通常、オマリズマブ(遺伝子組換え)として1回75~600mgを2又は4週間毎に皮下に注射する。1回あたりの投与量並びに投与間隔は、初回投与前血清中総IgE濃度及び体重に基づき、投与量換算表により設定する。 |
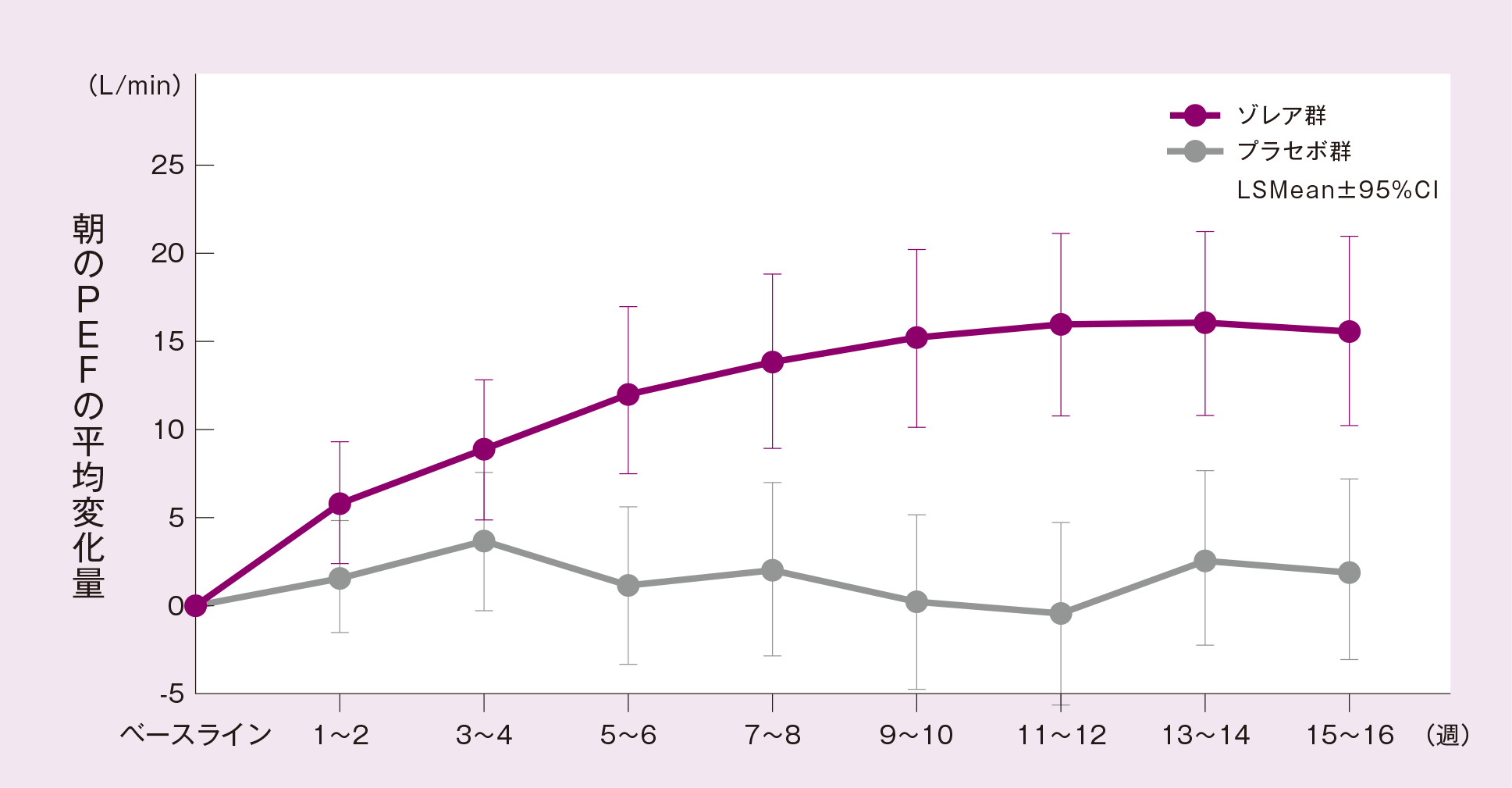
(2)朝のPEF[ 主要評価項目 ]
FASにおける最終評価時* 4 の朝のPEFのベースライン* 5 からの平均変化量(最小二乗平均値)は、プラセボ群に対するゾレア群の優越性が検証された(p=0.0004、ANCOVA)。

投与群、投与間隔、ベースライン値を共変量としたANCOVA モデルより求めたLSMean
*4(最終評価時):最終観察日以前の14 日間の平均値(治験薬投与期間中に治験を中止した被験者は、最後の測定値が記載された日以前14日間の平均値)
*5(ベースライン):初回投与開始日の朝のPEF 測定値も含む治験薬投与開始以前14 日間の平均値
FASにおけるゾレア群の朝のPEFの平均変化量の推移は下図の通りであった。
(3)FEV1.0[副次評価項目]
FASにおける投与16 週又は中止時のFEV1.0の平均変化量(最小二乗平均値)は、プラセボ群に比べゾレア群が有意に大きかった(p=0.032、ANCOVA)。
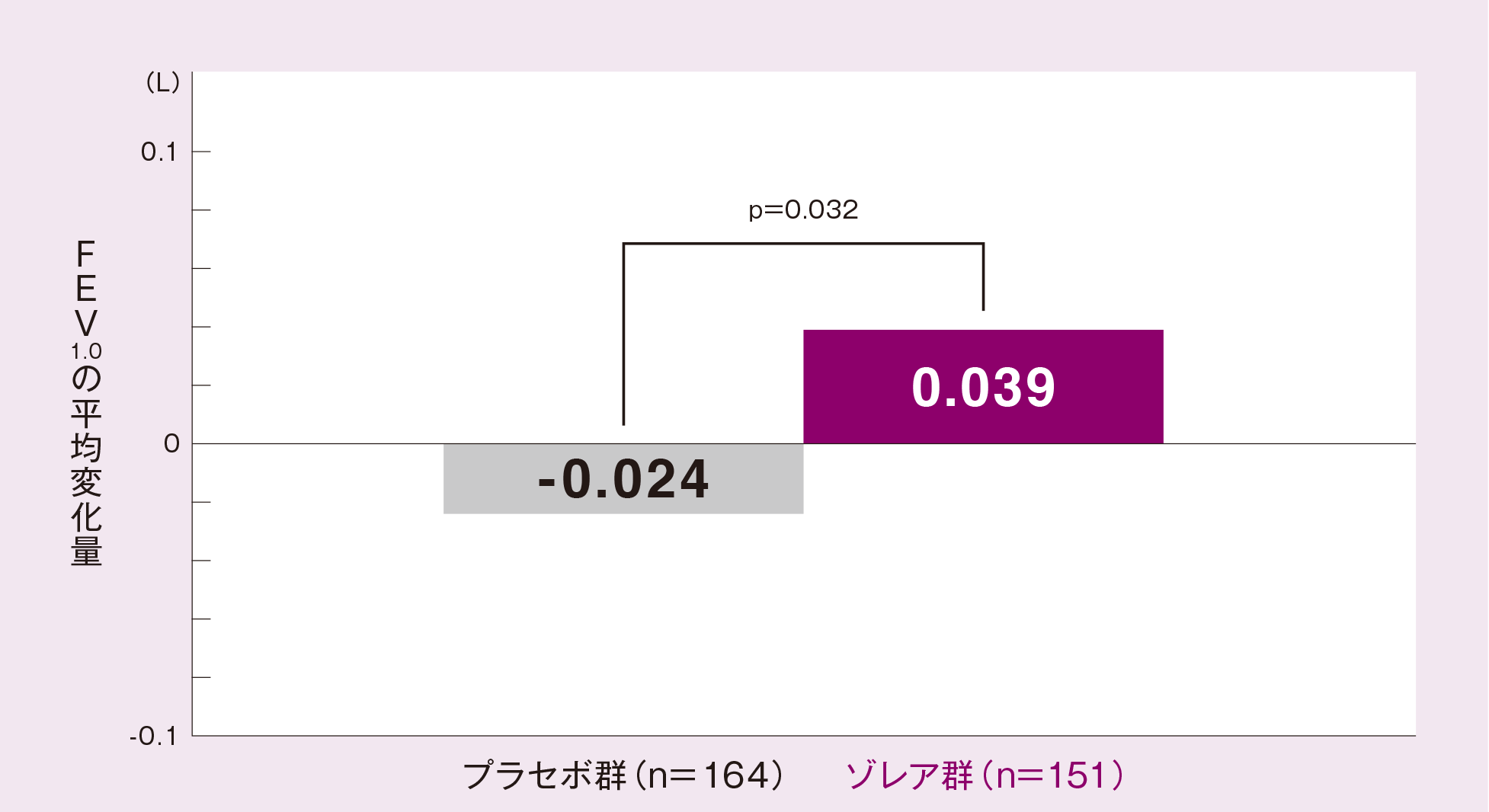
投与群、投与間隔、ベースライン値を共変量としたANCOVA モデルより求めたLSMean
(4)安全性
本試験(安全性解析対象集団:SAF)における副作用はゾレア群48.3%(73/151例)、プラセボ群38.4%(63/164 例)に認められた。
ゾレア群の主な副作用は注射部位紅斑34例(22.5%)、注射部位そう痒感17例(11.3%)等であった。
プラセボ群の主な副作用は、注射部位紅斑15 例(9.1%)、免疫検査異常12 例(7.3%)等であった。
重篤な副作用はゾレア群で1 例1 件(0.7%)に入院を要する肺炎が認められた。
また、有害事象による投与中止例はゾレア群で8 例(5.3%)であり、事象は蕁麻疹2 例(1.3%)、糖尿病、喘息、皮膚炎、肝機能異常、好酸球性肺炎/C-反応性蛋白増加/血中アルブミン減少/血小板数減少/リンパ球数減少/補体成分C4増加/血中尿素増加/好中球数増加/補体成分C3増加、鼻咽頭炎各1例(0.7%)であった。
プラセボ群は10 例(6.1%)であり、事象は喘息3 例(1.8%)、肝機能異常2 例(1.2%)、発疹/胸部不快感、蕁麻疹、肺結核、胃癌、悪心/嘔吐各1 例(0.6%)であった。
本試験において死亡例は報告されなかった。
(5)効能・効果に合致する部分集団*6における朝のPEF[ サブグループ解析結果 ]
効能・効果に合致する部分集団(より重症度の高い患者に絞り込んだ患者集団)においても、最終評価時*7の朝のPEFのベースライン*8からの平均変化量(最小二乗平均値)は、プラセボ群に比べゾレア群が有意に大きかった(p=0.0232、ANCOVA)。
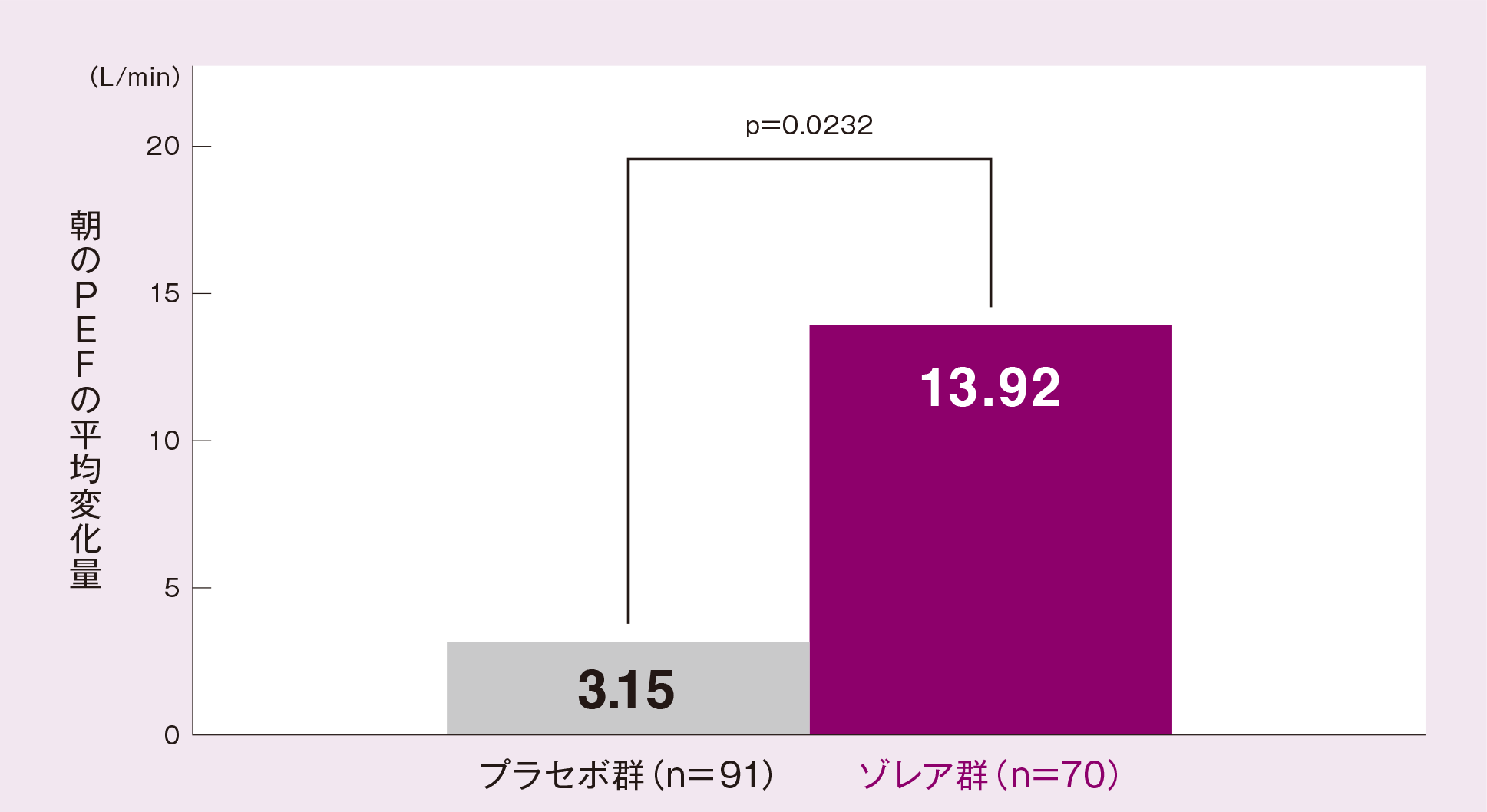
投与群、投与間隔、ベースライン値を共変量としたANCOVA モデルより求めたLSMean
*7(最終評価時):最終観察日以前の14 日間の平均値(治験薬投与期間中に治験を中止した被験者は、最後の測定値が記載された日以前14日間の平均値)
*8(ベースライン):初回投与開始日の朝のPEF 測定値も含む治験薬投与開始以前14日間の平均値
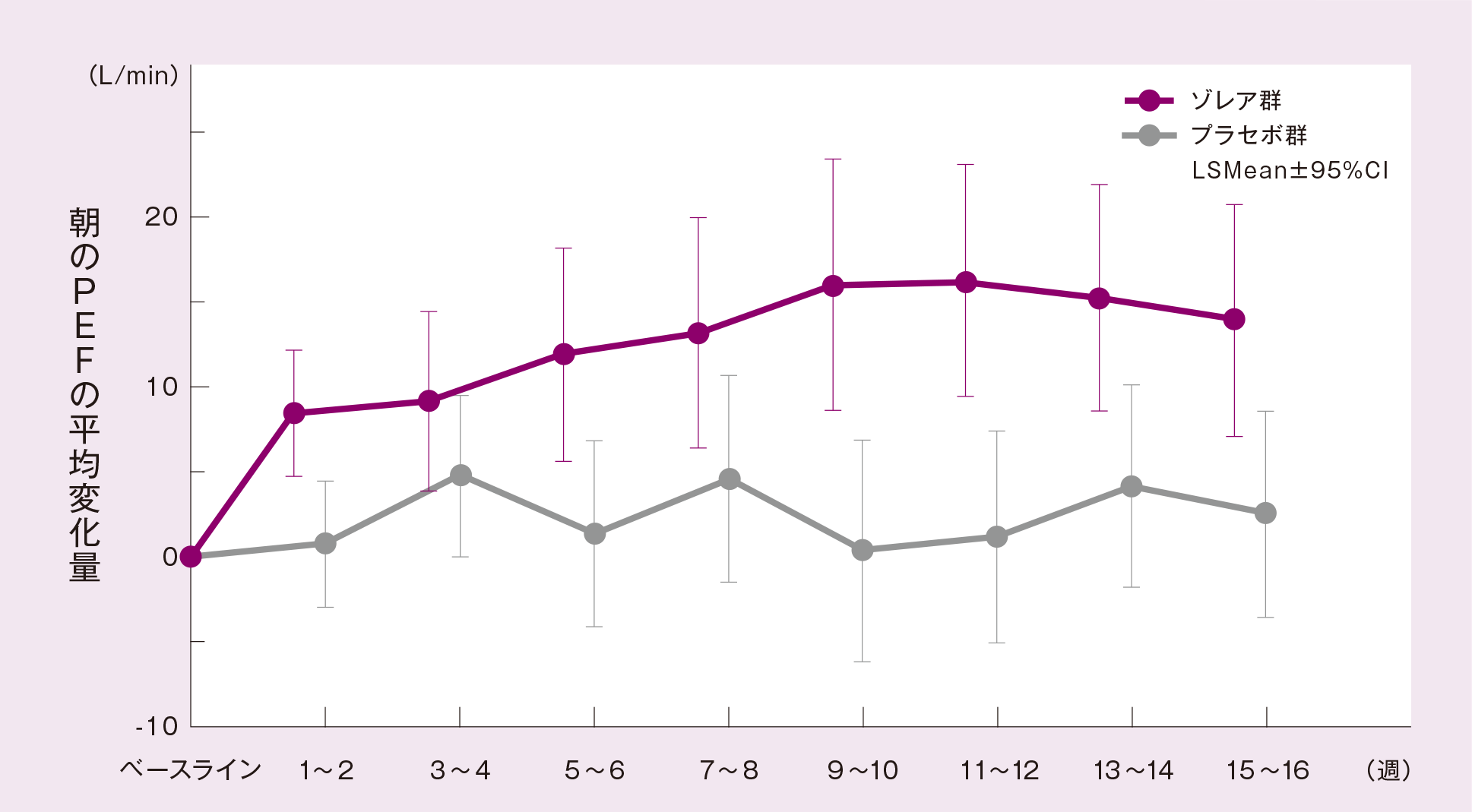
*6 効能・効果に合致する部分集団:
高用量の吸入ステロイド薬及び喘息治療薬を2 剤以上併用もしくは経口ステロイド薬を併用しているにもかかわらず、喘息症状がある(毎日の喘息症状がある、週1回以上の夜間症状がある、FEV1.0 が予測値の80%未満のいずれかを満たす)という条件に合致する部分集団161 例
(6)効能・効果に合致する部分集団*9におけるFEV1.0[ サブグループ解析結果 ]
効能・効果に合致する部分集団(より重症度の高い患者に絞り込んだ患者集団)においても、投与16週又は中止時のFEV1.0の平均変化量(最小二乗平均値)は、プラセボ群に比べゾレア群が有意に大きかった(p=0.008、ANCOVA)。
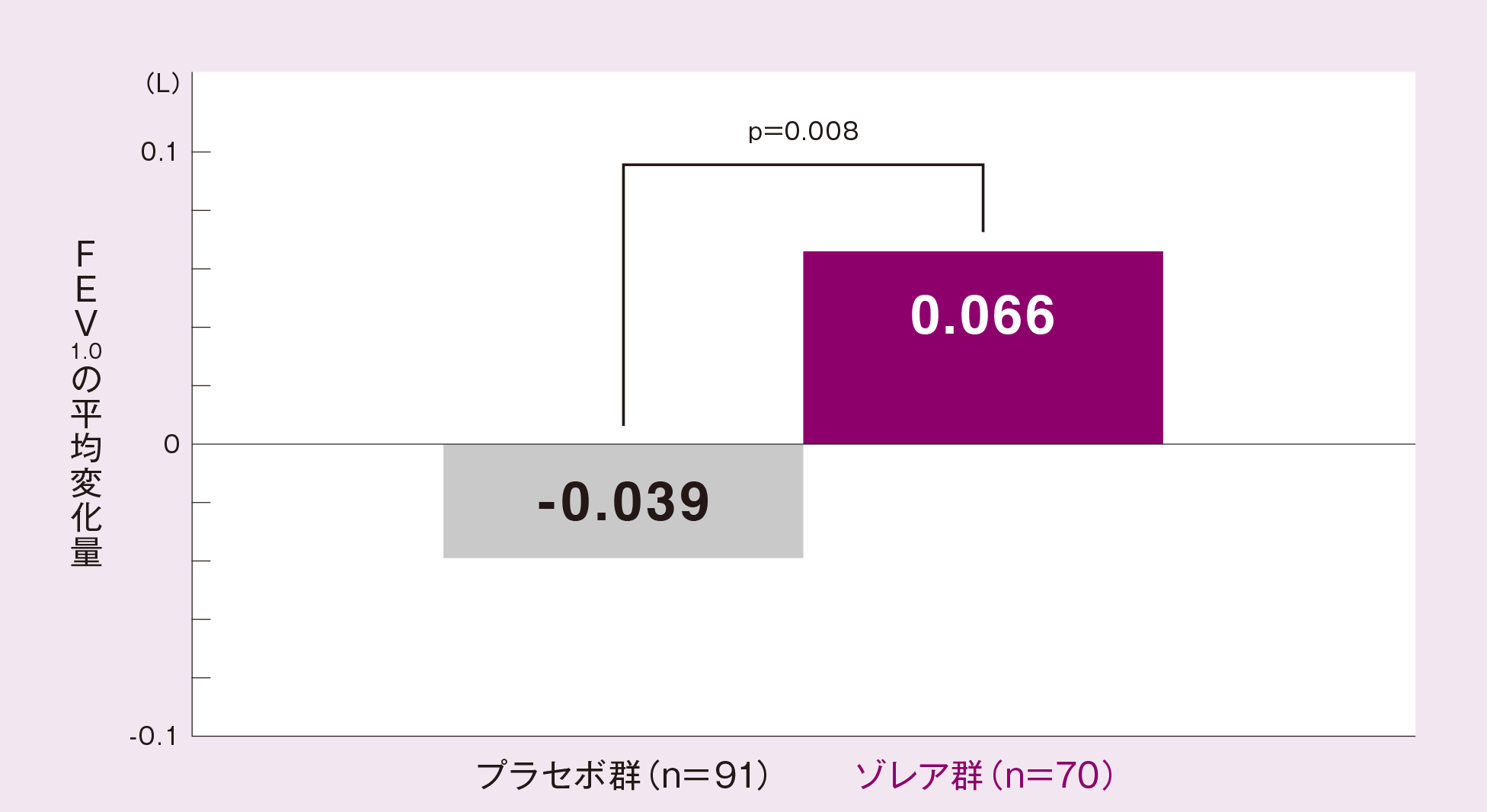
投与群、投与間隔、ベースライン値を共変量としたANCOVA モデルより求めたLSMean
*9 効能・効果に合致する部分集団:
高用量の吸入ステロイド薬及び喘息治療薬を2 剤以上併用もしくは経口ステロイド薬を併用しているにもかかわらず、喘息症状がある(毎日の喘息症状がある、週1回以上の夜間症状がある、FEV1.0 が予測値の80%未満のいずれかを満たす)という条件に合致する部分集団161 例
気管支喘息
製品について
疾患について

