クロザリル 国内臨床試験
Clozapine(LX100-129)の治療抵抗性統合失調症に対する臨床試験(後期第Ⅱ相試験:1201試験)2)
■ 目的
治療抵抗性統合失調症患者に対するクロザリルの安全性と有効性を26週間にわたり検討する。
臨床推奨用量を検討する。
■ 対象
治療抵抗性統合失調症患者
以下の基準をすべて満たす患者を対象とした。
- DSM-IV及びICD-10の「統合失調症」診断基準に合致する。
- 入院患者
- 同意取得日の年齢は18歳以上65歳未満
過去2年6ヵ月のいかなる時期においても、抗精神病薬に対して十分に反応した時期が存在しない
[持続的入院やGAF(Global Assessment of Function)評点≦30を目安とする]。
治療抵抗性統合失調症である(下記の1)、2)のいずれかに合致する)。
1) 既存の薬剤に対して反応性不良
以下に示す抗精神病薬の使用に反応しない。
1日あたりの総量としてクロルプロマジン換算1,000mg/日以上の薬物を少なくとも6週間以上投与する薬物治療を過去5年間に3回以上行っている。使用された薬剤は主剤(注)として3剤以上で、かつ少なくとも2剤は異なるchemical class(butyrophenone系、phenothiazine系など)に属する。(注) 抗精神病薬を複数使用している場合は、クロルプロマジン換算で最も量の多い(50%以上)薬剤を主剤とする。3剤以上の薬剤を同時期に使用し、50%以上の薬剤がない場合は、「主剤なし」とし、主剤の数には加えない。
2) 既存の薬剤に対して耐容性不良精神症状が改善しないにもかかわらず、遅発性ジスキネジア・錐体外路系症状が発現するため、増量できなかった抗精神病薬が過去に2剤以上ある。
- 前観察期の精神症状の重症度が、下記のいずれも満たす。
1) BPRS合計点が45点以上である。
2) BPRS項目「概念の統合障害」、「猜疑心」、「幻覚による行動」、「不自然な思考内容」のうち、2項目以上において、スコアが4以上である。
- 本試験中、患者が退院又は入院時に外泊した場合、精神症状、有害事象の発現などを観察、報告でき、かつ治験薬の服薬を管理できる同居可能な代諾者がいること。
■ 症例(評価例)数
30例
■ 試験デザイン及び投与方法
試験デザイン:
Fixed-flexible法(適宜漸増法)による多施設共同、非対照、非盲検試験
投与方法:
初回投与日には12.5mgを1日1回朝投与した。原則として、3週間かけて200mg/日まで増量することとし、有害事象が発現した場合は、患者の状態を観察しながら、より緩徐な増量を可とした。また、200mg/日に至る前に十分な効果が得られた、あるいは有効性と有害事象に対する耐容性を勘案し200mg/日まで増量する必要がないと判断された場合は、増量を行う必要はないこととした。漸増終了後は、臨床効果と耐容性を観察しながら適宜増減し(注)、患者ごとに至適用量を探索した。最大効果が得られた後は、漸減して可能な限り低用量で維持することとした。
(注)増量については、以下の1~4の留意事項に従い行った。
- 増量間隔は少なくとも4日間以上とする。
- 1日で100mgを超える増量は行わない。
- 投与量が200mg/日以上の場合には分割投与とする。300mg/日以上である場合には3分割以上の投与が望ましい。また、総1日量は、均等に分けずに、就寝時に多く投与してもよい。
- 1日投与量は600mgを超えない。
投与中止時:
無顆粒球症・好中球減少症、心筋炎・心筋症などの重篤な有害事象発現のため本薬の投与を緊急に中止しなくてはいけない場合は、精神症状の再燃など十分に注意した。また、緊急を要さない場合は、2週間かけ精神症状の変化に注意しながら漸減終了した。
投与期間:
治療期26週間、漸減期2週間(継続投与試験に移行しない場合)
| 国内で承認されたクロザリルの用法及び用量 通常、成人にはクロザピンとして初日は12.5mg(25mg錠の半分)、2日目は25mgを1日1回経口投与する。 3日目以降は症状に応じて1日25mgずつ増量し、原則3週間かけて1日200mgまで増量するが、1日量が50mgを超える場合には2~3回に分けて経口投与する。維持量は1日200~400mgを2~3回に分けて経口投与することとし、症状に応じて適宜増減する。ただし、1回の増量は4日以上の間隔をあけ、増量幅としては1日100mgを超えないこととし、最高用量は1日600mgまでとする。 |
■ 評価項目
主要評価項目:
有効性
BPRS合計スコア変化量の推移、BPRS合計スコア20%以上の改善例の割合
以下の18項目*からなり、評価は「1.なし」、「2.ごく軽度」、「3.軽度」、「4.中等度」、「5.やや重度」、「6.重度」、及び「7.最重度」の7段階で行った。*心気症、不安、情動的引きこもり、概念の統合障害、罪責感、緊張、衒奇症と不自然な姿勢、誇大性、抑うつ気分、敵意、猜疑心、幻覚による行動、運動減退、非協調性、不自然な思考内容、情動の平板化、興奮、見当識障害
PANSS(Positive and Negative Syndrome Scale)合計スコア変化量の推移
以下の30項目*からなり、評価は「1.なし」、「2.ごく軽度」、「3.軽度」、「4.中等度」、「5.やや重度」、「6.重度」、「7.最重度」で行った。*〔陽性尺度〕
妄想、概念の統合障害、幻覚による行動、興奮、誇大性、猜疑心、敵意
〔陰性尺度〕
情動の平板化、情動的引きこもり、疎通性の障害、受動性/意欲低下による社会的引きこもり、抽象的思考の困難、会話の自発性と流暢さの欠如、常同的思考
〔総合精神病理評価尺度〕
心気症、不安、罪責感、緊張、衒奇症と不自然な姿勢、抑うつ、運動減退、非協調性、不自然な思考内容、失見当識、注意の障害、判断力と病識の欠如、意志の障害、衝動性の調節障害、没入性、自主的な社会回避
安全性
有害事象、体重、体温、血圧・脈拍数、血液学的一般検査、HbA1C、グルコース、血液生化学検査、尿検査、内分泌検査、心電図、心エコー
副次評価項目:
遅発性ジスキネジア・錐体外路系症状(DIEPSS: Drug Induced Extra-Pyramidal Symptoms Scale、AIMS: Abnormal Involuntary Movement Scale)
■ 解析計画
BPRS、PANSS、DIEPSS及びAIMSの元データ尺度、投与開始日からの変化量について記述統計量の算出及び平均の推移図を作成した。変化量についてはpaired 検定を実施し、95%信頼区間(CI)を求めた投与開始前日からのBPRS変化率の20%以上改善例の割合及び両側95%信頼区間を算出した。計数値については、各カテゴリーの度数、割合を算出した。BPRS及びPANSSにおいて、治療抵抗性(反応性不良、耐容性不良)の層別解析を行った。
■ 判定基準
BPRS合計スコア改善例とは、投与前のBPRS合計スコアを基準として各評価時点でスコアが20%以上低下した患者と規定した。
■ 有効性
主要評価項目:BPRS合計スコア変化量の推移
BPRS合計スコアは投与前の62.2±8.35(平均値±標準偏差、以下同様)から投与2週後より減少し、投与26週後では−16.0±10.32(95%CI: −20.6, −11.4)変化しました。最終評価時では−14.2±10.76(95%CI: −18.2, −10.2)の変化が示され、投与前と比較して有意な減少が示されました(p<0.001、paired t検定による群内比較)。有効性評価対象の反応性不良例(22例)では、投与前62.6±8.73、最終評価時52.0±10.40(変化量は-10.6±9.43)、耐容性不良例(8例)では投与前61.0±7.60、最終評価時37.0±11.34(変化量は-24.0±7.95)であり、それぞれ有意(p<0.001、 paired t検定)な減少が示されました。
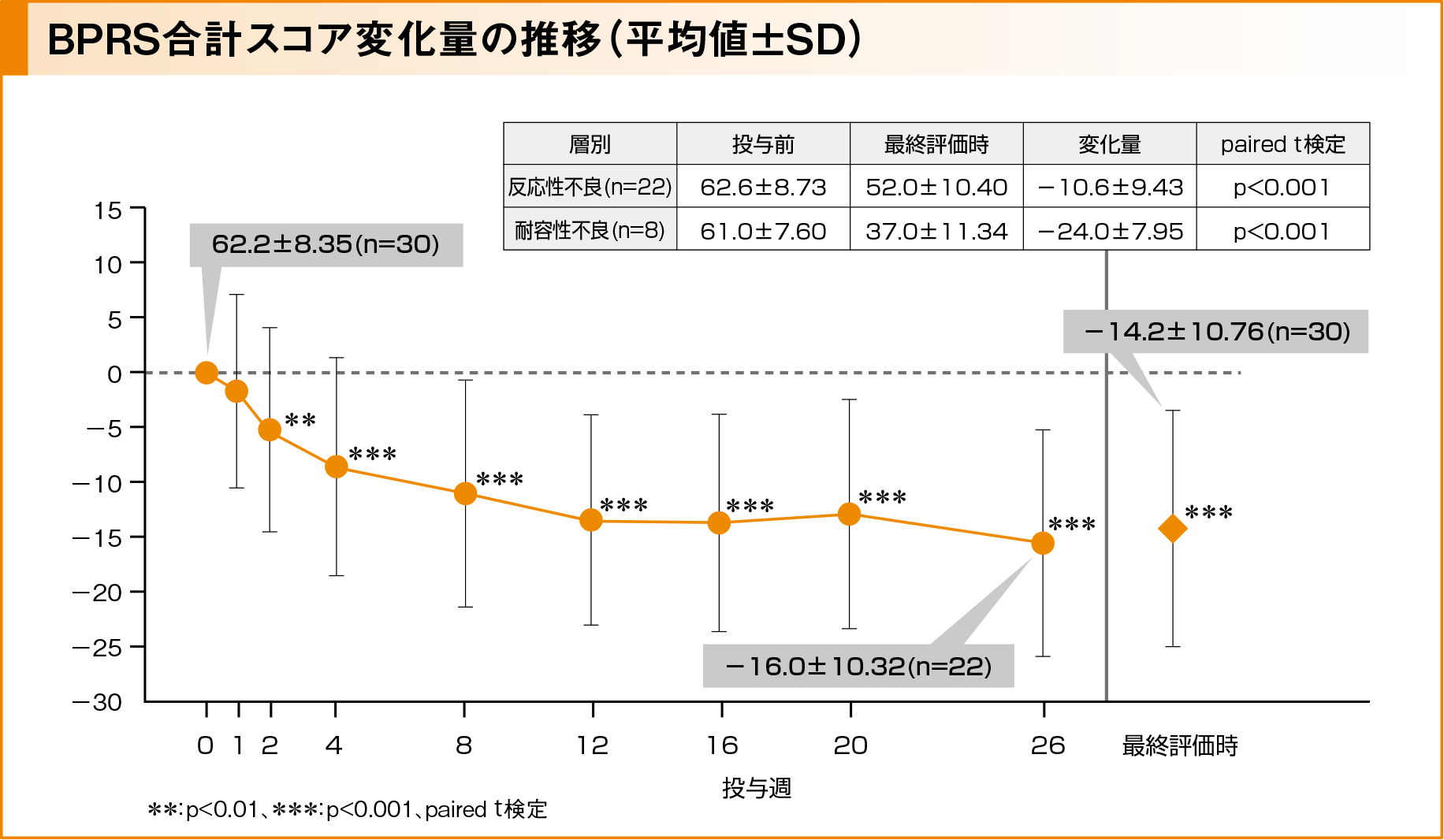
主要評価項目:BPRS合計スコア20%以上の改善例の割合
BPRS合計スコア改善例*は投与1週後から2例に示され、その後増加し、投与26週後で14例[63.6%(95%CI: 40.7, 82.8)]、最終評価時で56.7%(17例[56.7%(95%CI: 37.4, 74.5)])でした。反応性不良例では22例中9例が改善を示し、耐容性不良例では8例全例が改善を示しました。

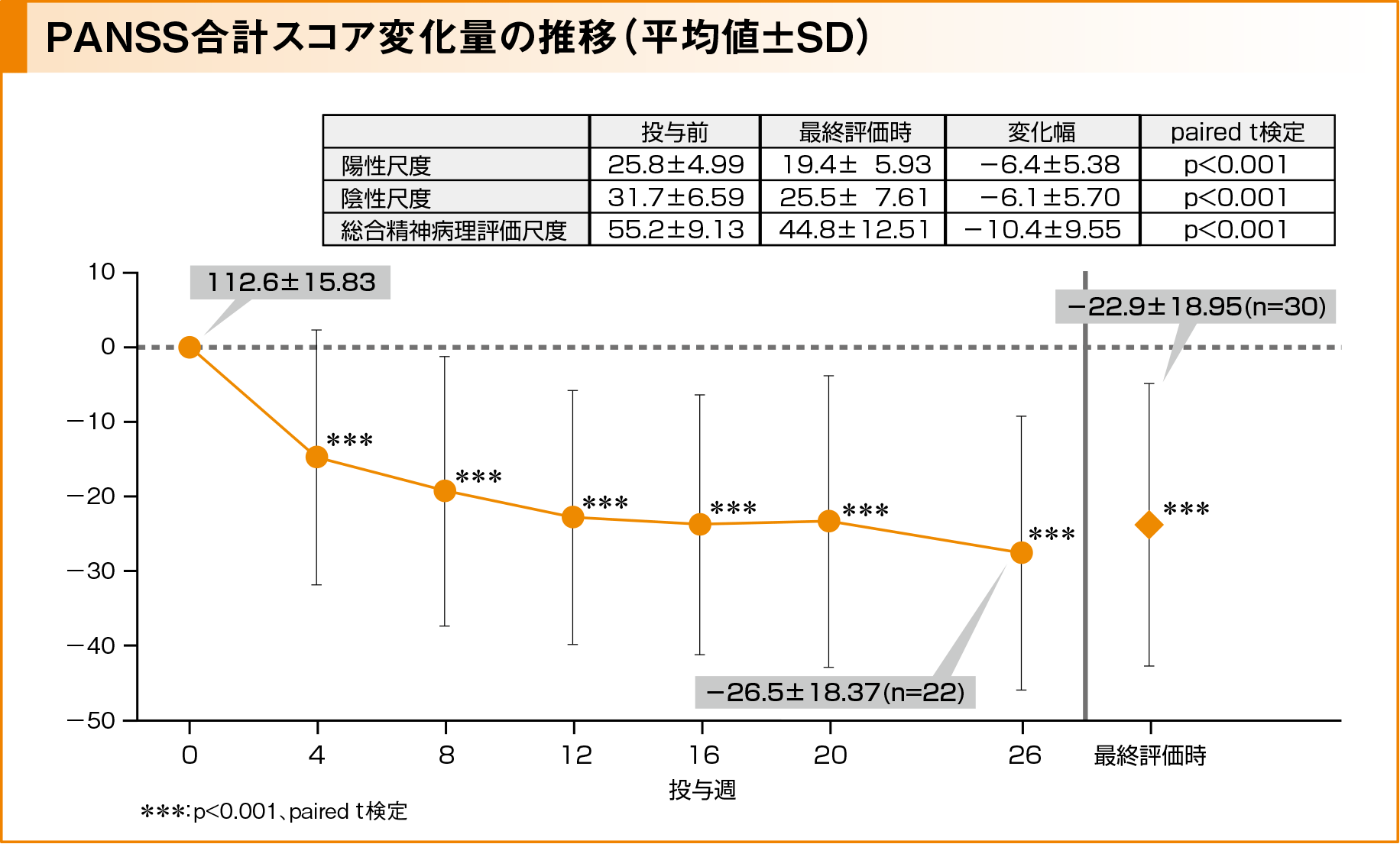
主要評価項目:PANSS合計スコア変化量の推移
PANSS合計スコアは投与前の112.6±15.38(平均値±標準偏差、以下同様)から投与4週後より減少を示し、最終評価時では−22.9±18.95(95%CI: ー30.0, ー15.8)の有意な変化が示されました(p<0.001、paired t検定による群内比較)。また、有効性評価対象例で、PANSSの尺度別の「陽性尺度」「陰性尺度」「総合精神病理評価尺度」について、合計スコアとその変化幅を検討したところ、減少幅は「陽性尺度」で6.4±5.38、「陰性尺度」で6.1±5.70、「総合精神病理評価尺度」で10.4±9.55であり、いずれの尺度においても、投与前と比較して最終評価時で減少が示されました。
■ 安全性
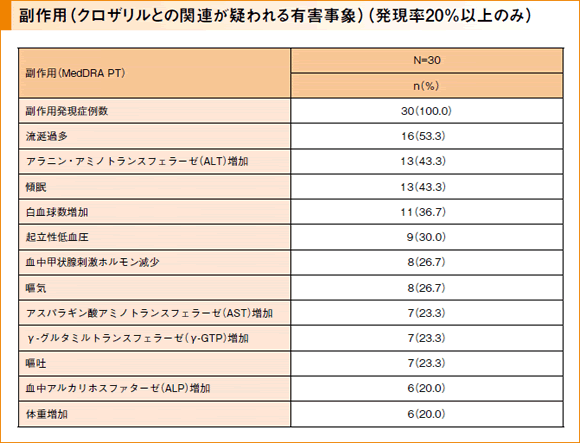
主要評価項目:副作用*
副作用は30例すべてに計289件認められました。特に発現率が高かった副作用は、流涎過多16例(53.3%)で、以下、アラニン・アミノトランスフェラーゼ増加13例(43.3%)、傾眠13例(43.3%)、白血球数増加11例(36.7%)、起立性低血圧9例(30.0%)でした。
重篤な副作用として、無顆粒球症1件、感染1件、C-反応性蛋白増加1件、肺炎1件、心膜疾患1件、心膜炎1件、痙攣1件、悪性症候群1件が認められました。また、本試験において死亡例は認められませんでした。投与中止にいたった副作用として、好中球減少症3件、駆出率減少1件、心膜疾患1件、心膜炎1件、無顆粒球症1件、白血球減少症1件が認められました。
*クロザリルとの関連が疑われる有害事象
また、本試験において、1例(3.3%)に無顆粒球症が発現しましたが、血液モニタリングの運用システムの基準に従い、投与は中止され、患者は回復しました。
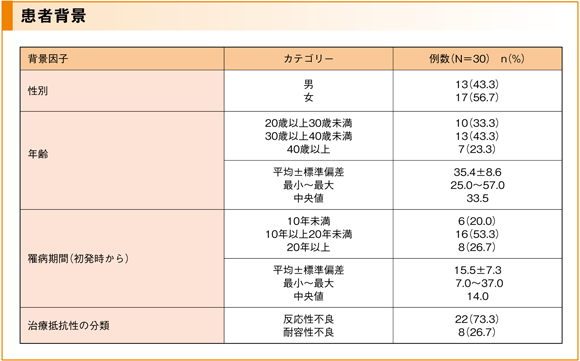
■ 患者背景
| 主要文献 2)社内資料:Clozapine(LX100-129)の治療抵抗性統合失調症に対する臨床試験(CLEX123J1201)[承認時評価資料(後期第Ⅱ相試験) |
クロザリルのお問い合わせ
デジタルコミュニケーターもしくはノバルティスダイレクトへお問い合わせください。
デジタルコミュニケーター
電話番号 0800-222-8814(通話料無料)
業務時間 月〜金 9:00~17:30(祝日及び当社休日を除く)
ノバルティスダイレクト
電話番号 0120-003-293(通話料無料)
受付時間 月〜金 9:00~17:30(祝日及び当社休日を除く)
