ルタテラ 臨床成績
「警告・禁忌を含む注意事項等情報」等は電子添文をご参照ください。
|
本試験は参考資料として提出した試験であり、一部承認外の成績が含まれますが、承認審査の過程で評価された成績のため掲載しています。
|
海外第Ⅰ/Ⅱ相試験:Erasmus MC試験(海外データ)1)
1)承認時評価資料:海外第Ⅰ/Ⅱ相試験(Erasmus MC試験)
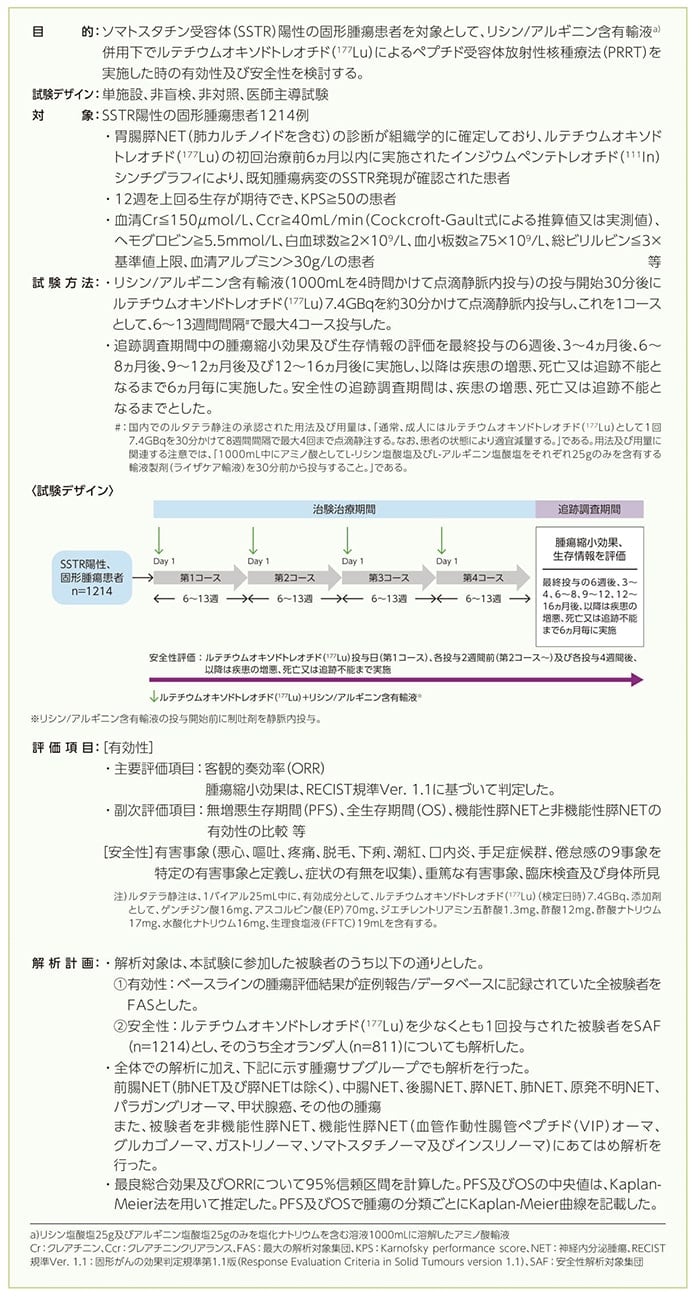
患者背景

年齢、BMIは平均値±標準偏差、初回のNET診断/転移診断から登録までの期間は中央値(最小値, 最大値)、その他は例数で示した。[ ]内は例数が異なる場合に、該当する例数を記載した。
BMI:体格指数
a)インジウムペンテトレオチド(111In)腫瘍集積スコア(Krenning’s scale)
Kwekkeboom DJ, et al. J Clin Oncol. 2005; 23(12): 2754-2762.
主要評価項目:客観的奏効率(ORR)
FAS全体におけるORRは42.7%(247/578例)でした。腫瘍タイプ別のORRは、膵NET63.9%(108/169例)、前腸NET58.3%(7/12例)、中腸NET 32.1%(70/218例)、後腸NET46.2%(6/13例)、肺NET33.3%(7/21例)、原発不明NET42.0%(37/88例)、パラガングリオーマ16.7%(3/18例)、甲状腺癌15.0%(3/20例)、その他の腫瘍31.6%(6/19例)でした。
ORR[全体、腫瘍タイプ別(サブグループ解析)](FAS)
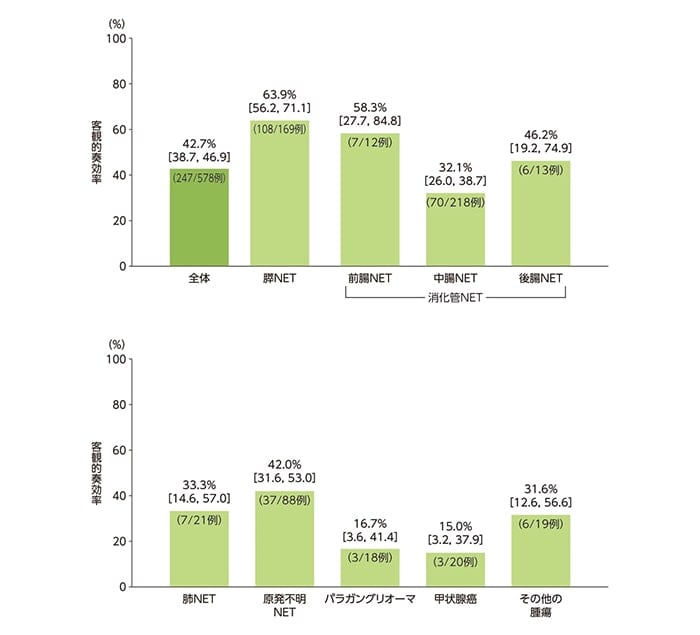
[ ]:95%信頼区間(CI)
ORRはCR+PRの患者の割合とした。CR:完全奏効、PR:部分奏効
副次評価項目:無増悪生存期間(PFS)
FAS全体におけるPFSイベントは350件認められました。PFS中央値は全体で26.7ヵ月であり、腫瘍タイプ別では、膵NET30.3ヵ月、前腸NET43.9ヵ月、中腸NET27.4ヵ月、後腸NET29.4ヵ月、肺NET18.4ヵ月、原発不明NET29.1ヵ月、パラガングリオーマ50.8ヵ月、甲状腺癌9.7ヵ月、その他の腫瘍13.2ヵ月でした。
PFS[全体、腫瘍タイプ別(サブグループ解析)](FAS)
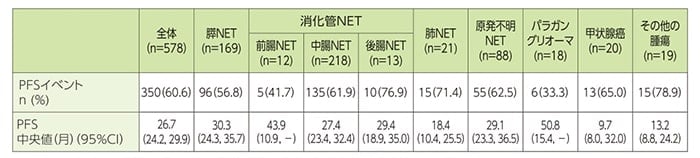
PFSは、初回治療から客観的増悪又は死因を問わない死亡までの期間とし、Kaplan-Meier法を用いて推定した。
CI:信頼区間
副次評価項目:全生存期間(OS)
FAS全体におけるOSイベントは273件認められました。OS中央値は全体で60.1ヵ月であり、腫瘍タイプ別では、膵NET66.4ヵ月、中腸NET55.6ヵ月、肺NET50.6ヵ月、原発不明NET53.2ヵ月、甲状腺癌43.1ヵ月、その他の腫瘍29.0ヵ月でした。なお、前腸NET、後腸NET及びパラガングリオーマではOS中央値は未到達でした。
OS[全体、腫瘍タイプ別(サブグループ解析)](FAS)
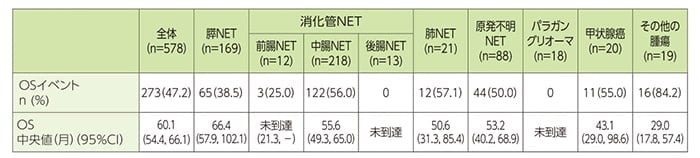
OSは、初回の治療日から死亡日まで、もしくは追跡不能となった被験者の最終観察日までの期間から、Kaplan-Meier法を用いて算出した。
CI:信頼区間
副次評価項目:機能性膵NETと非機能性膵NETの有効性の比較
膵NETの被験者(オランダ人のみ)を機能性と非機能性の2つのサブタイプに分類して比較したORRは、それぞれ75.0%及び58.4%でありPFS中央値はそれぞれ32.7ヵ月及び30.3ヵ月でした。
機能性膵NETと非機能性膵NETの有効性の比較(サブグループ解析)(オランダ人)
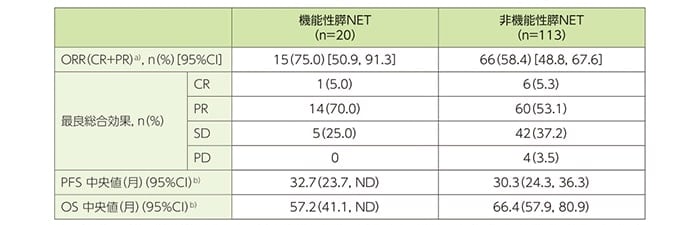
症例報告書/データベースから血管作動性腸管ぺプチド(VIP)オーマ、グルカゴノーマ、ガストリノーマ、ソマトスタチノーマ及びインスリノーマ等の膵NETの症状を有する被験者を機能性膵NETとして分類した。
a)ORRはCR+PRの患者の割合とした。
b)Kaplan-Meier法を用いて推定した。
※FDAと協議の上でオランダ人のみを有効解析対象とされた。
海外では上記のデータで承認されており、本邦の承認審査においてもオランダ人のみのデータで評価されている。
ORR:客観的奏効率、PFS:無増悪生存期間、OS:全生存期間、CR:完全奏効、PR:部分奏効、SD:安定、PD:進行、ND:未確定、CI:信頼区間
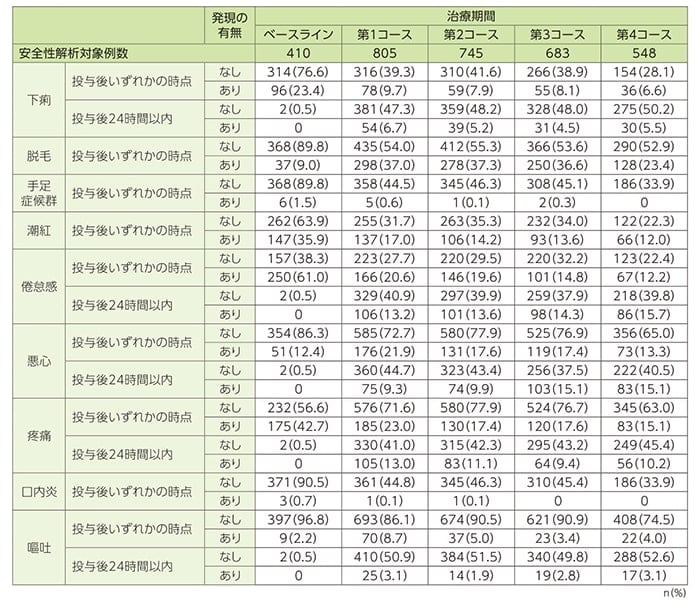
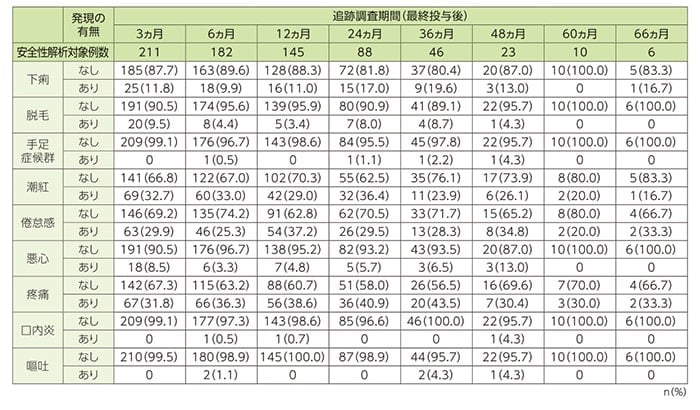
安全性(SAF n=1214)
- 重篤な有害事象
重篤な有害事象は、治験治療下で1214例中626例(51.6%)に認められました。発現頻度が1%以上の重篤な有害事象は、汎血球減少症a)97例(8.0%)、下痢57例(4.7%)、死亡55例(4.5%)、腹痛54例(4.4%)、貧血49例(4.0%)、嘔吐46例(3.8%)、発熱40例(3.3%)、悪心39例(3.2%)、血小板減少症37例(3.0%)、脱水31例(2.6%)、倦怠感30例(2.5%)、呼吸困難28例(2.3%)、便秘26例(2.1%)、肺炎25例(2.1%)、痛み、胆嚢摘出術各20例(1.6%)、腹水、腹腔ドレナージ各19例(1.6%)、骨髄異形成症候群17例(1.4%)、輸血15例(1.2%)、腸閉塞、低血圧各14例(1.2%)、高カルシウム血症、体重減少、ステント留置、上腹部痛各13例(1.1%)、イレウス、心不全、腎不全、中枢神経系への転移各12例(1.0%)でした。
本試験は、治験の中止を伴う有害事象は評価されませんでした。
- 死亡例
本試験において、ルテチウムオキソドトレオチド(177Lu)最終投与後30日以内に死亡した被験者は22例(1.8%)でしたが、いずれも治験治療との因果関係なしと判定されました。
a)汎血球減少症は、血小板数、赤血球数及び白血球数が同時に減少した場合に分類し、ヘモグロビン、白血球数及び血小板数のうち、1つでもGrade3又は4と判定された場合、治験治療下での重篤な有害事象/副作用と判定した。
※解析計画はSAF全体の解析であり、有害事象の発現例数及び発現率を記載すべきであるが、本試験においては該当データがない。ただし、海外では、SAFの重篤な有害事象、死亡例のデータで承認されており、本邦の承認審査においても上記のデータで評価されている。
安全性[特定の有害事象(9事象)の症状の有無(オランダ人 n=811)]
オランダ人の被験者(n=811)において特定の有害事象として定義した9事象(悪心、嘔吐、疼痛、脱毛、下痢、潮紅、口内炎、手足症候群、倦怠感)のうち、第1コース終了後に発現頻度が最も高かった事象は脱毛でした。脱毛の発現頻度は、ベースラインでは410例中37例(9.0%)、第1コース終了後には805例中298例(37.0%)、第2コース終了後には745例中278例(37.3%)、第3コース終了後には683例中250例(36.6%)、第4コース終了後には548例中128例(23.4%)に認められました。その後の追跡調査では、最終投与終了後3ヵ月では211例中20例(9.5%)となり、60ヵ月後では0%でした。
悪心及び嘔吐については、第1コース終了後が最も高頻度であり、それぞれ805例中176例(21.9%)と25例(3.1%)に認められました。第4コース終了後では548例中73例(13.3%)と17例(3.1%)であり、追跡調査では最終投与終了後3ヵ月では211例中18例(8.5%)と0例(0%)、60ヵ月後には両事象とも0%になりました。
観察期間中に最も頻度が高かった事象は疼痛でした。疼痛の発現頻度は、ベースラインでは410例中175例(42.7%)であり、第1コース終了後には805例中185例(23.0%)、第4コース終了後には548例中56例(10.2%)でした。その後の追跡調査では、最終投与終了後36ヵ月では46例中20例(43.5%)、60ヵ月後では10例中3例(30%)、66ヵ月後では6例中2例(33.3%)に認められました。
特定の有害事象(9事象)の症状の有無(オランダ人)