ルタテラ 臨床成績
「警告・禁忌を含む注意事項等情報」等は電子添文をご参照ください。
|
本試験は一部承認外の成績が含まれますが、国内承認申請資料として提出し、評価されているため掲載しています。
|
海外第Ⅲ相試験:NETTER-1試験(海外データ)[検証試験]1)
1)承認時評価資料:海外第Ⅲ相試験(NETTER-1試験)
患者背景(FAS)
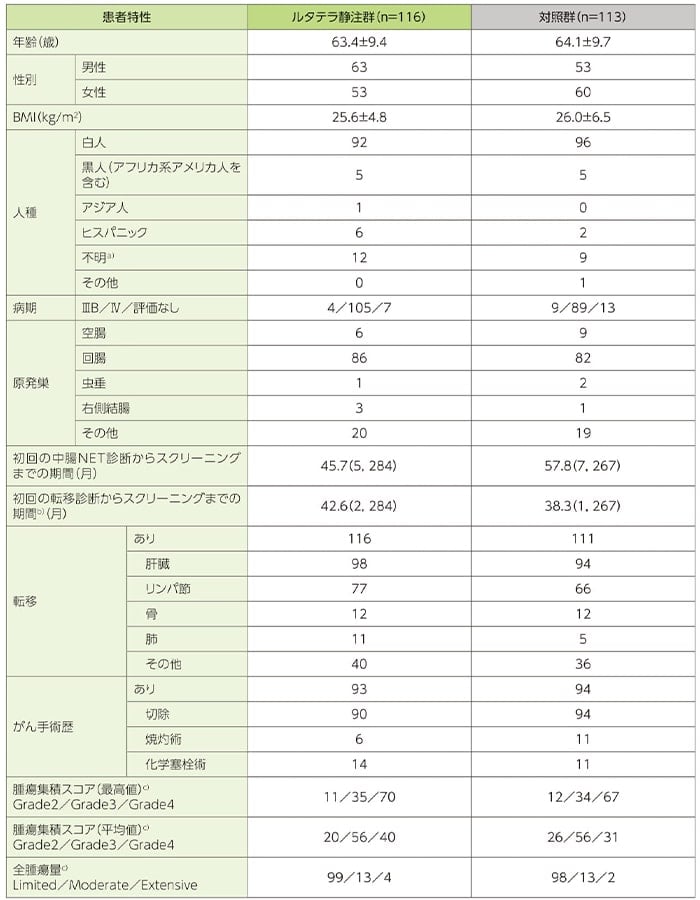
年齢及びBMIは平均値±標準偏差、初回の中腸NET診断/転移診断からスクリーニングまでの期間は中央値(最小値, 最大値)、その他は例数で示した。
a)各地域の要件や法的制限により人種の記載ができなかった被験者
b)初回の転移診断からの期間を算出した症例はルタテラ静注群が115例、対照群が111例であった。
c)インジウムペンテトレオチド(111In)による中央判定
BMI:体格指数
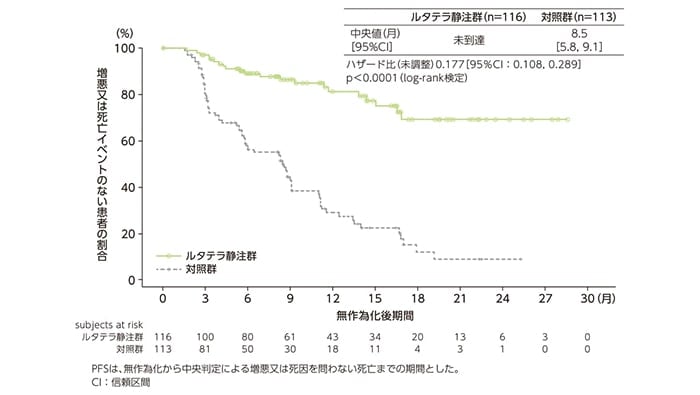
主要評価項目:無増悪生存期間(PFS)(検証的解析結果)[データカットオフ時点]
増悪(中央判定)又は死亡のイベントが発現した症例は、ルタテラ静注群116例中21例(18.1%)及び対照群113例中70例(61.9%)でした。PFS中央値は、ルタテラ静注群では未到達、対照群では8.5ヵ月(95%CI:5.8, 9.1)であり、ルタテラ静注群で有意な延長が認められ、増悪又は死亡イベントの発生リスクを82%低減しました[ハザード比0.177(95%CI:0.108, 0.289)、p<0.0001;log-rank検定]。
PFSのKaplan-Meier曲線(FAS)
副次評価項目:客観的奏効率(ORR)[データカットオフ時点]
FASにおける中央判定結果の欠落がない被験者202例の最良総合効果は、CR及びPRが、ルタテラ静注群でそれぞれ1例及び14例、対照群でそれぞれ0例及び4例であり、ORRはルタテラ静注群14.7%(15/102例)及び対照群4.0%(4/100例)であり、両群間に有意差が認められました(p=0.0141;Fisher正確検定)。
ORRa)及び最良総合効果(FAS)

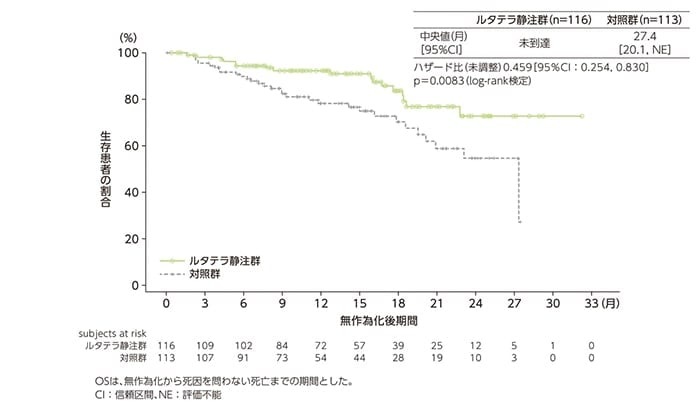
副次評価項目:全生存期間(OS)[データカットオフ時点]
OS中間解析のハザード比は0.459(95%CI:0.254, 0.830)でした[中間解析時点の暫定p=0.0083;log-rank検定で、O’Brien-Fleming法で調整した有意水準(α=0.000085)に未到達]。
OSのKaplan-Meier曲線(FAS)
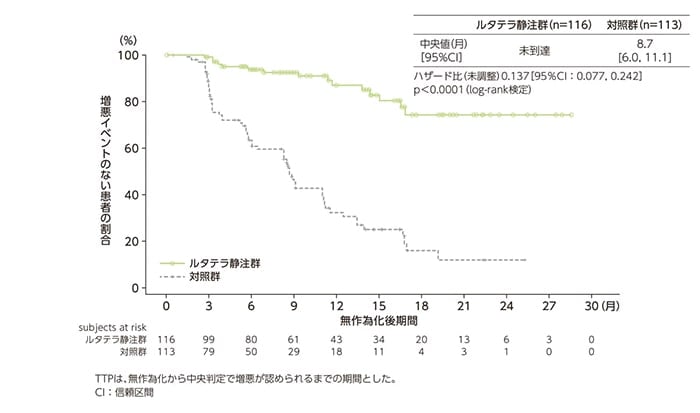
副次評価項目:無増悪期間(TTP)[データカットオフ時点]
増悪イベント(中央判定)が発現した症例は、ルタテラ静注群116例中15例(12.9%)及び対照群113例中61例(54.0%)でした。TTP中央値は、ルタテラ静注群では未到達、対照群では8.7ヵ月(95%CI:6.0, 11.1)であり、ルタテラ静注群で有意な延長が認められ、増悪イベントの発生リスクを86%低減しました[ハザード比0.137(95%CI:0.077, 0.242)、p<0.0001;log-rank検定]。
TTPのKaplan-Meier曲線(FAS)
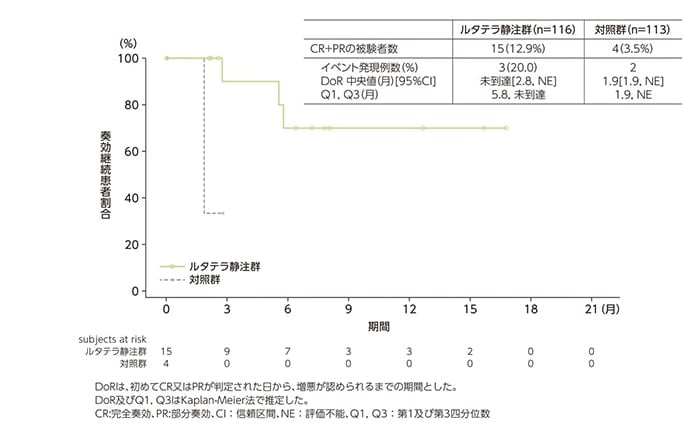
副次評価項目:奏効期間(DoR)[データカットオフ時点]
CR又はPRと判定されたルタテラ静注群15例及び対照群4例におけるDoR中央値は、それぞれ未到達及び1.9ヵ月でした。
DoRのKaplan-Meier曲線(FAS)
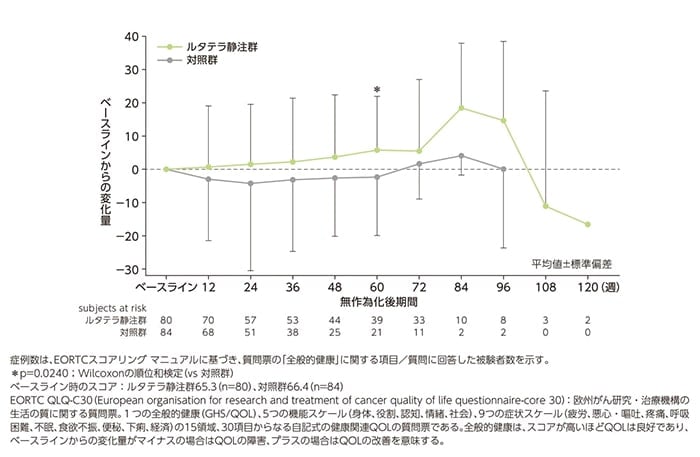
<参考情報>副次評価項目:生活の質(QOL)評価[データカットオフ時点]
EORTC QLQ-C30調査票を用いた健康関連QOL評価におけるルタテラ静注群の全般的健康スコアは、以下のように推移しました。
EORTC QLQ-C30調査票の全般的健康スコアの変化(FAS)
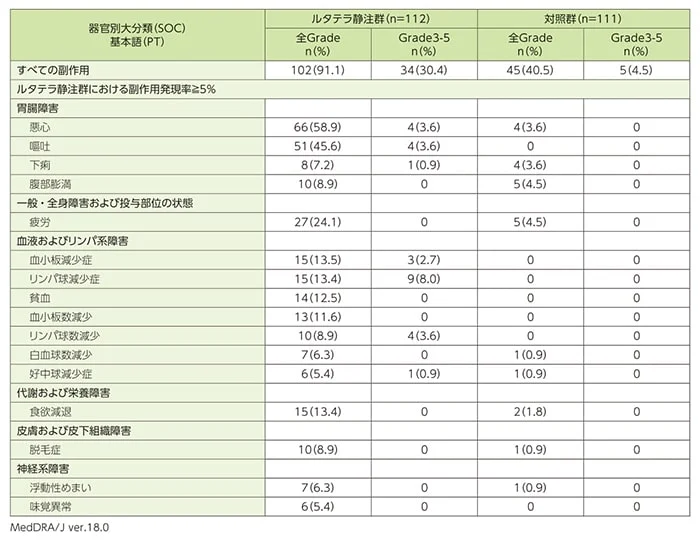
安全性[データカットオフ時点]
副作用の発現率は、ルタテラ静注群91.1%(102/112例)及び対照群40.5%(45/111例)でした。
- 主な副作用
ルタテラ静注群の主な副作用(5%以上)は、悪心58.9%(66/112例)、嘔吐45.6%(51/112例)、疲労24.1%(27/112例)、血小板減少症13.5%(15/112例)、リンパ球減少症及び食欲減退各13.4%(15/112例)、貧血12.5%(14/112例)、血小板数減少11.6%(13/112例)、腹部膨満、リンパ球数減少及び脱毛症各8.9%(10/112例)、下痢7.2%(8/112例)、白血球数減少及び浮動性めまい各6.3%(7/112例)、好中球減少症及び味覚異常各5.4%(6/112例)でした。
対照群の主な副作用は、腹部膨満、疲労及び高血糖が各4.5%(5/111例)でした。
- 重症度がGrade3以上と判定された副作用
重症度がGrade3以上と判定された副作用は、ルタテラ静注群で34例(30.4%)及び対照群で5例(4.5%)に認められました。
ルタテラ静注群で発現率5%以上の副作用のうち、Grade3以上は、リンパ球減少症9例(8.0%)、悪心、嘔吐、リンパ球数減少各4例(3.6%)、血小板減少症3例(2.7%)、下痢、好中球減少症各1例(0.9%)であり、これらの副作用は対照群では認められませんでした。
- 重篤な副作用
ルタテラ静注群で13例(11.6%)に認められ、そのうちルタテラ静注に関連すると判定された重篤な副作用は9例(8.0%)で、急性腎不全3例(2.7%)、多血球系異形成を伴う不応性血球減少症、気道感染、リンパ球減少症、腸閉塞、好中球減少症、単系統の異形成を伴う不応性血球減少症、腹水が各1例(0.9%)、リシン/アルギニン含有輸液に関連すると判定された重篤な副作用は3例(2.7%)で、肝性脳症、嘔吐、失神、脱水が各1例(0.9%)、徐放性オクトレオチドに関連すると判定された重篤な副作用は注射部位過敏反応1例(0.9%)でした。
対照群の重篤な副作用は3例(2.7%)に認められ、胃排出不全、急性胆嚢炎、カルチノイドクリーゼが各1例(0.9%)でした。
- 治験中止に至った副作用
ルタテラ静注群で8例(7.1%)に認められ、汎血球減少症、多血球系異形成を伴う不応性血球減少症、血小板減少症、悪心、腹水、注射部位過敏反応、血中クレアチニン増加、食欲減退並びに睡眠障害が各1例(0.9%)でした。ただし、悪心はリシン/アルギニン含有輸液投与後に発現したことからリシン/アルギニン含有輸液に関連すると判定され、注射部位過敏反応は投与開始後572日目に発現したことから徐放性オクトレオチドと関連すると判定されました。
対照群に認められた治験中止に至った副作用は、悪心及び疲労が発現した1例(0.9%)でした。
- 投与中止に至った有害事象
ルタテラ静注の投与中止に至った有害事象は14例(12.5%)に認められ、急性腎不全3例(2.7%)、血小板減少症2例(1.8%)、貧血、リンパ球減少症、汎血球減少症、腎機能障害、血中クレアチニン増加、血中カリウム減少、リンパ球数減少、急性呼吸不全、咳嗽、呼吸困難、腹水、悪心、悪寒、医療機器挿入合併症、食欲減退、高血糖、心停止、敗血症、多血球系異形成を伴う不応性血球減少症、睡眠障害及びショックが各1例(0.9%)でした。
対照群の投与中止に至った有害事象は、16例(14.4%)に認められ、悪性新生物進行5例(4.5%)、嘔吐、疲労が各2例(1.8%)、悪心、腹痛、胃腸管閉塞、小腸閉塞、無力症、全身健康状態低下、全身性浮腫、血中アルブミン減少、急性腎不全、蛋白尿、腎機能障害、冠動脈攣縮、筋力低下、血栓性脳梗塞、寝汗が各1例(0.9%)でした。
- 死亡例
本試験において、治験薬投与期間中又は投与終了後28日以内の死亡例はルタテラ静注群で7例(6.3%)及び対照群で9例(8.1%)であり、いずれも治験薬との因果関係なしと判定されました。
副作用一覧(重症度別:すべての副作用、ルタテラ静注群≧5%)(SAF)