ルタテラ 臨床成績
「警告・禁忌を含む注意事項等情報」等は電子添文をご参照ください。
|
国内第Ⅰ/Ⅱ相試験:P-1515-12試験1)
1)承認時評価資料:国内第Ⅰ/Ⅱ相試験(P-1515-12試験)

患者背景(FAS)
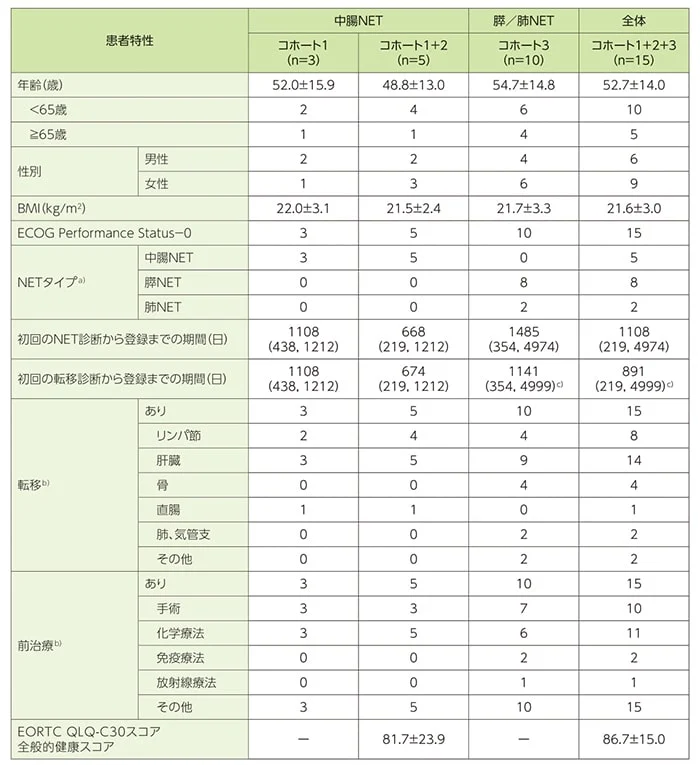
年齢(カテゴリー別を除く)、BMI及びEORTC QLQ-C30スコア(ベースライン値)は平均値±標準偏差、初回のNET診断/転移診断から登録までの期間は中央値(最小値, 最大値)、その他は例数で示した。
a)中腸NET以外の消化管NET患者の組み入れはなかった。
b)複数回答
c)1例欠落のため、コホート3がn=9、コホート1+2+3がn=14
BMI:体格指数
主要評価項目:中央判定による客観的奏効率(ORR)(confirmationなし)[DLP時点]
中腸NET患者5例の最良総合効果(confirmationなし)は、CRが1例、PRが2例であり、客観的奏効達成例は3例でした。
また、全NET患者a)15例の最良総合効果(confirmationなし)は、CRが1例(6.7%)、PRが6例(40.0%)であり、ORRは46.7%(90%CI:24.4, 70.0)でした。
中央判定による最良総合効果及びORR(confirmationなし)(FAS)
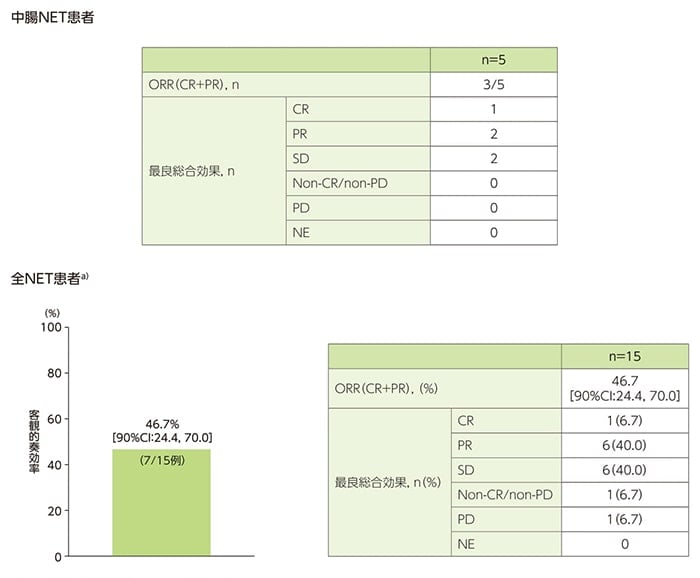
a)膵、消化管(中腸NET5例を含む)又は肺NET患者
ORRはCR+PRの患者の割合とし、90%信頼区間(CI)は、Clopper-Pearson正確信頼区間(両側)で示す。
CR:完全奏効、PR:部分奏効、SD:安定、PD:進行、NE:評価不能、DLP:データロックポイント
全NET患者a)でのNon-CR/non-PDの1例を除く14例における中央判定での標的病変の径和(最小値)のベースラインからの縮小率は下図の通りでした(非標的病変の増悪にてPDと判定された1例を含む)。
中央判定での標的病変の径和の縮小率を示したWaterfall plot(全NET患者a))[DLP時点]
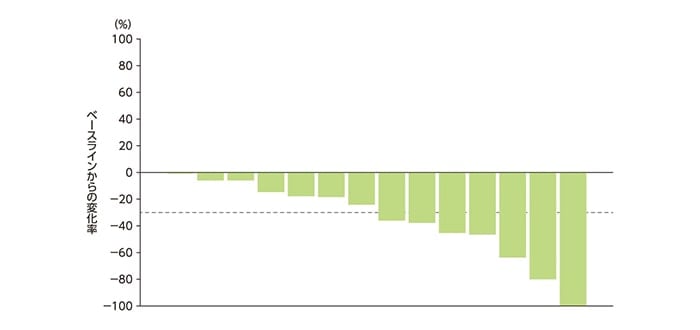
a)膵、消化管(中腸NET5例を含む)又は肺NET患者
標的病変の径和がベースライン径和と比べ30%以上減少が認められる場合、PRと判定する(標的病変の効果判定規準については、国内第Ⅰ相試験参照)。
副次評価項目:
中央判定による客観的奏効率(ORR)(confirmationあり)/
中央判定によるクリニカルベネフィット率(CBR)(confirmationあり)[DLP時点]
中腸NET患者5例の最良総合効果(confirmationあり)は、CRが1例、PRが2例、SDが2例であり、客観的奏効達成例は3例、クリニカルベネフィット達成例は5例でした。また、全NET患者a)15例の最良総合効果(confirmationあり)は、CRが1例(6.7%)、PRが5例(33.3%)、SDが7例(46.7%)、Non-CR/non-PDが1例(6.7%)であり、ORRは40.0%、CBRは93.3%でした。
中央判定による最良総合効果、ORR及びCBR(confirmationあり)(FAS)
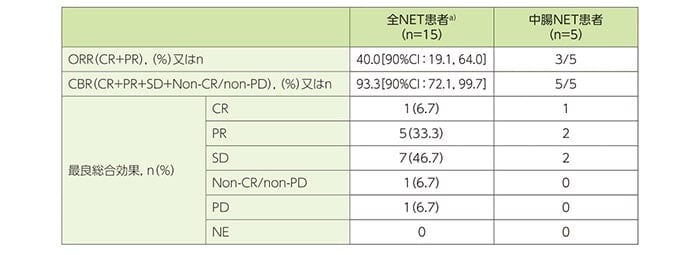
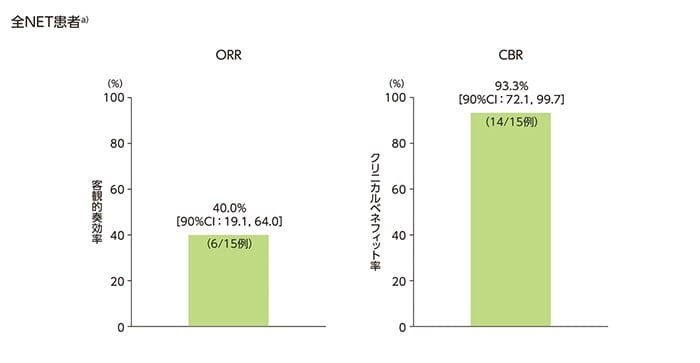
a)膵、消化管(中腸NET5例を含む)又は肺NET患者
ORRはCR+PRの患者の割合、CBRはCR+PR+SD+Non-CR/non-PDの患者の割合とし、90%信頼区間(CI)はClopper-Pearson正確信頼区間(両側)で示す。
CR:完全奏効、PR:部分奏効、SD:安定、PD:進行、NE:評価不能、DLP:データロックポイント
副次評価項目:中央判定による無増悪生存期間(PFS)[DLP時点]
中央判定による増悪又は死亡のイベントが発現した症例は、中腸NET患者5例で0例及び全NET患者a)15例で1例であり、ルタテラ静注初回投与後52週までの無増悪生存割合は、それぞれ5/5例及び93.3%でした。
中央判定によるPFS(FAS)
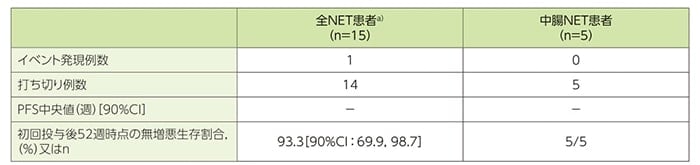
a)膵、消化管(中腸NET5例を含む)又は肺NET患者
CI:信頼区間、DLP:データロックポイント
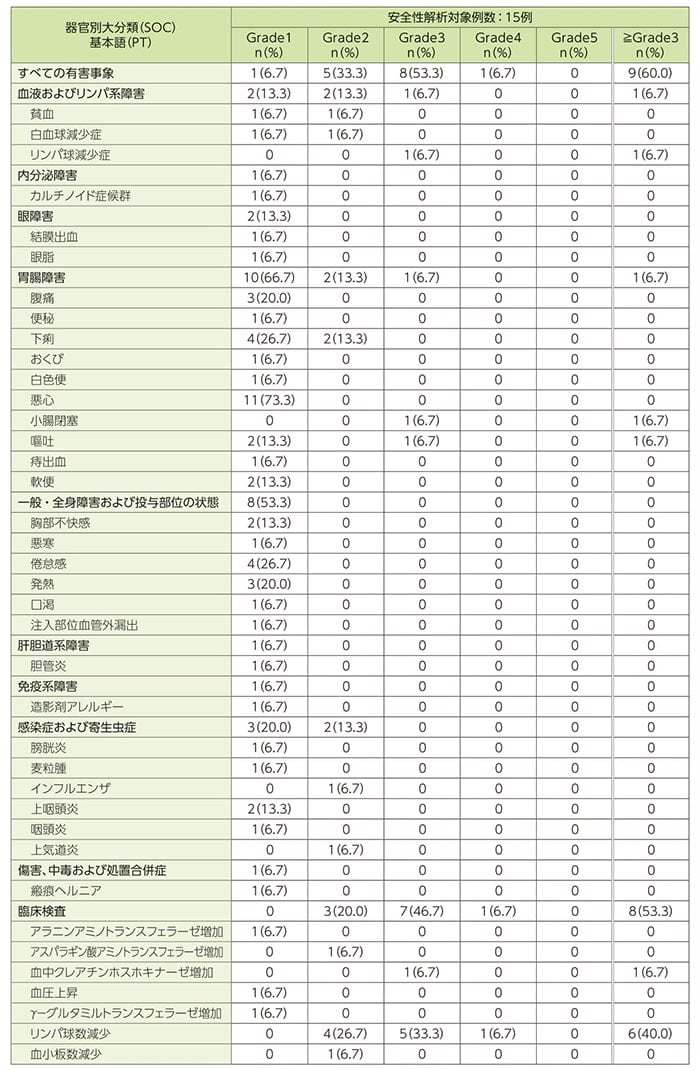
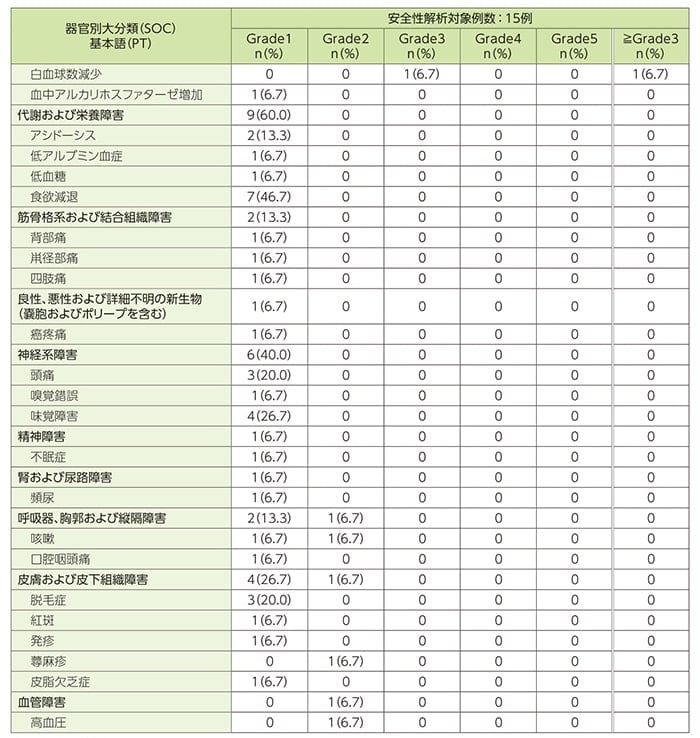
安全性[DLP時点]
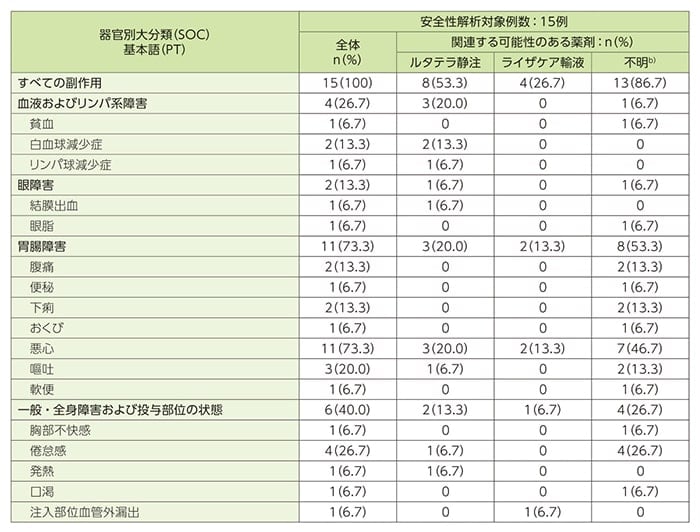
治験薬に関連すると判定された副作用(ルタテラ静注、ライザケア輸液及び不明を含む)は15例中15例に認められました。
- 主な副作用(2例以上)
悪心11例(73.3%)、リンパ球数減少10例(66.7%)、食欲減退7例(46.7%)、倦怠感及び味覚障害各4例(26.7%)、嘔吐及び脱毛症各3例(20.0%)、下痢、腹痛、頭痛、白血球減少症及びアシドーシス各2例(13.3%)でした。ルタテラ静注に関連すると判定された副作用は8例(53.3%)に認められ、内訳は、リンパ球数減少6例(40.0%)、悪心3例(20.0%)、食欲減退及び白血球減少症各2例(13.3%)でした。
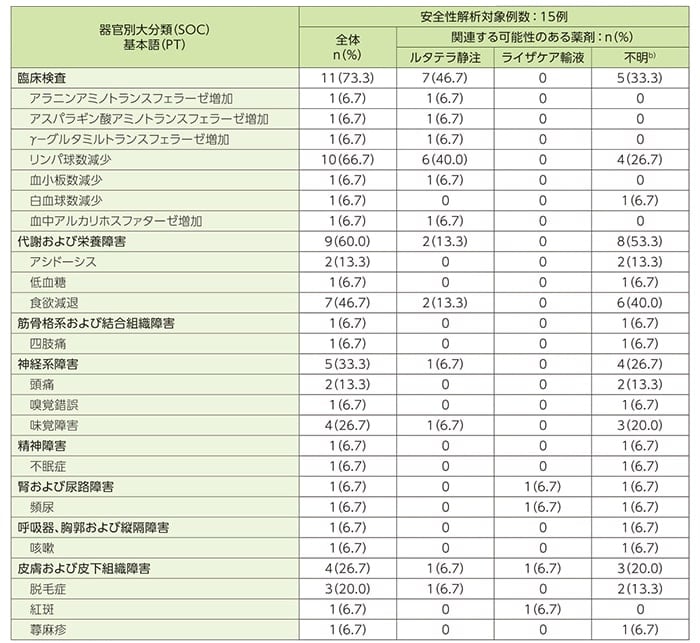
- 重症度がGrade3以上に判定された有害事象
重症度がGrade3以上に判定された有害事象は9例(60.0%)であり、そのうちGrade3が8例(53.3%)、Grade4が1例(6.7%)に認められ、Grade3では7例(46.7%)、Grade4では1例(6.7%)が治験薬との因果関係ありと判定されました。Grade3の有害事象はリンパ球数減少5例(33.3%)、リンパ球減少症、小腸閉塞、嘔吐、血中クレアチンホスホキナーゼ増加及び白血球数減少各1例(6.7%)であり、Grade4の有害事象はリンパ球数減少1例(6.7%)でした。
- 重篤な有害事象
インフルエンザ(Grade2)及び小腸閉塞(Grade3)が各1例(6.7%)認められ、いずれも治験薬との因果関係なしと判定されました。
- 治験の中止に至った有害事象
治験の中止に至った有害事象は認められませんでした。
- 投与量減量に至った有害事象
用量調整毒性(国内第Ⅰ相試験参照)に該当する有害事象として、血小板数減少(Grade2)が1例(6.7%)認められました。第3コースの治療で事象が認められ、第4コースの投与を延期のうえ、本剤を減量(半量)して行いました。
- 死亡例
本試験において死亡例は認められませんでした。
DLP:データロックポイント
副作用一覧a)(SAF)
MedDRA/J ver.23.0
a)副作用は、有害事象の発生と治験薬との因果関係について、時間的関連性がある、治験薬投与中止による消失、治験薬投与再開による再発、正確な既往歴の裏づけから説明可能、他に説明できる原因がない、その他、治験責任医師又は治験分担医師による判断の根拠に基づいて判定した。
b)関連すると思われる治験薬(ルタテラ静注、ライザケア輸液)が判断できない場合、「不明」と判定した。
有害事象一覧(重症度別)(SAF)
MedDRA/J ver.23.0
