ベオビュ 加齢黄斑変性(AMD)
海外第Ⅱ相試験(OSPREY:C-12-006試験)(海外データ)
有効性
(1)最高矯正視力スコアのベースラインからの変化量
(主要評価項目:12週、重要な副次評価項目:16週、その他の副次評価項目:4、8、20~56週の各評価時点)
12週及び16週の最高矯正視力スコア※1のベースラインからの変化量(最小二乗平均値)は、ベオビュ6mg群で5.75文字及び6.04文字、アフリベルセプト2mg群で6.89文字及び6.62文字でした。投与群間差(ベオビュ6mg群-アフリベルセプト2mg群)(80%信頼区間)は12週で-1.13(-4.19、1.93)文字、16週で-0.58(-3.72、2.56)文字と80%信頼区間の下限が非劣性マージンの-5文字を上回ったことから、ベオビュ6mg群のアフリベルセプト2mg群に対する非劣性が示されました(ANOVA※2)。
投与群間差の80%信頼区間の下限が0文字を下回ったことから、ベオビュ6mg群のアフリベルセプト2mg群に対する優越性は示されませんでした(ANOVA※2)。
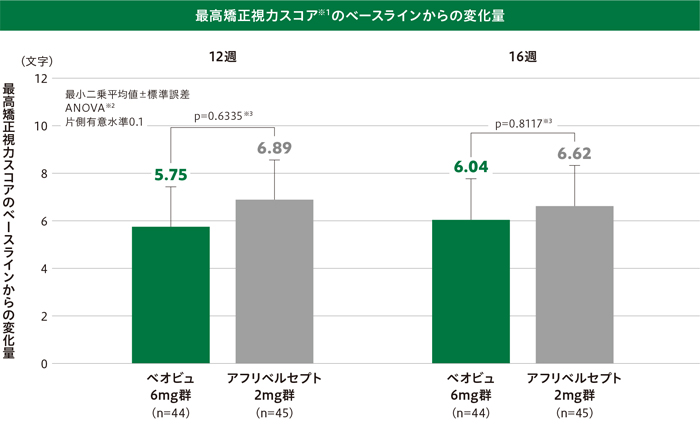

※1 欠測値はLOCF法を用いて補完
※2 投与群及びベースラインの最高矯正視力区分(<55文字、≧55文字)を因子とした
※3 片側
最高矯正視力スコア※1のベースラインからの変化量(最小二乗平均値)は、以下のように推移しました。
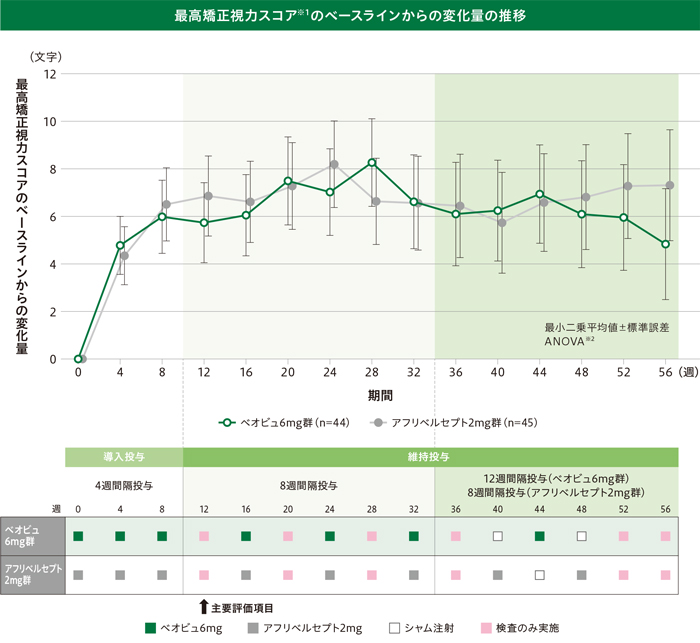
※1 欠測値はLOCF法を用いて補完
※2 投与群及びベースラインの最高矯正視力区分(<55文字、≧55文字)を因子とした
(2)中心窩網膜厚のベースラインからの変化量
(その他の副次評価項目:各評価時点)
中心窩網膜厚※1のベースラインからの変化量(最小二乗平均値)は、以下のように推移しました。
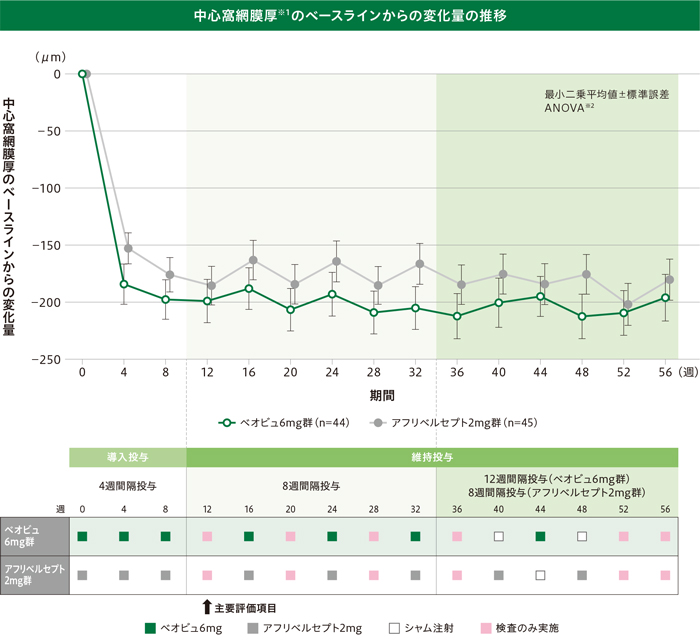
※1 欠測値はLOCF法を用いて補完
※2 投与群及びベースラインの中心窩網膜厚区分(<400μm、≧400μm)を因子とした
日本において承認されたベオビュの用法及び用量(抜粋) 〈中心窩下脈絡膜新生血管を伴う加齢黄斑変性〉 日本において承認されたベオビュの用法及び用量に関連する注意(抜粋) 〈効能共通〉 〈中心窩下脈絡膜新生血管を伴う加齢黄斑変性〉 |
