ベオビュ 加齢黄斑変性(AMD)
海外第Ⅱ相試験(OSPREY:C-12-006試験)(海外データ)
安全性
(3)安全性
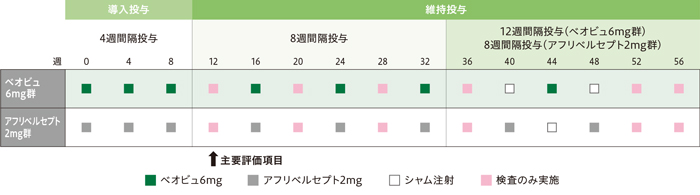
治験薬の曝露状況
各評価時点の治験薬投与患者の割合は以下のとおりです。
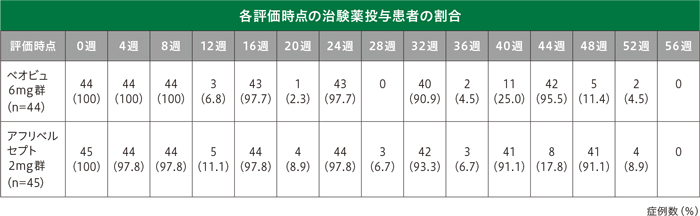
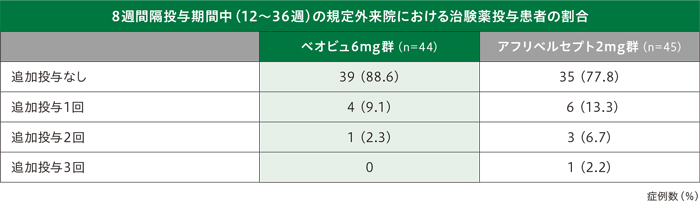
12~36週の8週間隔投与期間中、規定外の時点で治験薬が投与された患者は、ベオビュ6mg群5例(11.4%)、アフリベルセプト2mg群10例(22.2%)でした。
副作用
治療対象眼
治療対象眼における副作用発現率は、ベオビュ6mg群34.1%(15/44例)、アフリベルセプト2mg群26.7%(12/45例)でした。主な副作用は結膜出血〔ベオビュ6mg群11.4%(5/44例)、アフリベルセプト2mg群15.6%(7/45例)、以下同順〕、硝子体浮遊物〔4.5%(2/44例)、0%(0/45例)〕、視力低下〔4.5%(2/44例)、0%(0/45例)〕、硝子体出血〔4.5%(2/44例)、0%(0/45例)〕、眼圧上昇〔2.3%(1/44例)、4.4%(2/45例)〕、眼の異物感〔0%(0/44例)、4.4%(2/45例)〕、眼痛〔0%(0/44例)、4.4%(2/45例)〕でした。重篤な副作用は、ベオビュ6mg群1例(眼圧上昇)に認められました。投与中止に至った有害事象は、アフリベルセプト2mg群1例(網膜剥離)に認められましたが、治験薬及び治験薬投与手技との関連なしと判断されました。
眼以外
眼以外の副作用発現率は、ベオビュ6mg群2.3%(1/44例、心筋虚血)、アフリベルセプト2mg群2.2%(1/45例、一過性脳虚血発作)でした。死亡はベオビュ6mg群1例(心筋虚血)に認められ、治験薬との関連ありと判断されました。その他の重篤な副作用は、アフリベルセプト2mg群1例(一過性脳虚血発作)に認められました。本試験では投与中止に至った副作用の発現はありませんでした。
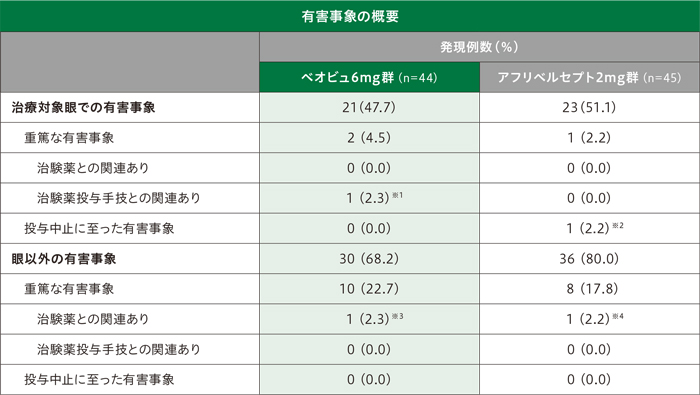
※1 眼圧上昇1例
※2 網膜剥離1例
※3 心筋虚血1例
※4 一過性脳虚血発作1例
日本において承認されたベオビュの用法及び用量(抜粋) 〈中心窩下脈絡膜新生血管を伴う加齢黄斑変性〉 日本において承認されたベオビュの用法及び用量に関連する注意(抜粋) 〈効能共通〉 〈中心窩下脈絡膜新生血管を伴う加齢黄斑変性〉 |
