ベオビュ 加齢黄斑変性(AMD)
本剤は国内外の第Ⅱ相及び第Ⅲ相試験の成績を基に評価され国内承認されました。以下で紹介する臨床試験成績には、承認範囲外の試験成績が一部含まれています(OSPREY:C-12-006試験、HAWK:C001試験)。
海外第Ⅱ相試験(OSPREY:C-12-006試験)2、3)(海外データ)
試験方法と患者背景および治療対象眼の主なベースライン特性
| 2)社内資料:海外第Ⅱ相試験(OSPREY:C-12-006試験)[20200010]承認時評価資料 3)Dugel PU, et al. Ophthalmology 2017;124(9):1296-1304[20190562] COI:本論文の著者のうち3名はノバルティスの社員である。著者にはノバルティスよりコンサルタント料/助成金を受領している者が含まれる。 |
試験方法
目的
12週〔治験薬を4週ごとに1回、連続3回投与(以下、導入投与)終了4週後〕のベオビュ6mg/50μL(以下、ベオビュ6mg)の有効性について、アフリベルセプト2mg/50μL(以下、アフリベルセプト2mg)と比較する。
試験対象
50歳以上で治療対象眼※1が未治療の活動性脈絡膜新生血管(choroidal neovascularization:CNV)を伴う滲出型加齢黄斑変性患者89例
試験デザイン
多施設共同二重遮蔽無作為化並行群間比較試験
投与方法
患者をベオビュ6mg群またはアフリベルセプト2mg群に1:1の比で無作為化し、各薬剤を4週ごとに3回導入投与した後、維持投与として32週まで8週ごとに硝子体内投与した。32週以降は、アフリベルセプト2mg群の患者はそのまま8週間隔投与を継続(40週及び48週に投与)し、ベオビュ6mg群の患者は12週間隔投与に変更した(44週に投与)。遮蔽性維持のため、ベオビュ6mg群では40週と48週に、アフリベルセプト2mg群では44週にシャム注射を実施した。また、維持投与の途中で、疾患活動性が認められた場合には遮蔽医師の判断により、投与間隔を変更してレスキュー治療として割り付けられた治験薬を投与することを可能とした。この方法により、遮蔽性は維持された。
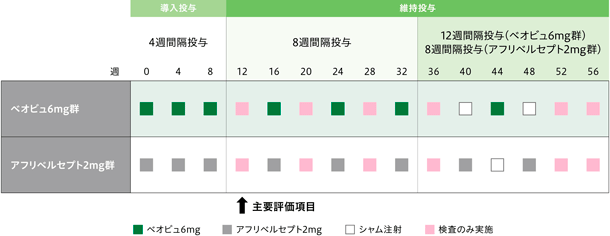
主要評価項目
最高矯正視力スコア※2のベースラインからの変化量(12週)
重要な副次評価項目
最高矯正視力スコア※2のベースラインからの変化量(16週)
その他の副次評価項目
- 最高矯正視力スコア※2のベースラインからの変化量(4、8、20~56週の各評価時点)
- 中心窩網膜厚のベースラインからの変化量(各評価時点)
※2 ETDRS文字スコア(ETDRS視力検査表を用いて測定開始距離4mで評価)
安全性評価項目
- 治験薬の曝露状況〔各評価時点の治験薬投与患者の割合、8週間隔投与期間中(12~36週)の規定外来院における治験薬投与患者の割合〕
- 有害事象(治療対象眼及び眼以外)
解析計画
| 主要評価項目・重要な副次評価項目 |
|---|
| その他の副次評価項目 |
|---|
| 安全性評価項目 |
|---|
患者背景及び治療対象眼の主なベースライン特性
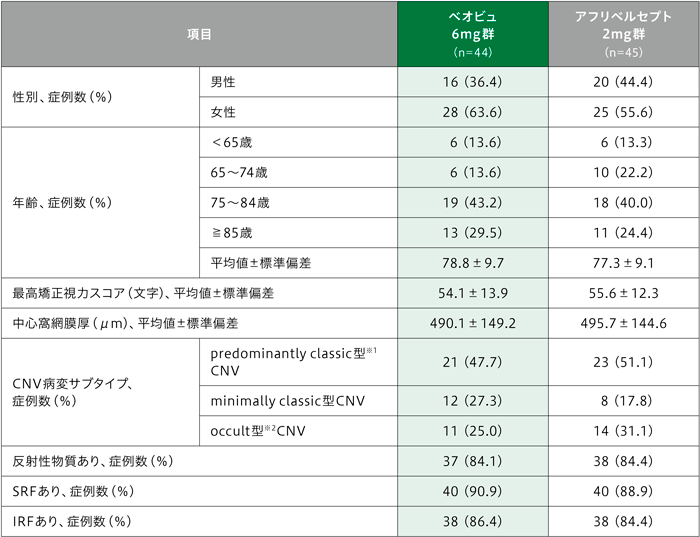
※1 predominantly classic型とpure classic型が含まれる
※2 3つのサブタイプ〔線維血管系網膜色素上皮剥離(pigment epithelial detachment:PED)、漿液性PED及び後期漏出〕のうち少なくとも1つが存在する場合
日本において承認されたベオビュの用法及び用量(抜粋) 〈中心窩下脈絡膜新生血管を伴う加齢黄斑変性〉 日本において承認されたベオビュの用法及び用量に関連する注意(抜粋) 〈効能共通〉 〈中心窩下脈絡膜新生血管を伴う加齢黄斑変性〉 |
