イラリス 臨床成績
| 「効能又は効果」、「用法及び用量」、「禁忌を含む使用上の注意」、「効能又は効果に関連する使用上の注意」、 「用法及び用量に関連する使用上の注意」については添付文書をご参照ください。 |
1. 国際共同検証試験(第Ⅲ相/N2301試験)5)
(1)二重盲検期(エポック2)
試験デザイン
目 的:
周期性発熱症候群(TNF受容体関連周期性症候群(TRAPS))の患者を対象に、イラリス150mgを4週間隔投与したときの有効性を、寛解率を指標として評価し、イラリスのプラセボに対する優越性を検証する。
対 象:
TNF受容体関連周期性症候群患者46例
投与方法:
イラリス150mg(又は2mg/kg)又はプラセボのいずれかに1:1の比で割り付け、4週間隔で投与開始した。
投与後、疾患活動性が持続する場合又は再燃が認められた場合の増量は以下のように行った。
・7日後~28日目 : イラリス150mg(又は2mg/kg)を盲検下で1回のみ追加投与可とし、29日目に増量した。
・29日目以降 : 非盲検投与へ切替え、増量した。増量は、段階的(プラセボ→150mg→300mg)に行い、イラリス300mg(又は4mg/kg)、4週間隔投与を上限とした。
イラリスの用量は各投与時の体重で規定し、体重40kgを超える患者には150mg又は300mgを、体重40kg以下の患者には2mg/kg又は4mg/kgを皮下投与した。
試験スケジュール:
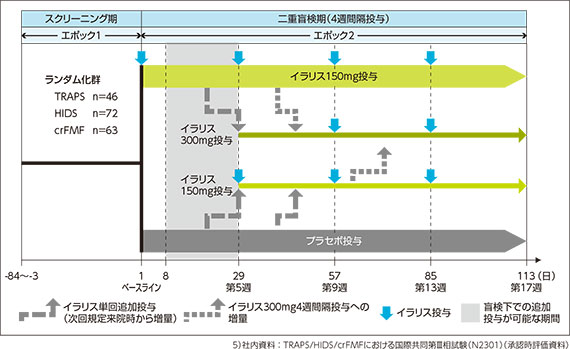
評価項目:
主要評価項目 : 寛解率
副次評価項目 : 臨床的寛解(医師による全般評価が軽微以下)の患者の割合
血清学的寛解(CRP10mg/L以下)が得られた患者の割合
血清アミロイドAの正常化が認められた患者の割合
探索的評価項目: 寛解率に対する探索的解析
医師による全般評価
解析計画:
本試験では、コホート別*及び投与期間別に解析した。Fisher’s exact検定を用いて、片側有意水準2.5%とし、イラリス群の二重盲検期の寛解率をプラセボ群と比較した。寛解率、並びにオッズ比、リスク差、及びそれぞれの95%信頼区間を算出した。95%信頼区間には正確なClopper-Pearson法を用いた。主要評価項目が達成された場合、イラリス4週間隔投与のプラセボに対する優越性を評価するために、階層的な検定手順によりすべての副次評価項目を評価した。2.5%の片側有意水準で有意差が示される限り、次の検定手順へ進んだ。
判定基準:
➀ 寛解率:投与14日後にindex flare**の寛解が得られ、かつ16週間の投与中に再燃を認めなかった患者の割合とした。
➁ index flareの寛解:ランダム化時に認められた最初の再燃をindex flareとし、14日後に以下の2つの条件を満たした場合、index flareの寛解とした。
・臨床的寛解 :医師による全般評価が軽微以下
・血清学的寛解:CRPが正常範囲内(10mg/L以下)又はベースラインと比べ70%以上の減少
➂ 再燃:再燃とは、臨床的再燃と血清学的再燃が同時に認められた場合と定義した。14日後にindex flareの寛解を認めた患者は、14日後以降にこの定義を適応した。
・臨床的再燃 :医師による全般評価が軽度以上
・血清学的再燃:CRP 30mg/L以上
④ 医師による全般評価:治験担当医師が疾患活動性の全般評価を5段階(0.症状なし、1.軽微、2.軽度、3.中等度、4.重度)で評価した。
*TRAPS、HIDS、crFMFの疾患別
**index flare:ランダム化時に認められた最初の再燃であり,本試験の有効性評価の指標となる再燃
1)患者背景

2)主要評価項目:寛解率(投与16週後)
TNF受容体関連周期性症候群において、主要評価項目である寛解率についてプラセボに対するイラリスの優越性が確認された( Fisher’s exact 検定、p=0.0050)。
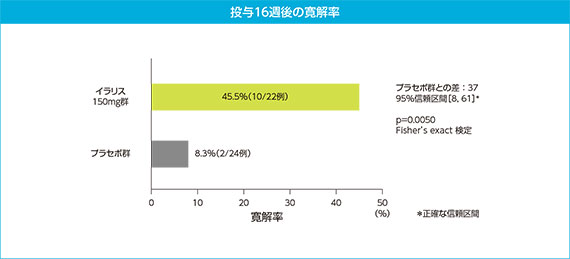
二重盲検期で増量を要したイラリス群の患者、プラセボからイラリスに切り替えた患者、及び主要評価項目を評価する前になんらかの理由により試験を中止した患者は非寛解例とみなした。
3)副次評価項目:投与16週後の臨床的寛解、血清学的寛解、血清アミロイドAの正常化
臨床的寛解、血清学的寛解及び血清アミロイドAの正常化は、イラリスがプラセボと比較して有意に高い達成率を示した(下図参照)。
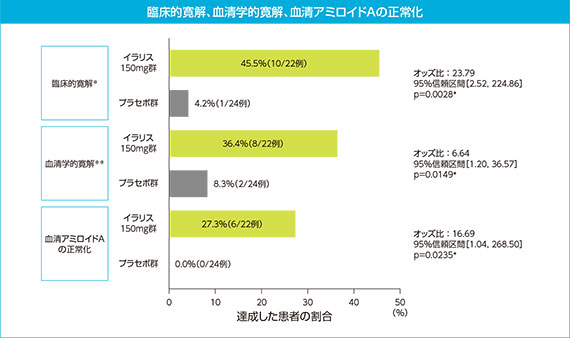
二重盲検期で増量を要したイラリス群の患者、プラセボからイラリスに切り替えた患者、及び主要評価項目を評価する前になんらかの理由により試験を中止した患者は非寛解例とみなした。
※:医師による全般評価が軽微以下 ※※:CRP(標準化されたCRP) 10mg/L以下
*:階層的検定手順に基づき、疾患別に投与群とベースライン値を説明変数としたロジスティック回帰モデルを用いて解析した結果、有意水準0.025(片側)で有意
4)探索的評価項目:
寛解率に対する探索的解析
探索的解析の結果では、主解析の寛解率[45.5%(10/22例)]と比べて72.7%(16/22例)と高くなったことから、300mgへの増量効果が示された。
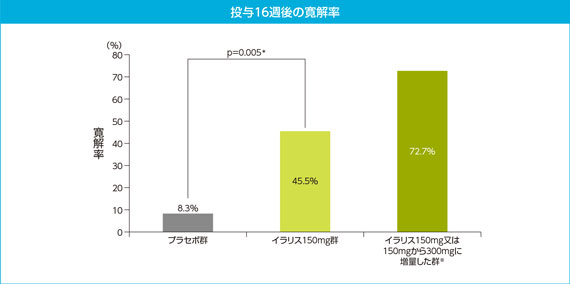
*:Fisher’s exact 検定に基づき解析した結果、有意水準0.025(片側)で有意
※:28日以前に盲検下にて150mgから300mgに増量し、29日にindex flareの寛解が<TNF受容体関連周期性症候群(TRAPS)>得られ、Day 29以降も再燃しなかった患者。
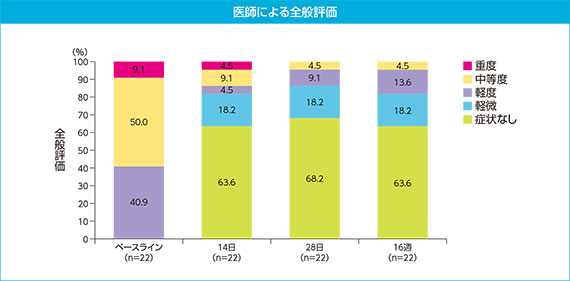
・医師による全般評価
イラリス150mgで投与開始した患者におけるベースラインの医師による全般評価は軽度9例(40.9%)、中等度11例(50.0%)、重度2例(9.1%)であった。イラリス投与後、14日で軽微以下の患者の割合が81.8%となり(症状なし14例、軽微4例)、16週までその割合(81.8%)が維持された。
5)安全性:
SAF(安全性解析対象集団)のうちランダム化群で二重盲検期に発現した有害事象、死亡、重篤な有害事象、投与中止に至った有害事象は以下の通りであった。
<TRAPSの有害事象の要約(N2301試験:16週, SAF)>
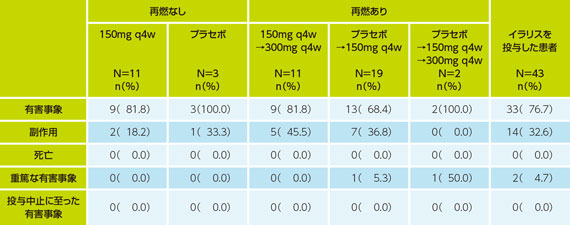
イラリス150mg群の有害事象は81.8%(9/11例)にみられ、主なものは上気道感染症2件(16.2%)、下痢及び発熱が各1件(9.1%)等であった。
プラセボ群の有害事象は100.0%(3/3例)にみられ、主なものは下痢、胃部不快感、疲労感及び尿路感染症が各1件(33.3%)等であった。
イラリス150mgから300mgに増量した群の有害事象は81.8%(9/11例)にみられ、主なものは腹痛4件(36.4%)、発熱、鼻咽頭炎及び咳が各3件(27.3%)等であった。
プラセボからイラリス150mgに変更した群の有害事象は68.4%(13/19例)にみられ、主なものはTRAPS 3件(15.8%)、上腹部痛、発熱、注射部位反応及び鼻咽頭炎が各2件(10.5%)等であった。
プラセボからイラリス150mgさらに300mgに増量した群の有害事象は100.0%(2/2例)にみられ、主なものは嚥下障害及び真菌皮膚感染症が各1件(50.0%)等であった。
イラリスを投与した患者全体の有害事象は76.7%(33/43例)にみられ、主なものは発熱6件(14.0%)、腹痛、注射部位反応及び鼻咽頭炎が各5件(11.6%)等であった。
重篤な有害事象は、プラセボからイラリス150mgに変更した群に1例(TNF受容体関連周期性症候群1件)とプラセボからイラリス150mgさらに300mgに増量した群1例(嚥下障害2件、及び喉頭狭窄、口腔咽頭痛、嘔吐が各1件)報告されたが、薬剤との関連はいずれも否定された。
(2)投与中断/投与頻度低減期(エポック3)
試験デザイン
目 的:
周期性発熱症候群(TNF受容体関連周期性症候群(TRAPS))の患者を対象に、イラリス150mgを4週間隔投与したときの有効性を、寛解率を指標として評価し、イラリスのプラセボに対する優越性を検証する。
対 象:
二重盲検期のイラリス150mg投与群でindex flareの寛解が得られ、再燃を認めることなく二重盲検期を終了した患者(TRAPS:9例)
投与方法:
イラリス150mg 4週間隔投与でindex flareの寛解が得られ、再燃を認めることなく二重盲検期を終了した患者(以下、イラリス寛解例)を、1:1の比でイラリス150mg 8週間隔投与群(以下、150mg q8w群)又はプラセボ群のいずれかに再割り付けし、二重盲検下でイラリスを投与した。再割付け後に、再燃を認めた患者は、以下のとおり非盲検投与への切替え(増量)を可とした。
・ プラセボ群に再割付けされ、8週間以下の期間内に再燃を認めた場合は、イラリス150mgの4週間隔非盲検投与へ切り替えた。
・ プラセボ群に再割り付けされ、8週間を超える期間内に再燃を認めた場合は、イラリス150mgの8週間隔非盲検投与へ切り替えた。
・ イラリス150mgの8週間隔投与群に再割り付けされ、再燃を認めた場合は、イラリス150mgの4週間隔投与に戻した。
二重盲検期に盲検下で追加投与又は非盲検投与へ切り替えた患者は、追加投与又は切り替えた(増量した)用量(150mg又は300mg)を維持しながら、非盲検下で8週間隔投与に変更した。再燃を認めた場合、4週間隔投与への変更を可とした。
試験スケジュール:
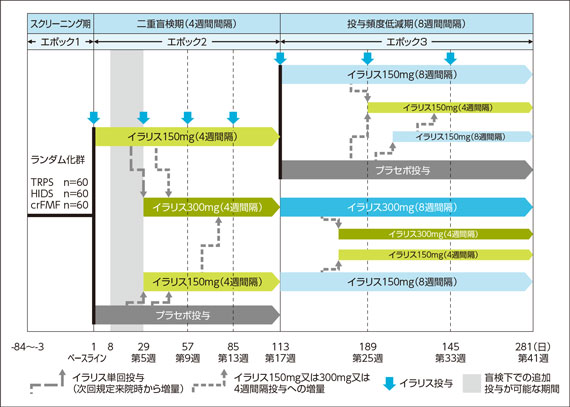
評価項目:
主要評価項目: 寛解率
副次評価項目: 投与40週後の寛解率
解析計画:
効果の持続を評価するため、副次評価項目は、再ランダム化時の投与群別(150mg 8週間隔群又はプラセボ群)に集計した。有効性は、Fisher’s exact検定に基づき解析し、有意水準0.025(片側)で有意とした。閉検定手順に基づき、TRAPSのみプラセボに対するイラリスの優越性を検証した。
判定基準:
寛解の定義
二重盲検期のイラリス寛解例が、投与中断・投与頻度低減期でイラリス8週間隔投与に変更後、投与40週後まで再燃が認められなかった場合
再燃の定義
・臨床的再燃 :医師による全般評価が軽度以上
・血清学的再燃:CRP 30mg/L以上
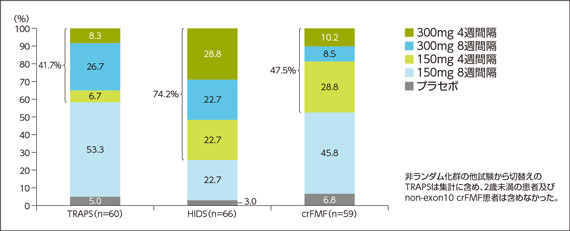
1)用法用量の内訳(試験終了時の投与量及び投与間隔)
TRAPSでは約半数が疾患活動性をコントロールするために150mg 8週間隔より高い用法用量を要した。
2)主要評価項目:エポック2参照
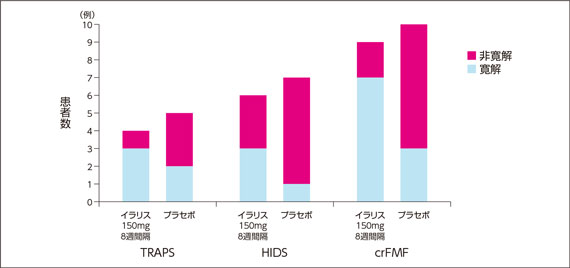
3)副次評価項目:投与40週後の寛解率
・ いずれの疾患でも、患者数は少なかった。患者数は少ないため、結果の解釈には留意が必要である。
・ 寛解が維持できた患者の割合は、プラセボ群に比べ150mg 8週間隔群で多かったものの、投与群間で有意差はみられなかった(TRAPSのみ事前に設定した閉手順にしたがい検定(p=0.3571、Fisher’s exact検定))。
4)安全性
副作用発現率は、イラリス投与群で20.5%(8/39例)であり、プラセボ継続群(3例)では認められなかった。
主な副作用は、好中球減少症、無力症、及び頭痛(各5.1%、2件)等であった。
投与中止/投与頻度低減期の死亡例はなかった。投与中止に至った副作用は57例中1例(好中球減少症)にみられた。重篤な有害事象は発現しなかった。
