イラリス 臨床成績
| 「効能又は効果」、「用法及び用量」、「禁忌を含む使用上の注意」、「効能又は効果に関連する使用上の注意」、 「用法及び用量に関連する使用上の注意」については添付文書をご参照ください。 |
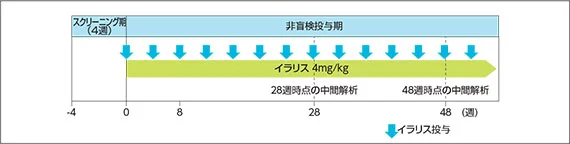
1. 国内臨床試験(第Ⅲ相/G1301試験)13)
(1)試験デザイン
目 的:
主要目的として以下を評価する。
・8週時点のAdapted ACR Pediatric 30を達成した患者の割合を指標として、イラリスの有効性を評価する。
・28週時点でイラリスの投与により副腎皮質ステロイド薬(以下ステロイド薬)を減量できた患者の割合を評価する。
評価項目:
(1)有効性
1)主要評価項目: ・8週時点でAdapted ACR Pediatric 30を達成した患者の割合
・28週時点で経口ステロイド薬を減量できた患者の割合
2)副次評価項目: ・Adapted ACR Pediatric反応基準(30/50/70/90/100の達成)を達成した患者数及び割合
・再燃が認められた患者数及び割合
・疾患非活動性の定義に該当した患者数及び割合
・経口ステロイド薬を減量できた患者数及び割合
(2)安全性
(3)薬物動態/薬力学
試験方法:
非盲検、非対照、多施設共同試験
対 象:
目標症例数 : 約20例
評価例数 : 19例
・スクリーニング時点で2歳以上20歳未満の男女
・治験組入時の3ヵ月以上前に国際リウマチ学会(ILAR)の基準でSJIAと診断され、発症時の年齢が16歳未満
・治験組入時に、疾患活動性の基準(2関節以上の活動性関節炎、初回投与前1週間以内の発熱 ; 38℃超が1日以上、CRP 30mg/L超)をすべて満たす
投与方法:
イラリス4mg/kgを4週間隔で皮下投与した。イラリスの投与1回あたりの最大用量は300mgとした。なお、8週以降は経口ステロイド薬の減量を認めた。
経口ステロイド薬漸減の手順は以下のとおりとした。
・0.1mg/kg/日を超える経口プレドニゾロン(又は等価量のステロイド薬)を使用している場合は1週間につき0.1mg/kgずつ漸減した。
・0.1mg/kg/日の経口プレドニゾロン(又は等価量のステロイド薬)を使用している場合は0.05mg/kg/日に漸減して1週間投与した。その後、0.05mg/kgの48時間毎の投与に変更して2週間投与した後投与を中止した。
試験スケジュール:
解析計画:
有効性、安全性ともイラリスが1回以上投与されたすべての患者を対象とした。本試験は患者数が少ないため、記述的に有効性の結果を提示し、統計的モデルに基づく解析及び仮説検定は行わなかった。本試験では、2回の中間解析(28週時点及び48週時点)を計画した。
判定基準:
<Adapted ACR Pediatric反応基準>
■Adapted ACR Pediatric 30、50、70、90、100の判定で評価されるコンポーネント
Adapted ACR Pediatric 30、50、70、90、100は、上記1~6のうち3項目以上がベースラインからそれぞれ30%以上、50%以上、70%以上、90%以上、100%改善し、かつ過去1週間に発熱がなく(上記7)、上記1~6のうち30%を超えて悪化した項目が1項目以下である場合をさす。 |
<疾患非活動性の定義>
■疾患非活動性(以下の基準をすべて満たすもの)
G1301試験では、上記の基準に「持続的な朝のこわばりが15分以下である」を追加した新たな疾患非活動性の定義でも評価した。 |
<再燃>
■再燃(以下のいずれか1つ以上を満たすもの)
・3つの反応基準の1つとして治験担当医師又は保護者による全般的評価を用いる場合は、20mm以上の悪化がみられる必要がある。 ・3つの反応基準の1つとして活動性関節炎がみられる関節数又は動作制限がみられる関節数を用いる場合は、2関節以上の悪化がみられる必要がある。 ・再燃の判定にCRPを使用する場合は、CRPが30mg/Lを超えている必要がある。 |
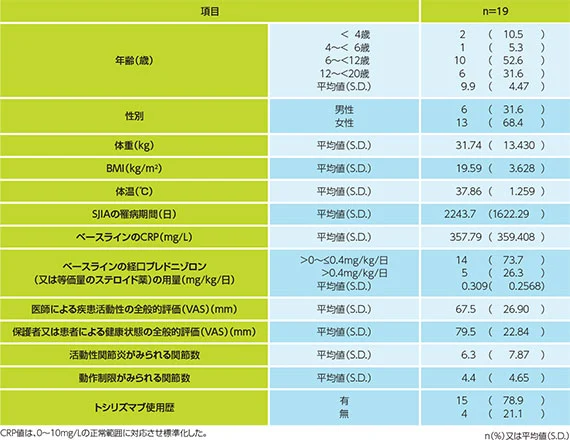
(2)患者背景
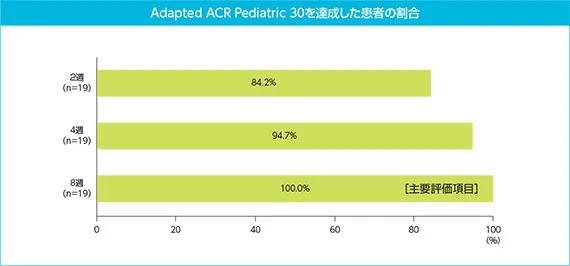
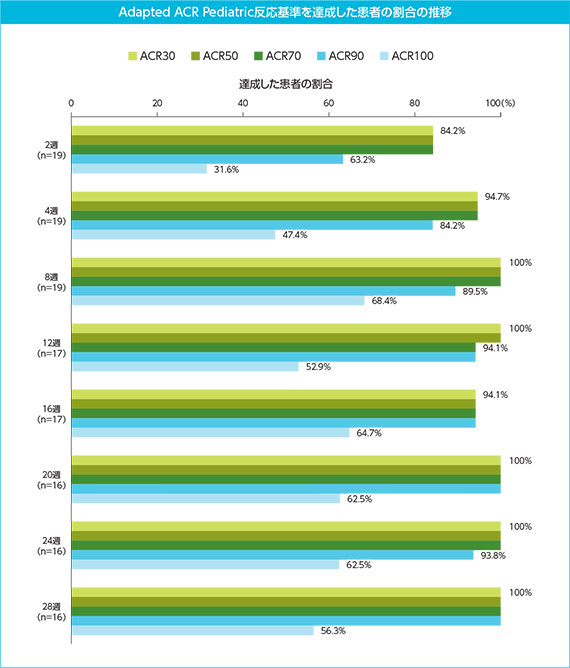
(3)主要評価項目:8週時点でAdapted ACR Pediatric 30を達成した患者の割合
Adapted ACR Pediatric 30を達成した患者は、2週時点で19例中16例(84.2%)、4週時点で19例中18例(94.7%)であり、8週時点で19例全例(100%)が達成した。なお、19例中4例がベースラインから8週までの間に、SJIAの再燃又は悪化により、経口ステロイド薬を増量又は静注ステロイド薬の使用、あるいはその両方を行った*。
*いずれも治験実施計画書からの逸脱として報告された。
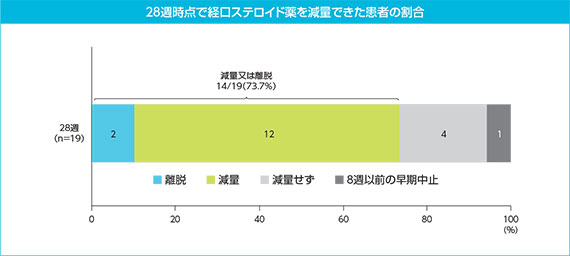
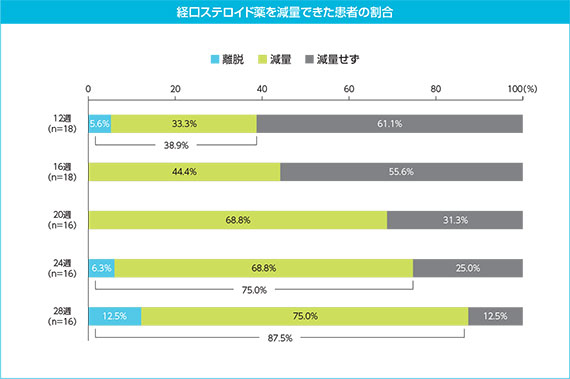
(4)主要評価項目:28週時点で経口ステロイド薬を減量できた患者の割合
経口ステロイド薬の減量は8週時点から開始できることとされた。28週時点で経口ステロイド薬を減量又は離脱できた患者は、19例中14例(73.7%)であった。
経口ステロイド薬を減量できた患者:Adapted ACR Pediatric 30を維持し、かつ以下のいずれかに該当するもの。Z
・ベースラインの投与量が0.8mg/kg/日超の場合、0.5mg/kg/日以下へ減量
・ベースラインの投与量が0.5mg/kg/日以上0.8mg/kg/日以下の場合、ベースラインからの減量が0.3mg/kg/日以上
・ベースラインの投与量にかかわらず0.2mg/kg/日以下に減量
・ベースラインの投与量が0.2mg/kg/日以下の場合、ベースラインからの減量
8週以前の早期中止例は、経口ステロイド薬を減量できなかった患者(減量せず)とみなした。欠測の場合、8週以降の最後に観察された値で補完した。
(5)副次評価項目:28週までにAdapted ACR Pediatric反応基準を達成した患者の割合
Adapted ACR Pediatric 30を達成した患者の割合は、8週以降28週時点まで、16週時点の17例中16例(94.1%)を除き100%であった(8週;19例中19例、12週;17例中17例、20、24、28週;16例中16例)。
Adapted ACR Pediatric 100を達成した患者の割合は、2週時点で19例中6例(31.6%)、4週時点で19例中9例(47.4%)であり、8週(19例中13例、68.4%)以降28週(16例中9例、56.3%)まで50~60%で推移した。
(6)副次評価項目:経口ステロイド薬を減量できた患者数及び割合
経口ステロイド薬を減量又は離脱できた患者の割合は、経口ステロイド薬の減量を開始できる8週以降、12週時点で18例中7例(38.9%)、16週時点で18例中8例(44.4%)であり、その後28週(16例中14例、87.5%)ま で経時的に増加した。
経口ステロイド薬を減量できた患者の定義については(4)主要評価項目を参照。8週以前の早期中止例は減量できなかった患者(減量せず)とみなした。
(7)副次評価項目:疾患非活動性の定義に該当した患者数及び割合
疾患非活動性の基準に該当した患者は、4週及び8週時点で19例中12例(63.2%)、12週時点で17例中12例(70.6%)、28週時点で16例中12例(75.0%)であった。
(8)副次評価項目:再燃が認められた患者数及び割合
28週までに再燃の基準に合致した患者は、19例中3例であった。
(9)安全性
副作用は19例中13例(68.4%)に認められた。主な副作用は注射部位反応3例(15.8%)等であった。
本試験において死亡例は報告されなかった。重篤な副作用は胃腸炎、貪食細胞性組織球症、発熱、咽頭炎、エプスタイン・バーウイルス感染(各1例)であった。投与中止に至った副作用はみられなかった。