ジレニア 肝機能異常
肝機能異常の発現状況
- ジレニア投与中に肝機能検査値異常(ALT、AST、γ-GTP等の上昇)が現れることがあります。
- 本剤の国内臨床試験における肝機能検査値異常の発現率は31.1%(50/161例)でした。
- 発現例の多くは本剤投与開始後3~4ヵ月以内に認められていますが、その後も認められることがあります。
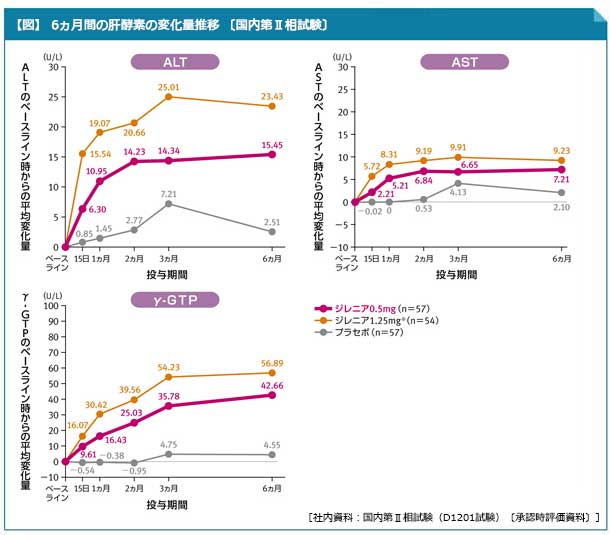
- 国内臨床試験において、ALT、ASTのベースライン時からの平均変化量は、ジレニア群では投与開始15日後には上昇がみられ、投与開始3ヵ月後に最も高値を示しました(図)。
- γ-GTPのベースライン時からの平均変化量は、ジレニア群では投与開始15日後には上昇がみられ、投与開始6ヵ月後に最も高値を示しました(図)。
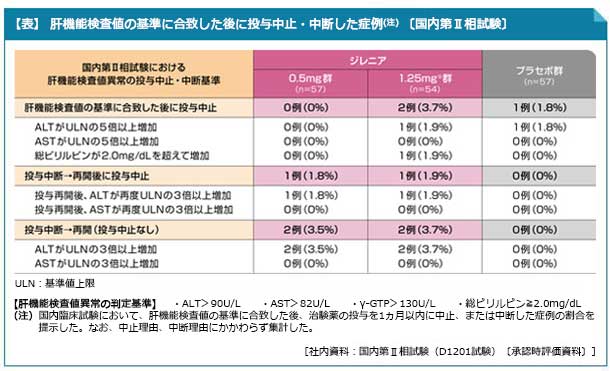
- 国内第Ⅱ相試験において、肝機能検査値の基準に合致した後に投与を中止した症例の割合は、ジレニア0.5mg群で0%(0/57例)、1.25mg※群で3.7%(2/54例)、プラセボ群で1.8%(1/57例)でした(表)。
※【ジレニアの用法及び用量】通常、成人にはフィンゴリモドとして1日1回0.5mgを経口投与する。
《国内第Ⅱ相試験 試験概要》
目的
日本人再発性多発性硬化症患者に対するジレニアの6ヵ月にわたる有用性を、プラセボを対照として比較検討する。
対象
日本人再発性多発性硬化症患者171例[年齢:18~60歳、EDSS:0~6.0、過去1年間に1回以上または過去2年間に2回以上の再発を経験またはスクリーニング期のGd造影T1強調病巣が1つ以上、試験薬割り付け前30日間に再発を経験していない、またはステロイド治療を受けていない、視神経脊髄炎(NMO)ではない]
方法
プラセボ対照・無作為化・二重盲検比較試験。対象患者を無作為に3群に割り付け、ジレニア0.5mg、1.25mg※、またはプラセボの1日1回経口投与を6ヵ月間行った。
評価項目
◎主要評価項目: 投与3ヵ月後および6ヵ月後の両時点でGd造影病巣が認められなかった被験者の割合(MRIによる評価)
◎副次評価項目: 新規または新規に拡大したT2強調病巣が認められなかった被験者の割合(MRIによる評価)、安全性 など
解析計画
投与3ヵ月後および6ヵ月後の両時点でGd造影病巣が認められなかった被験者の割合は、投与群、およびスクリーニング期のGd造影病巣数を共変量として調整したlogistic regression modelを用いて解析した。
肝機能異常に関する除外基準
肝臓の状態が以下のいずれかに該当する患者(本試験には肝機能異常のリスクを有する患者は含まれていない)
- アルコール乱用や慢性の肝または胆道疾患の既往または合併がある
- ASTまたはALTがULN(基準値上限)の2倍を超える
- ALPがULNの1.5倍を超える
- γ-GTPがULNの3倍を超える
- 総ビリルビンがULNを超える(ジルベール症候群を除く)
- 直接ビリルビンがULNを超える
安全性
副作用の発現率は、ジレニア0.5mg群で75.4%(43例/57例)、ジレニア1.25mg※群で85.2%(46例/54例)、プラセボ群で50.9%(29例/57例)であった。なお、主な副作用(ジレニア0.5mg群で発現率5%以上)は、鼻咽頭炎〔ジレニア0.5mg群26.3%(15例)、ジレニア1.25mg※群16.7%(9例)、プラセボ群21.1%(12例)〕、肝機能検査値異常〔各々21.1%(12例)、31.5%(17例)、5.3%(3例)〕、徐脈〔各々5.3%(3例)、14.8%(8例)、0例〕、悪心〔各々5.3%(3例)、3.7%(2例)、1.8%(1例)〕、咽頭炎〔各々5.3%(3例)、3.7%(2例)、3.5%(2例)〕、足部白癬〔各々5.3%(3例)、1.9%(1例)、3.5%(2例)〕、頭痛〔各々5.3%(3例)、7.4%(4例)、1.8%(1例)〕であった。
重篤な有害事象の発現率は、ジレニア0.5mg群で8.8%(5例)、ジレニア1.25mg※群で20.4%(11例)、プラセボ群で5.3%(3例)であり、主な重篤な有害事象(ジレニア0.5mg群で発現率5%以上)は、徐脈〔ジレニア0.5mg群5.3%(3例)、ジレニア1.25mg※群14.8%(8例)、プラセボ群0例〕であった。投与中止に至った有害事象の発現率は、ジレニア0.5mg群で10.5%(6例)、ジレニア1.25mg※群で11.1%(6例)、プラセボ群で5.3%(3例)であり、主な投与中止に至った有害事象(ジレニア0.5mg群で発現率5%以上)は、肝機能検査値異常〔ジレニア0.5mg群5.3%(3例)、ジレニア1.25mg※群3.7%(2例)、プラセボ群3.5%(2例)〕であった。本試験において、死亡は認められなかった。
[社内資料:国内第Ⅱ相試験(D1201試験)〔承認時評価資料〕]
[Saida T et al:Mult Scler 18(9):1269-1277, 2012]
ノバルティスは本研究に資金提供を行いました。著者には過去にコンサルタントとしてノバルティスを支援した者が含まれています。本論文の著者のうち3名はノバルティスの社員です。
田辺三菱製薬は本研究に資金提供を行いました。著者には過去にコンサルタントとして田辺三菱製薬を支援した者や研究支援などを受けた者が含まれています。本論文の著者のうち1名は田辺三菱製薬の社員です。
※【ジレニアの用法及び用量】通常、成人にはフィンゴリモドとして1日1回0.5mgを経口投与する。
リスクを軽減するための注意事項
肝機能検査の実施について
- 肝機能異常が現れることがあるので、ジレニア投与開始前に肝機能検査(トランスアミナーゼ、ビリルビン等)を実施するとともに、本剤投与中は定期的(投与開始15日後、1、2、3、6ヵ月後、それ以降は3ヵ月ごと等)*に肝機能検査を実施してください。
- 本剤投与中に肝機能障害を疑う臨床症状(悪心、嘔吐、腹痛、疲労、食欲不振等)が現れた場合にも肝機能検査を実施し、異常が認められた場合には本剤の投与を中止するなど適切な処置を行ってください。
【特定の背景を有する患者に関する注意】について
以下の患者に対しては、注意して投与してください。
- 肝機能障害またはその既往歴のある患者
*:〔参考〕国内第Ⅱ相試験(6ヵ月)のプロトコールより
