ベオビュ 糖尿病黄斑浮腫(DME)
製品特性
糖尿病黄斑浮腫に対するベオビュの特性
糖尿病黄斑浮腫を効能又は効果としたヒト化抗VEGFモノクローナル抗体一本鎖Fv断片(scFv)
ベオビュはVEGF-Aに結合して、血管内皮細胞表面に発現するVEGF受容体(VEGFR1及びVEGFR2)へのVEGF-Aの結合を阻害します。
※作用機序を参照
ブロルシズマブ(遺伝子組換え)として6mg(0.05mL)を6週ごとに1回、通常、連続5回(導入期)硝子体内投与するが、症状により投与回数を適宜減じる。その後の維持期においては、通常、12週ごとに1回、硝子体内投与。なお、症状により投与間隔を適宜調節するが、8週以上あけること
導入期における投与回数については、治療反応性に応じて5回未満とすることも考慮します。維持期においては、定期的に疾患活動性を評価し、疾患活動性を示唆する所見が認められた場合は、投与間隔を8週とすること等を考慮します。
有効性:糖尿病黄斑浮腫患者の最高矯正視力を改善
ベオビュ6mg投与による最高矯正視力スコアのベースラインからの変化量(52週)は、アフリベルセプト2mg群に対して非劣性であることが検証されました(非劣性マージン:-4文字、片側p<0.001、ANOVA)。
〔[非劣性試験]KESTREL(B2301)試験:日本人を含む国際共同第Ⅲ相試験、KITE(B2302)試験:海外第Ⅲ相試験〕
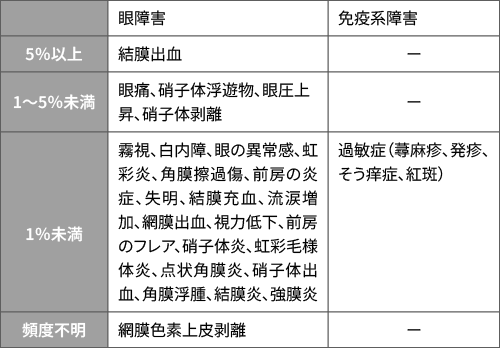
安全性:重大な副作用として、眼障害及び動脈血栓塞栓症、主な副作用として以下のものが報告されています
重大な副作用:
眼障害眼内炎(0.5%)、眼内炎症(ぶどう膜炎等)(2.8%)、網膜色素上皮裂孔(0.7%)、網膜剥離(0.2%)、網膜裂孔(0.6%)、網膜血管炎(0.1%)、網膜動脈閉塞(0.4%)、網膜血管閉塞(0.4%)があらわれることがある。本剤投与により眼内炎症があらわれた患者に対して再投与した場合に、眼内炎症が再発した症例が報告されている。
網膜血管炎及び網膜血管閉塞の発現には本剤への免疫応答が関与していることが報告されており、網膜血管炎又は網膜血管閉塞があらわれた患者では、再発するおそれがあるため、本剤を再投与しないこと。これらの事象は眼内炎症(ぶどう膜炎、虹彩炎、硝子体炎、虹彩毛様体炎等)に併発することがあるため、眼内炎症があらわれた場合は、患者の状態を十分に観察すること。
その他の副作用:

電子添文の副作用の項及び臨床成績の項の安全性の結果をご参照ください。
