アフィニトール 結節性硬化症(TSC)
| 「警告・禁忌を含む注意事項等情報」等は電子添文をご参照ください。 |
| 「結節性硬化症」の効能又は効果について 結節性硬化症又は孤発性リンパ脈管筋腫症に伴う腎血管筋脂肪腫対象第Ⅲ相国際共同比較検証試験(EXIST-2 試験)、結節性硬化症に伴う上衣下巨細胞性星細胞腫対象第Ⅲ相海外比較検証試験(EXIST-1試験)、結節性硬化症に伴う上衣下巨細胞性星細胞腫対象第Ⅱ相海外臨床試験(C2485 試験)に加え、結節性硬化症に伴うてんかん部分発作対象第Ⅲ相国際共同比較検証試験(EXIST-3 試験)、及び結節性硬化症に伴うリンパ脈管筋腫症又は孤発性リンパ脈管筋腫症対象第Ⅱa 相海外臨床試験(X2201 試験)の結果に基づき、本剤の効能又は効果を「結節性硬化症に伴う腎血管筋脂肪腫」及び「結節性硬化症に伴う上衣下巨細胞性星細胞腫」から「結節性硬化症」に一部変更することが承認されました。なお、EXIST-1 試験、EXIST-3 試験、X2201試験は承認用法用量ではなく、また、EXIST-2試験及びX2201 試験は承認外の孤発性リンパ脈管筋腫症患者を含む臨床試験です。 |
結節性硬化症に伴うてんかん部分発作対象第Ⅲ相国際共同比較検証試験(EXIST-3試験)1)
1)社内資料: 国際共同臨床試験の結果 M2304 試験(承認時評価資料)〔20190284〕
試験方法
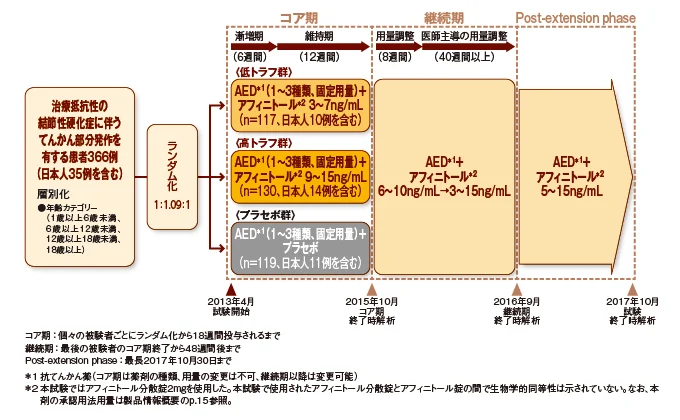
試験デザイン: 多施設共同、二重盲検、ランダム化、プラセボ対照、並行群間比較試験
実施地域:アルゼンチン、オーストラリア、ベルギー、カナダ、コロンビア、デンマーク、フランス、ドイツ、ギリシャ、ハンガリー、アイルランド、イタリア、日本、メキシコ、オランダ、ノルウェー、ポーランド、韓国、ロシア、スペイン、台湾、タイ、トルコ、イギリス、米国の世界25ヵ国
| 目的 | 結節性硬化症に伴うてんかん部分発作の発現頻度の減少を、2つのトラフ濃度範囲のアフィニトールとプラセボとで比較検証する。 | |
| 対象 | 抗てんかん薬(AED)の単剤又は併用による2 種類以上のレジメンで治療したにもかかわらず抑制できない(治療抵抗性)てんかん部分発作が認められる結節性硬化症患者366例 | |
| 方法 | 対象をアフィニトール低トラフ群、高トラフ群及びプラセボ群にランダムに割り付けし、AED 併用下、以下の通りアフィニトール又はプラセボを1日1回朝食後に経口投与した。 | |
| コア期 | 患者の年齢及びCYP3A4/P-gp 誘導薬の併用の有無に応じた用量にて投与を開始し、最初の6週間でトラフ濃度が低トラフ群は3〜7ng/mL、高トラフ群は9〜15ng/mLの範囲になるよう用量を漸増し、続く12週間はそれまでの用量を維持した。 | |
| 継続期 | プラセボ群を含む全患者にアフィニトールを投与し、最初の8 週間でトラフ濃度を6〜10ng/mL に調整し、その後は治験責任(分担)医師主導により3〜15ng/mL の範囲で用量調節可とした。 | |
| Post- extension phase | 継続期を終了した全患者に、市販可能となった時点、ロールオーバー試験*が治験実施医療機関で実施可能となった時点、又は2017 年10月30日のいずれか早い時点まで投与を継続した(患者ごとに判断)。アフィニトールの用量は目標トラフ濃度を5〜15ng/mLとし、患者の状態に応じて治験責任(分担)医師の判断で調整した。 * ロールオーバー試験とは、EXIST-3 試験でアフィニトールを投与中であり、かつ治験責任(分担)医師によって継続投与により利益が得られると判断された患者を対象とした試験。 | |
| 評価項目 | 主要評価項目: | 50% Responder rate(部分発作の発現頻度がベースラインから50%以上減少した患者の割合) |
| 副次評価項目: | 発作頻度減少率(部分発作発現頻度のベースラインからの減少率)、無発作率(部分発作発現頻度が100%減少した患者の割合)、無発作日数 等 | |
| 探索的評価項目: | 日本人患者集団における結節性硬化症に伴うASD(自閉症スペクトラム障害)に対する効果 | |
| 解析計画 | 50% Responder rate は、全体で有意水準片側2.5%になるようにBonferroni-Holm 法を用いて調整し、ランダム化時の年齢の部分集団(1 歳以上〜6 歳未満、6歳以上〜12 歳未満、12 歳以上〜18歳未満、18 歳以上)を層別化因子とするCochran-Mantel-Haenszel(CMH) χ2検定を用いて各群間を比較した。発作頻度減少率は、全体で有意水準片側2.5%になるようにBonferroni-Holm 法を用いて調整し、ランダム化時の年齢の部分集団を層別化因子、週あたりのベースラインの発作頻度(平均値)を共変量とした順位ANCOVAを用いて各群間を比較した。無発作率はClopper and Pearson 法による正確な95%信頼区間とともに示した。無発作日数は、ベースラインからの変化量について記述統計量を算出した。探索的評価項目である日本人患者集団における結節性硬化症に伴うASD(自閉症スペクトラム障害)に対する効果の評価は、広汎性発達障害日本自閉症協会評定尺度(Pervasive Developmental Disorders Autism Society Japan Rating Scale,PARS)を用いた評定について、患者ごとにベースラインと治療後の評定を要約した。 | |
患者背景(海外データ)
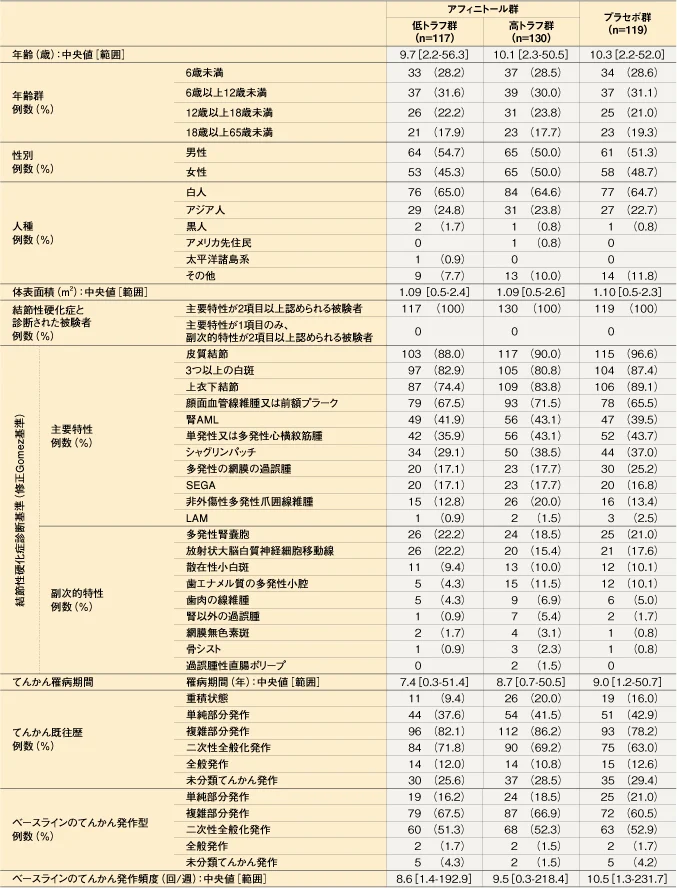
(コア期終了時解析:2015年10月カットオフ、最大の解析対象集団)
有効性
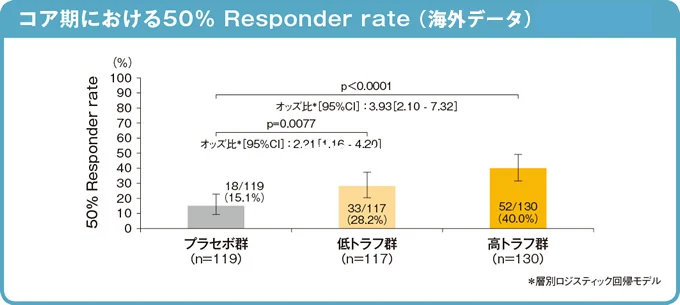
1)50% Responder rate[主要評価項目]
コア期終了時解析(2015年10月カットオフ)
50% Responder rate(部分発作の発現頻度がベースラインから50%以上減少した患者の割合)は、低トラフ群28.2%(95%信頼区間:20.3 - 37.3)、高トラフ群40.0%(95%信頼区間:31.5 - 49.0)、プラセボ群15.1%(95%信頼区間:9.2 - 22.8)であり、いずれのアフィニトール群とプラセボ群の間に有意な差があることが検証されました(層別Cochran-Mantel-Haenszel χ2 検定 低トラフ群p=0.0077、高トラフ群p <0.0001)。
試験終了時解析(2017年10月カットオフ)
コア期または継続期でアフィニトールを1回以上投与された361例において、試験終了時の50% Responder rate(部分発作の発現頻度がベースライン[アフィニトール投与開始前、プラセボ群の場合はアフィニトール投与への切替え時]から50%以上減少した患者の割合)は、18週時で31.0%(95%信頼区間:26.2 - 36.1)、54週時で46.2%(95%信頼区間:40.4 - 52.0)、102週時で59.7%(95%信頼区間:52.4 - 66.7)でした。
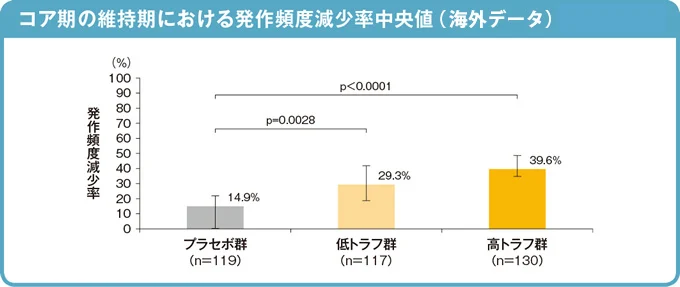
2)発作頻度減少率(副次評価項目)
コア期終了時解析(2015 年10 月カットオフ)
コア期の維持期における発作頻度減少率(部分発作発現頻度のベースラインからの減少率*)中央値は、低トラフ群で29.3%(95%信頼区間:18.8 - 41.9)、高トラフ群で39.6%(95%信頼区間:35.0 - 48.7)、プラセボ群で14.9%(95%信頼区間:0.1 - 21.7)であり、いずれのアフィニトール群とプラセボ群の間で有意な差がありました(順位ANCOVA 低トラフ群p=0.0028、高トラフ群p <0.0001)。
* 発作頻度減少率=100×(SFB - SFM)÷ SFB
SFB:ベースライン期での週あたりの発作頻度の平均値、SFM:維持期での週あたりの発作頻度の平均値
継続期終了時解析(2016年9月カットオフ)
ベースライン[アフィニトール投与開始前(プラセボ群の場合はアフィニトール投与への切替え時)]からの発作頻度減少率中央値は、18 週時点(7〜18 週、n=352)で31.7%(95%信頼区間:28.51 - 36.09)、54 週時点(43〜54 週、n=298)で46.7%(95%信頼区間:40.17 - 54.02)、102 週時点(91〜102週、n=163)で56.9%(95%信頼区間:50.00 - 68.42)でした。
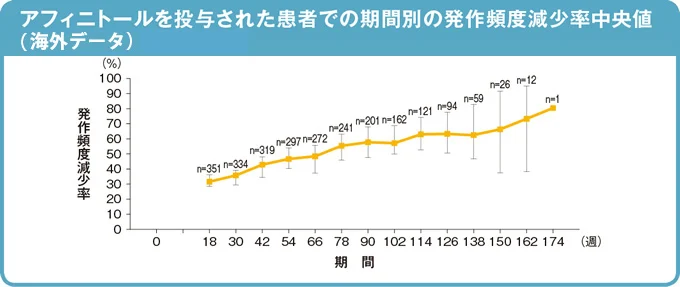
試験終了時解析(2017 年10 月カットオフ)
発作頻度減少率中央値は、18週時点(7〜18週、n=352)で31.7%(95%信頼区間:28.51 - 36.09)、54週時点(43〜54週、n=299)で46.1%(95%信頼区間:39.93 - 53.61)、102週時点(91〜102週、n=191)で59.7%(95%信頼区間:52.13 - 70.94)でした。
3)無発作率(副次評価項目)
試験終了時解析において12ヵ月時(n=284)、18ヵ月時(n=221)、24ヵ月時(n=145)及び30ヵ月時(n=65)に過去6ヵ月間無発作であった患者の割合は、それぞれ5.6%(95%信頼区間:3.3 - 9.0)、10.0%(95%信頼区間:6.3 - 14.7)、9.0%(95%信頼区間:4.9 - 14.8)、15.4%(95%信頼区間:7.6 - 26.5)、過去12ヵ月間無発作であった患者の割合はそれぞれ0.7%(95%信頼区間:0.1 - 2.5)、5.0%(95%信頼区間:2.5 - 8.7)、8.3%(95%信頼区間:4.3 - 14.0)、10.8%(95%信頼区間:4.4 -20.9)でした。
4)無発作日数(副次評価項目)
継続期終了時解析において、アフィニトール投与開始時からの28日あたりの無発作日数(中央値)を7 週以降12 週間隔(7〜18 週、19〜30 週、以降同様に12 週間隔)で計算した時のベースラインからの変化量(中央値)は、18 週時(7〜18 週、n=352)で2.46日、54 週時(43〜54 週、n=298)で4.32日、102 週時(91〜102 週、n=163)で6.15日でした。
5)日本人患者集団における結節性硬化症に伴うASD(自閉症スペクトラム障害)に対する効果(探索的評価項目)
登録された日本人患者35 例中29 例(低トラフ群9 例、高トラフ群10 例、プラセボ群10 例)において、広汎性発達障害日本自閉症協会評定尺度(Pervasive Developmental Disorders Autism Society Japan Rating Scale、PARS)を用い結節性硬化症に伴うASD(自閉症スペクトラム障害)について評価しました。
コア期終了時解析では、臨床的に意義があると考えられる5ポイント以上の変化を認めた患者は、低トラフ群で2 例、高トラフ群で2 例、プラセボ群で1 例でした。
試験終了時解析では、コア期終了時に臨床的に意義があると考えられる5ポイント以上の変化を認めたアフィニトール群の4例のうち、42週時点で評価し得た3例で5ポイント以上の変化でした。また、投与終了時点では4例中1 例は適切に評価が実施できず、1例はスコアが増加(悪化)し、2例は5ポイント以上の変化でした。なお、プラセボ群からアフィニトールに群に移行した患者で、5ポイント以上の変化を認めた患者はいませんでした。
安全性(副次評価項目)
<コア期終了時解析(2015年10月カットオフ)>
- 主な副作用
アフィニトール投与群の低トラフ群117例中78例(66.7%)、高トラフ群130例中102例(78.5%)及びプラセボ群119例中40例(33.6%)に副作用がみられました。各アフィニトール群で特に多く認められた副作用は、低トラフ群で口内炎及び口腔内潰瘍形成各28例(23.9%)、アフタ性潰瘍及び高トリグリセリド血症各5例(4.3%)、高トラフ群で口内炎40例(30.8%)、口腔内潰瘍形成25例(19.2%)、アフタ性潰瘍17例(13.1%)でした。プラセボ群で認められた主な副作用は口腔内潰瘍形成5例(4.2%)、口内炎、食欲減退、悪心及び嘔吐各4例(3.4%)でした。 - 重篤な有害事象
重篤な有害事象は低トラフ群で117例中16例(13.7%)、高トラフ群で130例中18例(13.8%)、プラセボ群で119例中3例(2.5%)にみられました。2例以上に認められた重篤な有害事象は、低トラフ群でてんかん重積状態、痙攣発作、口腔内潰瘍形成、咽頭炎及び尿路感染が各2例(1.7%)、高トラフ群で肺炎が4例(3.1%)、てんかん重積状態及び頭痛が各2例(1.5%)でした。プラセボ群で2例以上に認められた重篤な有害事象はありませんでした。このうち副作用は、低トラフ群のてんかん重積状態、口腔内潰瘍形成及び咽頭炎各2例(1.7%)、痙攣発作及び尿路感染各1例(0.9%)、高トラフ群の肺炎3例(2.3%)、てんかん重積状態及び頭痛各1例(0.8%)でした。 - 投与中止に至った有害事象
投与中止に至った有害事象は低トラフ群で117例中6例(5.1%)、高トラフ群で130例中4例(3.1%)、プラセボ群で119例中2例(1.7%)でした。その内訳は、低トラフ群で口内炎2例(1.7%)、発熱、免疫不全症、不安及び下痢各1例(0.9%)、高トラフ群で肺炎、口内炎、好中球減少症及び口腔内潰瘍形成各1例(0.8%)、プラセボ群でウイルス性気道感染及び体重減少各1例(0.8%)でした。
<継続期終了時解析(2016年9月カットオフ)
- 主な副作用
アフィニトール投与361例中、副作用は307例(85.0%)にみられました。主な副作用は口内炎121例(33.5%)、口腔内潰瘍形成94例(26.0%)、下痢38例(10.5%)、アフタ性潰瘍及び発熱各37例(10.2%)等でした。 - 重篤な有害事象
アフィニトール投与361例中120例(33.2%)に重篤な有害事象がみられました。最も多く認められた重篤な有害事象は肺炎が33例(9.1%)であり、次いで痙攣発作が15例(4.2%)、てんかん重積状態が13例(3.6%)、胃腸炎が10例(2.8%)、発熱が8例(2.2%)等でした。このうち副作用は、65例(18.0%)に発現し、最も多く認められた重篤な副作用は肺炎21例(5.8%)であり、次いでてんかん重積状態及び発熱各6例(1.7%)、胃腸炎5例(1.4%)、痙攣発作4例(1.1%)でした。 - 投与中止に至った有害事象
投与中止に至った有害事象はアフィニトール投与361例中47例(13.0%)にみられました。最も多く認められた投与中止に至った有害事象は、肺炎が6例(1.7%)であり、次いで口内炎が5例(1.4%)でした。その他の事象は1%未満の発現でした。
<試験終了時解析(2017年10月カットオフ)>
- 主な副作用
アフィニトール投与361例中、副作用は314例(87.0%)にみられました。主な副作用は、口内炎(口腔内潰瘍等を含む)240例(66.5%)、感染症131例(36.3%)、下痢及び発熱各40例(11.1%)等でした。 - 重篤な有害事象
アフィニトール投与361例中137例(38.0%)に重篤な有害事象がみられました。1%以上に認められた重篤な有害事象は、肺炎が38例(10.5%)、痙攣発作が18例(5.0%)、てんかん重積状態が15例(4.2%)、胃腸炎が14例(3.9%)、発熱が11例(3.0%)、気管支炎及びインフルエンザが各6例(1.7%)、下痢及び扁桃炎が各5例(1.4%)、口腔内潰瘍形成、咽頭炎、腎盂腎炎、口内炎及び嘔吐が各4例(1.1%)でした。
このうち副作用は、77例(21.3%)に発現し、最も多く認められた重篤な副作用は肺炎23例(6.4%)であり、次いで発熱9例(2.5%)、胃腸炎及びてんかん重積状態各6例(1.7%)、痙攣発作4例(1.1%)でした。 - 投与中止に至った有害事象
投与中止に至った有害事象はアフィニトール投与361例中50例(13.9%)にみられ、1%以上に認められた投与中止に至った有害事象は、肺炎6例(1.7%)、口内炎5例(1.4%)でした。 - 死亡(全試験期間)
コア期終了時解析のデータカットオフ日までに高トラフ群の1例が継続期中である投与開始約9.2ヵ月後に原疾患であるてんかんにより死亡しました(アフィニトールとの関連は否定されました)。コア期終了時解析のデータカットオフ日以降、継続期終了時解析のデータカットオフ日までに低トラフ群の1例が肺炎の副作用により死亡しました。継続期終了時解析のデータカットオフ日以降、試験終了時解析のデータカットオフ日までに、新たに2例がてんかんにおける原因不明の突然死及び敗血症性ショックにより死亡しました。このうち副作用は、敗血症性ショックでした。
| アフィニトール錠2.5mg・5mg【用法及び用量】(抜粋)(結節性硬化症の場合) 成人の結節性硬化症に伴う腎血管筋脂肪腫の場合 通常、エベロリムスとして1日1回10mgを経口投与する。なお、患者の状態やトラフ濃度により適宜増減する。 上記以外の場合 通常、エベロリムスとして3.0mg/m2を1日1回経口投与する。なお、患者の状態やトラフ濃度により適宜増減する。 アフィニトール分散錠2mg・3mg【用法及び用量】 成人の結節性硬化症に伴う腎血管筋脂肪腫の場合 通常、エベロリムスとして10mgを1日1回、用時、水に分散して経口投与する。なお、患者の状態やトラフ濃度により適宜増減する。 上記以外の場合 通常、エベロリムスとして3.0mg/m2を1日1回、用時、水に分散して経口投与する。なお、患者の状態やトラフ濃度により適宜増減する。 |
〈用法及び用量に関連する注意事項等情報〉については、製品電子添文をご参照ください。
