悪性黒色腫(メラノーマ) Phase III COMBI-AD試験
COMBI-AD試験 試験概要
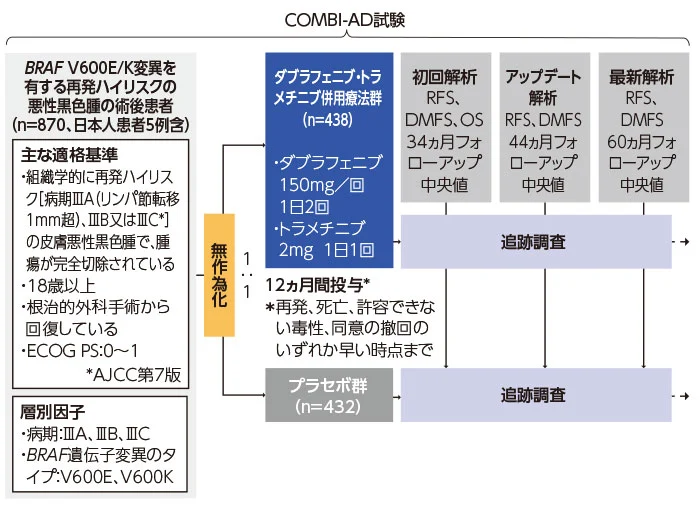
試験方法
データカットオフ:初回解析 2017年6月30日
アップデート解析 2018年4月30日
最新解析 2019年11月8日
RFS, Relapse Free Survival; OS: Overall Survival; DMFS: Distant Metastasis Free Survival: FFR: Freedom From Relapse,
Long, GV. et al:.N. Engl. J. Med. 2017; 377(19): 1813-1823〔20180231〕【利益相反】本研究はノバルティスファーマ(ノバルティス)の支援で実施した。ノバルティス社員が著者に4名含まれ ている。ノバルティスより謝礼金やアドバイザリー料、研究助成を受領している著者が10名含まれている。ノバルティスよりメディカルライティングについてのサポートを受けている。
社内資料:国際共同第Ⅲ相臨床試験(F2301試験)(2018年7月2日承認、CTD2.7.6.4.1.1.) <承認時評価資料>〔20180229〕Hauschild, A. et al.:J. Clin. Oncol. 2018; 36(35): 3441-3449【利益相反】本研究はノバルティスファーマの支援で実施した。ノバルティスファーマ社員が著者に4名含まれている。ノバルティスファーマより謝礼金やアドバイザリー料、研究助成、交通費/宿泊費、その他経費を受領している著者が17名含まれている。
Dummer, R. et al.:N. Engl. J. Med. 2020; 383(12): 1139-1148【利益相反】本研究はノバルティスファーマ(ノバルティス)の支援で実施した。ノバルティス社員が著者に3名含まれている。ノバルティスよりメディカルライティングについてのサポートを受けている。
試験概要
目的
BRAF V600E/K変異を有する病期Ⅲ(AJCC第7版)の再発ハイリスクの組織学的に確認された皮膚悪性黒色腫で、腫瘍が完全に切除された患者を対象に、プラセボに対するダブラフェニブ・トラメチニブ併用療法の有効性、安全性及び忍容性を検討する。
対象
BRAF V600E/K遺伝子変異を有する、病期Ⅲ(AJCC第7版)の再発ハイリスク[病期ⅢA(リンパ節転移1mm超)、ⅢB又はⅢC]の組織学的に確認された皮膚悪性黒色腫で、腫瘍が完全に切除された患者 870例
主要評価項目
無再発生存期間(RFS)
副次評価項目
全生存期間(OS)、安全性等
解析計画
RFS(主要評価項目):
Kaplan-Meier法を用いて推定し、層別因子及び病期で調整した層別log-rank検定を用いて治療群間で比較し、Pike法を用いてハザード比及び95%CIを算出した。また、補助的にA mixed Weibull cure-ratemode(l ワイブル治癒混合モデル)を用いて、各治療群の長期無再発生存患者を推定した。
OS(副次評価項目):
Kaplan-Meier法を用いて推定し、層別因子で調整した層別log-rank検定を用いて治療群間で比較した。
Hauschild, A. et al:. J. Clin. Oncol. 2018; 36(35): 3441-3449【利益相反】本研究はノバルティスファーマの支援で実施した。ノバルティスファーマ社員が著者に4名含まれている。ノバルティスファーマより謝礼金やアドバイザリー料、研究助成、交通費/宿泊費、その他経費を受領している著者が17名含まれている。
Dummer, R. et al:. N. Engl. J. Med. 2020; 383(12): 1139-1148【利益相反】本研究はノバルティスファーマ(ノバルティス)の支援で実施した。ノバルティス社員が著者に3名含まれている。ノバルティスよりメディカルライティングについてのサポートを受けている。
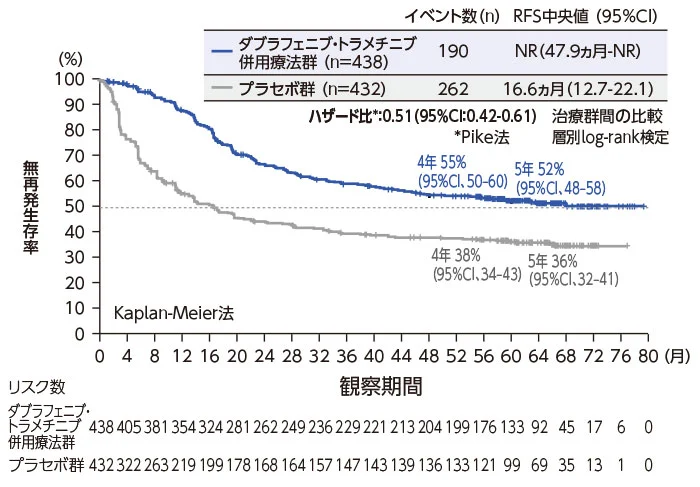
無再発生存期間(RFS)<主要評価項目>
データカットオフ:2019年11月8日
Dummer, R. et al:. N. Engl. J. Med. 2020; 383(12): 1139-1148【利益相反】本研究はノバルティスファーマ(ノバルティス)の支援で実施した。ノバルティス社員が著者に3名含まれている。ノバルティスよりメディカルライティングについてのサポートを受けている。
安全性<副次評価項目>
- 副作用はダブラフェニブ・トラメチニブ併用療法群の398/435例(92%)、プラセボ群の272/432例(63%)に認められた。主なものは、ダブラフェニブ・トラメチニブ併用療法群では発熱244例(56%)、疲労170例(39%)、悪寒155例(36%)等、プラセボ群では疲労85例(20%)、悪心52例(12%)、頭痛50例(12%)等であった。
- 重篤な有害事象は、ダブラフェニブ・トラメチニブ併用療法群では155例に認められた。発現率1%以上の重篤な有害事象は、ダブラフェニブ・トラメチニブ併用療法群では発熱67例、悪寒及び駆出率減少各13例、丹毒8例等であった。
- 投与中止に至った有害事象は、ダブラフェニブ・トラメチニブ併用療法群では114例に認められた。発現率1%以上の投与中止に至った有害事象は、ダブラフェニブ・トラメチニブ併用療法群では発熱38例、悪寒16例、疲労8例等であった。
本試験において副作用による死亡例は認められなかった。
データカットオフ: 2019年11月8日
Dummer, R. et al:. N. Engl. J. Med. 2020; 383(12): 1139-1148【 利益相反】本研究はノバルティスファーマ(ノバルティス)の支援で実施した。ノバルティス社員が著者に3名含まれている。ノバルティスよりメディカルライティングについてのサポートを受けている。
Long, GV. et al:. N. Engl. J. Med. 2017; 377(19): 1813-1823〔20180231〕【利益相反】本研 究はノバルティスファーマ(ノバルティス)の支援で実施した。ノバルティス社員が著者に4名含まれている。ノバルティスより謝礼金やアドバイザリー料、研究助成を受領している著者が10名含まれている。ノバルティスよりメディカルライティングについてのサポートを受けている。
社内資料:国際共同第Ⅲ相臨床試験(F2301試験)COMBI-AD<承認時評価資料>〔20180229〕