キムリア 濾胞性リンパ腫(FL)
ELARA試験
再発又は難治性のFL成人患者を対象とした国際共同第Ⅱ相試験(E2202試験、ELARA試験)(日本人を含む)
Fowler, N.H. et al.:Nat Med. 2022; 28(2): 325-33 COI:本試験はノバルティスの資金により行われた。著者にノバルティスより謝礼、研究助成金を受領したもの及び社員が含まれる。
社内資料:再発又は難治性の濾胞性リンパ腫(FL)成人患者を対象とするCTL019の有効性及び安全性を評価する第Ⅱ相単群多施設試験(E2202試験)(承認時評価資料)
再発又は難治性のFL成人患者を対象にキムリアの有効性及び安全性を評価する、単群、多施設共同、第Ⅱ相試験(E2202試験、ELARA試験)
試験概要
- 試験デザイン
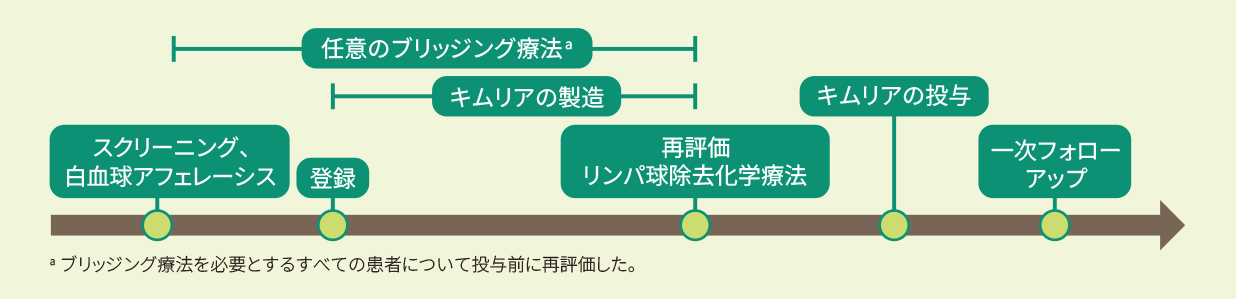
| 目的 | 再発又は難治性FL患者を対象にキムリアの有効性及び安全性を検討する。 |
| 対象 | 再発又は難治性のFL患者98例のうち投与例97例(日本人9例を含む)。 スクリーニング時に放射線学的に測定可能な病変を有し、キムリア投与前に中央検査機関の病理評価でグレード1、2、3AのFLであることが組織学的に確定している、18歳以上の再発又は難治性FL患者で、以下の組入れ基準のいずれかを満たす患者。なお、悪性腫瘍(リンパ腫)の活動性の中枢神経系浸潤のある患者は除外された。 ・ 二次治療以降の全身療法(抗CD20抗体及びアルキル化剤を含む)に対して難治性となったか、又は二次治療以降の全身療法終了後6ヵ月以内に再発した患者。 ・ 抗CD20抗体による維持療法(上記、2ライン以上の治療終了後)の実施中又は終了後6ヵ月以内に再発した患者。 ・自家HSCT後に再発した患者。 |
| 投与方法・投与量 | CAR発現生T細胞として0.6×108~6.0×108個(体重問わず)を単回静脈内投与した。 |
| 評価項目・ 解析計画 | 主要評価項目 副次評価項目 解析計画 |
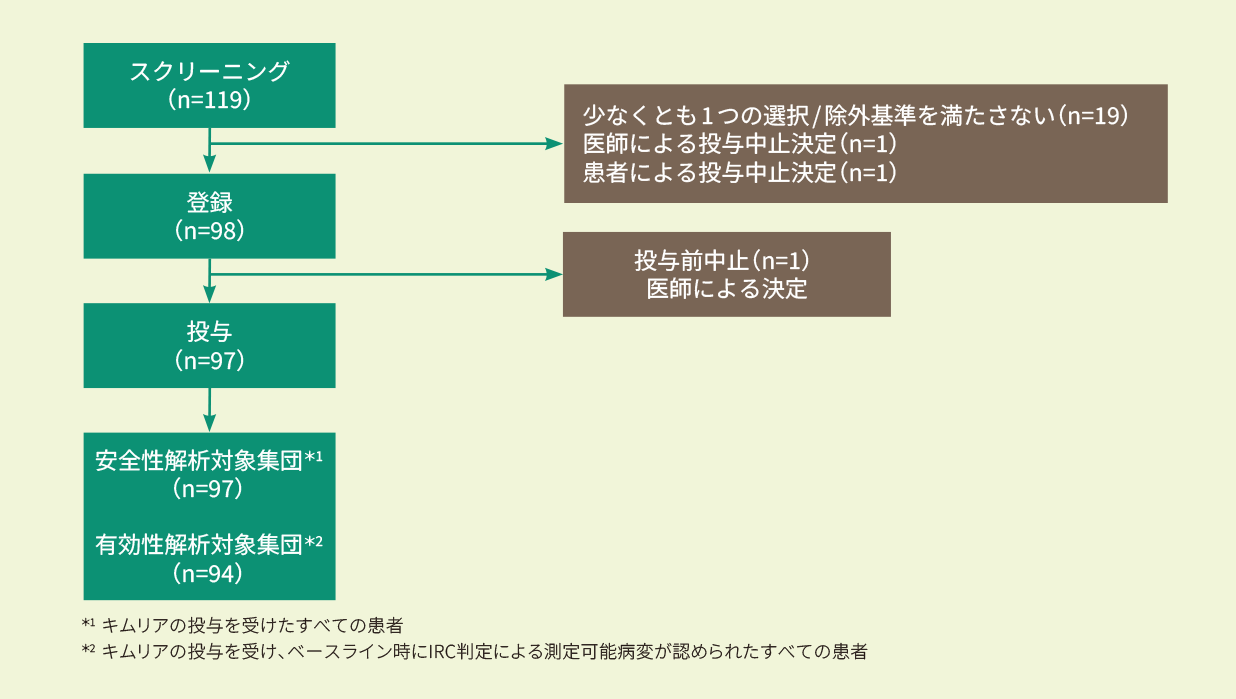
治療状況・患者背景
- 治療状況
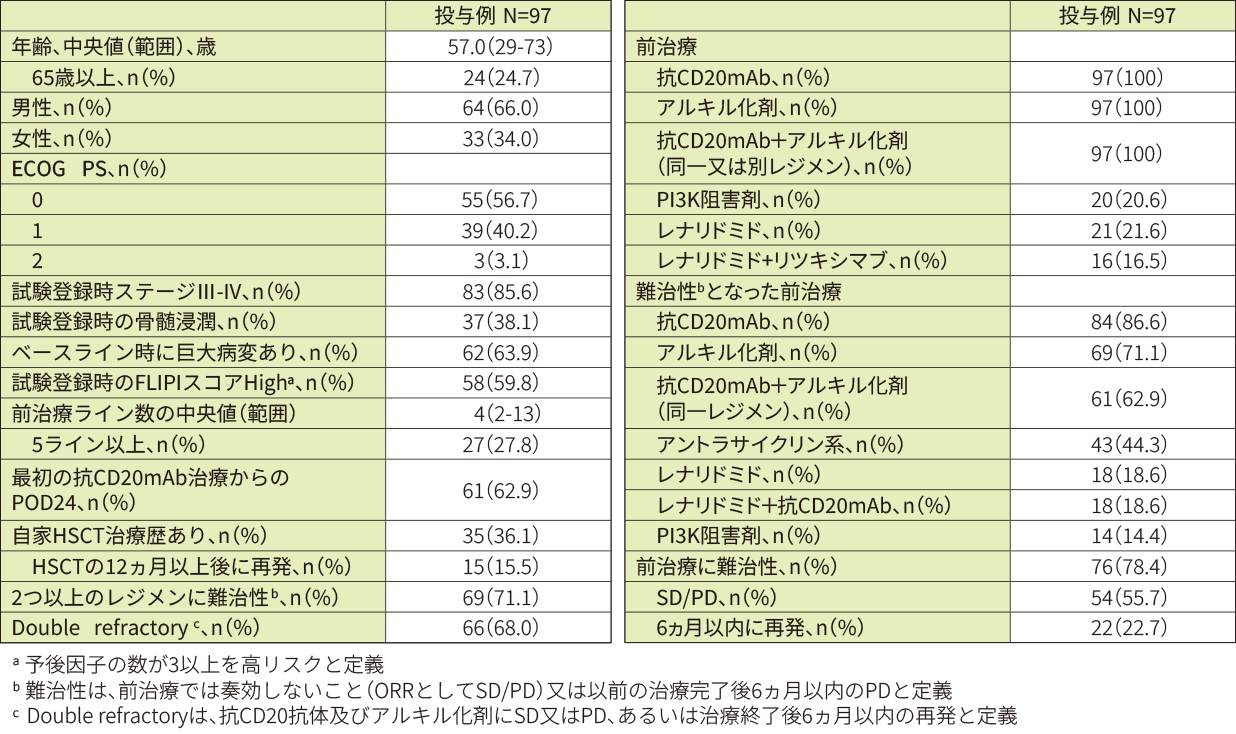
- 患者背景
有効性
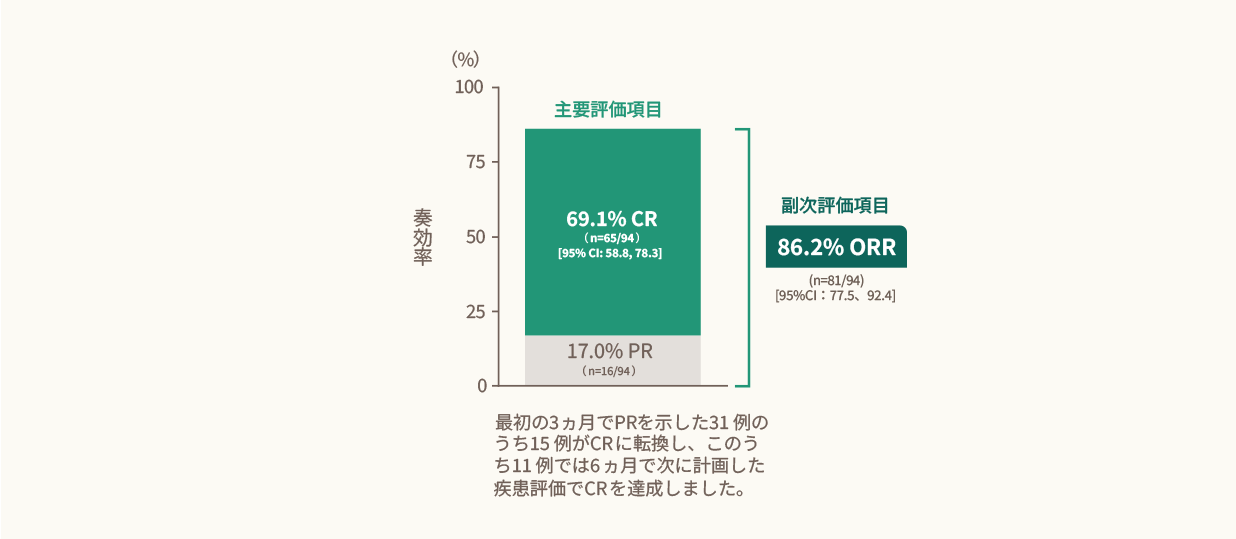
キムリア投与後のCRRは69.1%、ORRは86.2%でした。<主要・副次評価項目>
- キムリア投与後のCRR及びORR(IRC判定、EAS)
CRRの部分集団解析の結果、FLIPIスコア、巨大病変の有無、LDH値等の部分集団別の解析結果は以下の通りでした。<部分集団解析>
- CRRの部分集団解析(IRC判定、EAS)
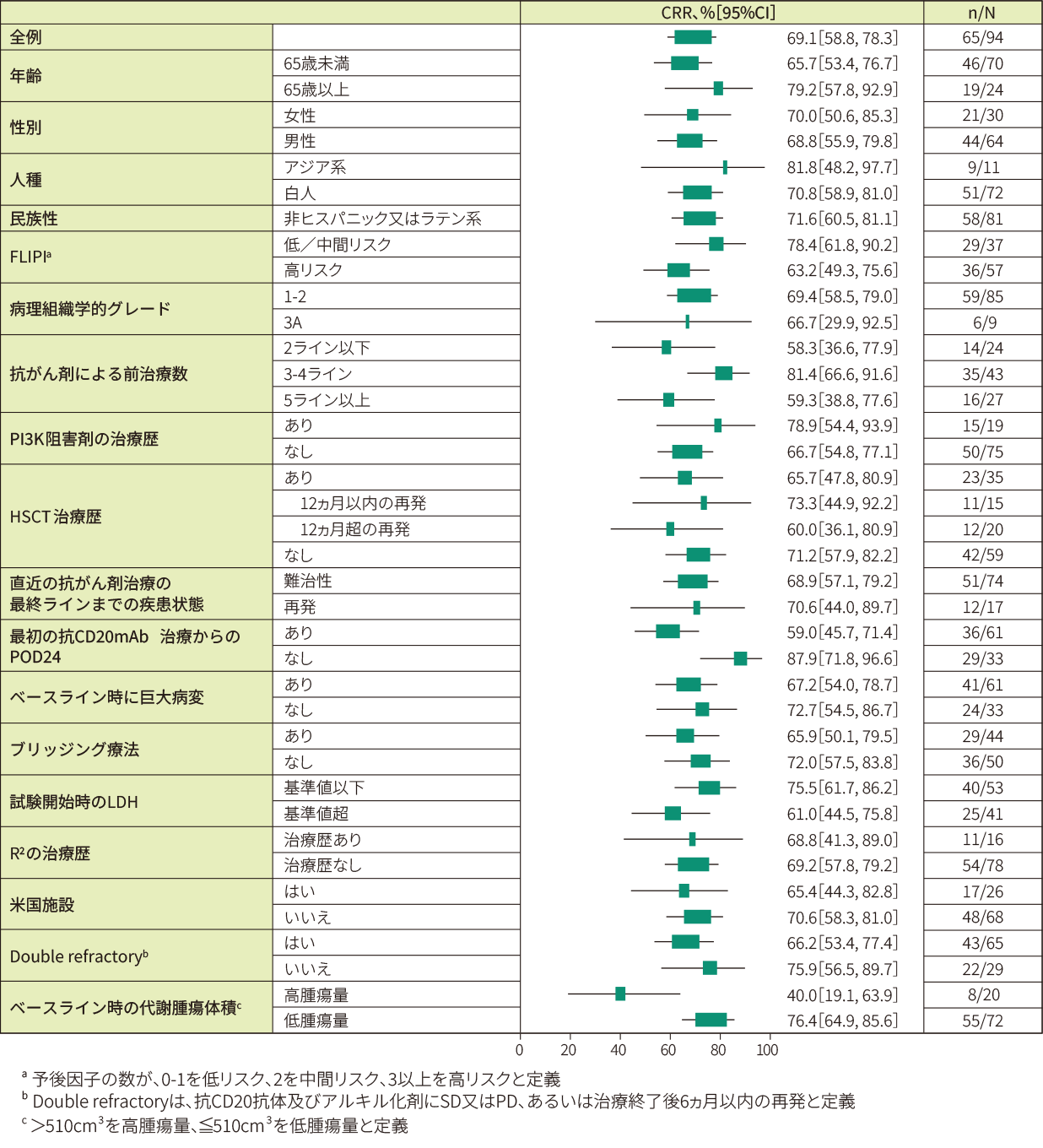
奏効例(81例)における9ヵ月時点での奏効維持率は76.0%でした。12ヵ月追跡調査解析時点で、IRC判定によるDORの中央値は推定できませんでした。<副次評価項目>
- Kaplan-Meier法で推定したIRC判定に基づく奏効期間の曲線(EAS)
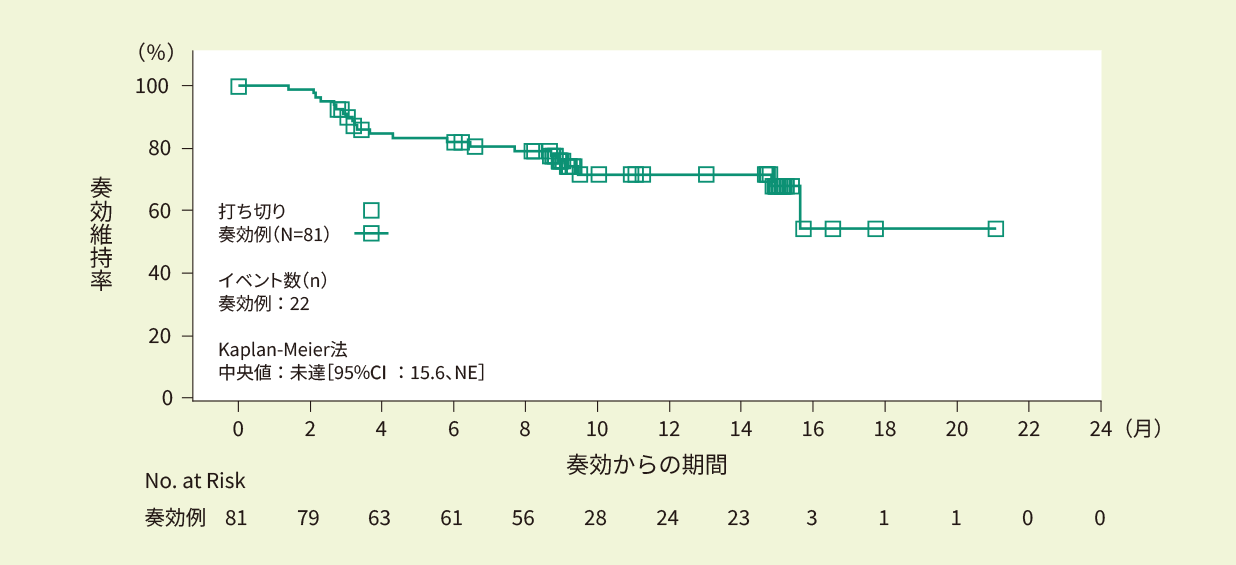
全例(94例)における12ヵ月時点での無増悪生存率は67.0%でした。観察期間中央値は18.4ヵ月と推定されましたが、18ヵ月時点以降のリスク集合が小さいため解釈には注意が必要です。<副次評価項目>
- Kaplan-Meier法で推定したIRC判定に基づくPFS曲線(EAS)
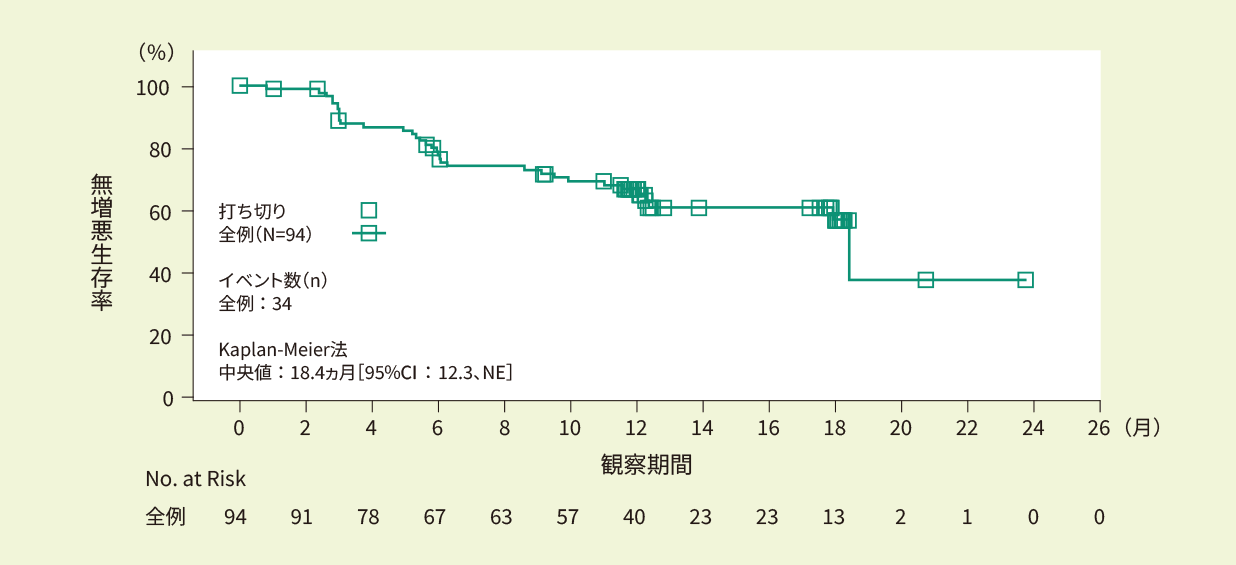
全例(94例)における12ヵ月時点での全生存率は95.3%、18ヵ月時点で91.6%でした。全生存期間の中央値は推定できませんでした。<副次評価項目>
- Kaplan-Meier法で推定したIRC判定に基づく全生存期間の曲線(EAS)
安全性
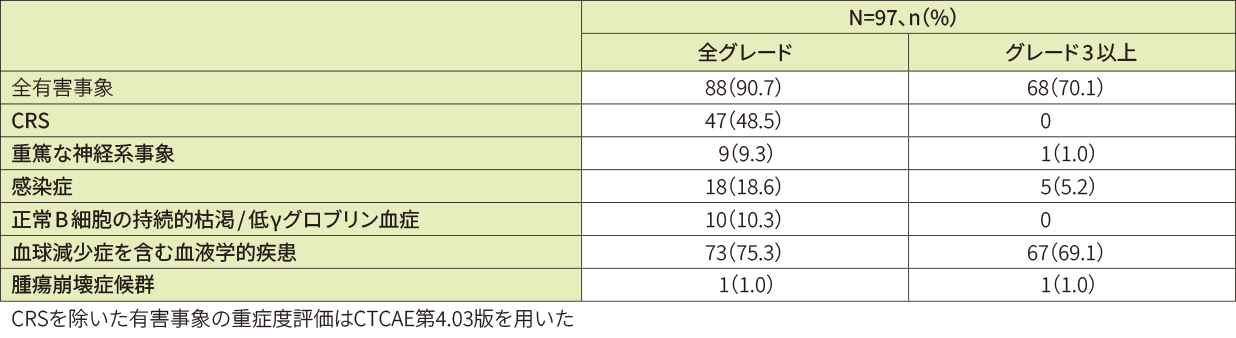
データカットオフ日(2021年3月)時点では、安全性解析対象97例中76例(78.4%)に副作用が認められました。比較的よくみられた副作用(10%以上)は、CRS47例(48.5%)、好中球減少症20例(20.6%)、貧血13例(13.4%)、低γグロブリン血症及び好中球数減少各10例(10.3%)でした。また、重篤な副作用は29例(29.9%)に認められました。主な重篤な副作用はCRS18例(18.6%)、肺炎3例(3.1%)、脳症及び発熱性好中球減少症2例(2.1%)等でした。
主な重篤な副作用のうちグレード3以上は、肺炎及び発熱性好中球減少症各2例(2.1%)、CRS、脳症等各1例(1.0%)でした。
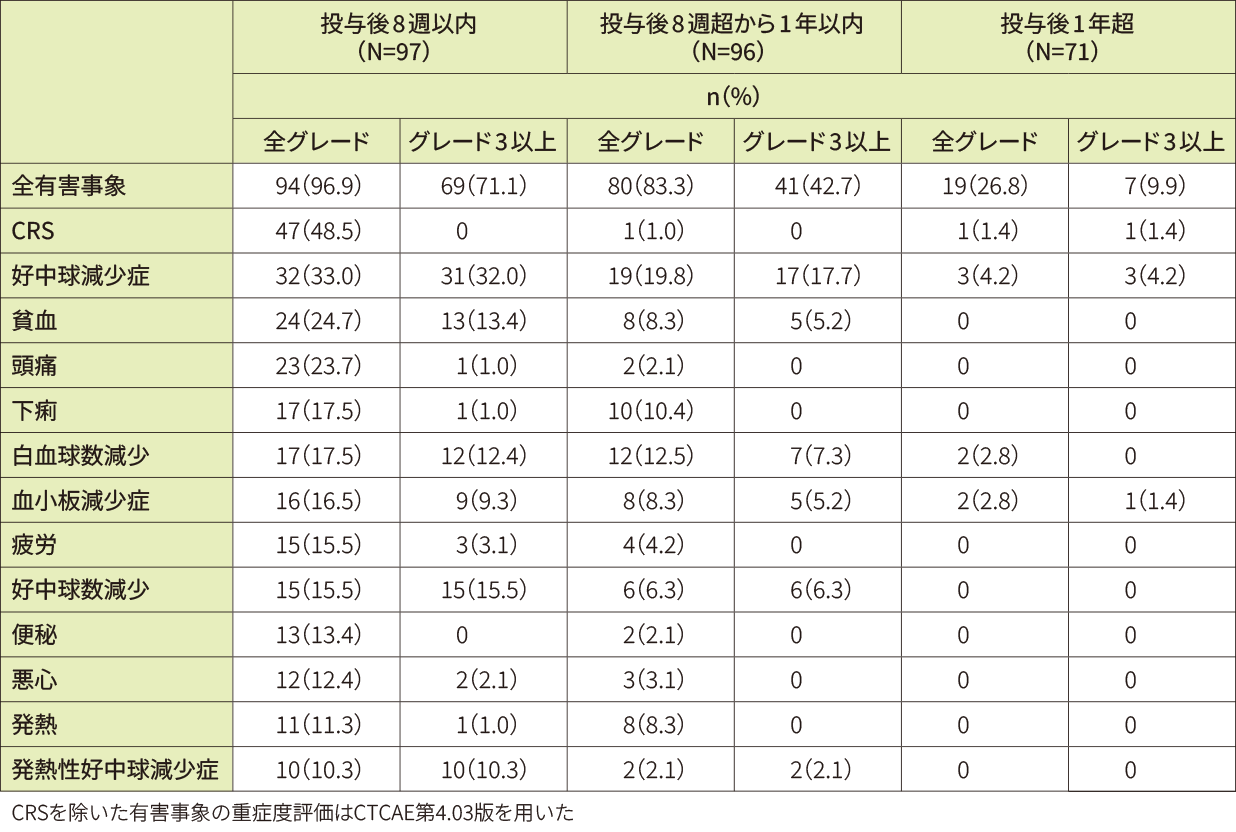
有害事象は96例(99.0%)に認められました。20%以上に認められた全グレードの有害事象は、CRS48例(49.5%)、好中球減少症41例(42.3%)、貧血25例(25.8%)、頭痛24例(24.7%)、下痢及び白血球数減少各21例(21.6%)でした。
グレード3以上の有害事象の多くは8週以内に認められました。
重篤な有害事象は42例(43.3%)に認められました(投与後8週以内:27.8%、8週超から1年以内:19.8%、1年超:7.0%)。全グレードで発現率5%以上に認められた重篤な有害事象は、CRS19例(19.6%)、肺炎8例(8.2%)、発熱性好中球減少症6例(6.2%)でした。
CRSの発現までの期間の中央値は4日、持続期間の中央値は4日でした。CRSに対して実施した主な抗サイトカイン療法は、トシリズマブ(16例、うちコルチコステロイド併用3例)の投与でした。また、重篤な神経系事象は、頭痛7例(7.2%)、ICANS 4例(4.1)、脳症3例(3.1%)等でした。
- 特に注意を要する有害事象(キムリア投与後8週以内)(データカットオフ日:2021年3月)
- 発現率10%以上の全グレード及びグレード3以上の有害事象
試験中止に至った有害事象は認められませんでした。
死亡は7例(7.2%)に認められ、いずれも投与後30日以降に死亡しました。死因は5例が疾患進行、1例が有害事象、1例が安楽死でした。有害事象による死亡例では、Day 7に初回のCRS(Grade 1)が発現し、抗サイトカイン療法は要さずにDay 30に回復しました。Day 368に2回目のCRSが発現し、Day 375に死亡しました。
本患者は肺炎(Day 296)、脳症(Day 345)、敗血症(Day 345)、急性腎障害(Day 361)、胃腸潰瘍(Day 365)を併発していました。治験担当医師はこれらすべての事象をキムリアとの関連ありと判断しました。
キムリア投与後3ヵ月時点の血中CAR導入遺伝子レベルは96 copies/μgでしたが、6ヵ月時点及び9ヵ月時点(それぞれ死亡の6ヵ月前及び3ヵ月前)は定量下限以下でした。12ヵ月時点(死亡の2週間前)及び死亡時の測定検体は採取されておらず、キムリアとの関連性を裏付ける検査結果は得られませんでした。
また、剖検の結果、マクロファージ活性化症候群が確認されました。FLの再発を示唆する所見は認められませんでした。
脳を含むマクロファージ凝集部位のCD19免疫組織染色ではCD19陽性細胞は認められず、キムリアとの関連性を特定するには至りませんでした。
| 【効能、効果又は性能】 1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない患者に限る。 ・初発の患者では標準的な化学療法を2回以上施行したが寛解が得られない場合 ・再発の患者では化学療法を1回以上施行したが寛解が得られない場合 ・同種造血幹細胞移植の適応とならない又は同種造血幹細胞移植後に再発した場合 2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない、かつ、自家造血幹細胞移植の適応とならない又は自家造血幹細胞移植後に再発した患者に限る。 ・ 初発の患者では化学療法を2回以上、再発の患者では再発後に化学療法を1回以上施行し、化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合 ・ 濾胞性リンパ腫が形質転換した患者では通算2回以上の化学療法を施行し、形質転換後には化学療法を1回以上施行したが、形質転換後の化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合 3. 再発又は難治性の濾胞性リンパ腫。ただし、以下の場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない患者に限る。 ・初発の患者では全身療法を2回以上、再発の患者では再発後に全身療法を1回以上施行し、全身療法により奏効が得られなかった又は奏効が得られたが再発した場合 《効能、効果又は性能に関連する使用上の注意》 1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病 (1)25歳以下(投与時)の患者に使用すること。 (2)フローサイトメトリー法又は免疫組織染色法等により検査を行い、CD19抗原が陽性であることが確認された患者に使用すること。 (3)臨床試験に組み入れられた患者の前治療歴等について、【臨床成績】の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。 2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫、再発又は難治性の濾胞性リンパ腫 (1)臨床試験に組み入れられた患者の組織型、前治療歴等について、【臨床成績】の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。 |
BOR: best overall response;最良総合効果
CAR: chimeric antigen receptor;キメラ抗原受容体
CI: confidence interval;信頼区間
CR: complete response;完全奏効
CRR: complete response rate;完全奏効率
CRS: cytokine release syndrome;サイトカイン放出症候群
DOR: duration of response;奏効期間
EAS: efficacy analysis set;有効性解析対象集団
ECOG: Eastern cooperative oncology group;米国東海岸がん臨床試験グループ
FL: follicular lymphoma;濾胞性リンパ腫
FLIPI: follicular lymphoma international prognostic index;濾胞性リンパ腫国際予後指標
HSCT: hematopoietic stem cell transplantation;造血幹細胞移植
IRC: independent review committee;独立審査委員会
LDH: Lactate dehydrogenase;乳酸脱水素酵素
mAb: monoclonal antibody;モノクローナル抗体
NE: not estimable;推定不能
ORR: overall response rate;全泰効率
OS: overall survival;全生存期間
PD: progressive disease;進行
PFS: progression free survival;無増悪生存期間
PI3K: phosphoinositide 3-kinase;ホスファチジルイノシトール3-キナーゼ
POD24: progression of disease within 24 months;治療開始から24ヵ月以内の増悪又は死亡
PPS: per protocol set;Per-Protocol集団
PR: partial response;部分奏効
PS: performance status
QOL: quality of life;生活の質
R2: レナリドミド、リツキシマブ
SD: stable disease;安定




