

MSの病態から考える抗CD20抗体療法の背景
日本における多発性硬化症(MS)の患者数はこの10年で倍増した。治療薬の開発も急速に進み、現在では20種類以上の疾患修飾薬(DMD)が存在する。2024年6月現在、わが国では8種類が承認されている。
MSは1868年にCharcotによって病理概念が提唱された後、1965年にSchumacherらにより「空間的かつ時間的多発性を満たす原因不明の中枢神経系脱髄疾患」と臨床的に定義された1)。MSは原因不明を前提とし、原因が同定された、視神経脊髄炎と区別されるようになったが、ではなぜ原因がわかっていないMSに対し抗CD20抗体療法が行われるようになったのだろうか。
MSは、疾患モデルの実験的自己免疫性脳脊髄炎(EAE)が自己免疫性T細胞のみで発症することが確認され2)、長らくT細胞媒介性疾患と考えられてきた。一方で、以前からMS患者では脳脊髄液中にオリゴクローナルバンド(OCB)が検出されることが知られていた3)。2000年代になり、OCBのバンド数がMSの重症度と関連しており4)、OCBは脳脊髄液中のB細胞により産生されることが報告され5)、また、進行型MS患者に
おいて髄膜にB細胞を含む異所性リンパ濾胞様構造が見いだされ6)、B細胞濾胞が大脳皮質の神経細胞脱落と関連していることなどが明らかとなった7)。こうしたことから、末梢でB細胞の活性化が生じて移行先の中枢神経系で成熟し、その最終像としてB細胞濾胞が形成されると推察され8)、MSに対してB細胞除去が試みられるようになった。
B細胞は骨髄の幹細胞から分化成熟し、抗体を産生する形質細胞に至る9)。免疫不全に陥ることなくB細胞を除去するには、幹細胞と形質細胞には発現しない細胞表面マーカーを標的とする必要がある。その要件を満たしたのがCD20であり、MSにおけるB細胞除去として抗CD20抗体療法が始まった。
抗CD20抗体療法による免疫再構築の可能性
近年、抗CD20抗体療法の作用機序はB細胞除去に留まらないことが注目されつつある。CD20はB細胞だけではなくT細胞の一部にも発現するが、MS患者では特に脳脊髄液でCD20陽性T細胞が増加しており、総合障害度スケール(EDSS)との相関が認められる10)。一方で、抗CD20抗体療法により制御性T細胞が増加することが示され、抗CD20抗体療法の効果の一部に寄与している可能性が示唆されている11)。さらに、抗CD20抗体療法ではB細胞が減少するが、骨髄の幹細胞は影響されないため再構成が起こり、炎症性のB細胞が減り制御性B細胞が増えることが示された12)。このことから、MSではB細胞のバランスが炎症へ傾いているが、抗CD20抗体療法で一度B細胞を除去してリセットすることにより、免疫のバランスが改善されることが示唆されている(参考情報)12)。さまざまなデータを勘案すると、抗CD20抗体療法は単なるB細胞除去を超えて「免疫再構築療法」とも言えると考えられる13)。
一般的に抗体製剤は髄液中へ移行しにくい。そのため、末梢血とリンパ節でいかに効果を発揮させるかがこの治療の鍵を握る。スウェーデンとデンマークで行われたコホート研究(MSレジストリ)では、抗CD20抗体薬(国内未承認)を早期に導入したスウェーデンの患者群でMSの進行抑制が示された14)。B細胞が中枢神経系に移行する前の段階で病変形成を阻止するためには、早期の抗CD20抗体療法開始が重要となる。
再発を伴うMSに対するオファツムマブの有効性および安全性
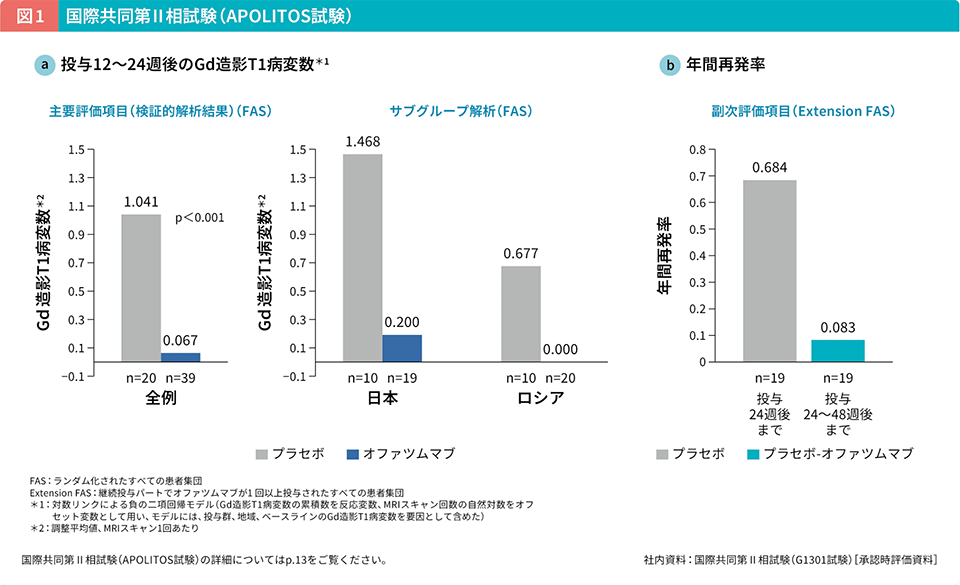
再発を伴うMS患者に対するオファツムマブの有効性および安全性を検証した2つの海外第Ⅲ相試験は、対照薬のteriflunomideが国内未承認であったことから、ブリッジング試験として日本人患者を含む小規模な国際共同第Ⅱ相試験(APOLITOS試験)が実施された(図1)15)。その結果、主要評価項目(検証的な解析項目)である投与12~24週後の1スキャンあたりのGd造影T1病変数は、オファツムマブ群でプラセボ群に比べて93.6%減少し、プラセボ群に対する優越性が検証された[検証的解析結果。当該病変数の相対的な減少率を「1ー当該病変数の比」で算出し、割合(%)として表記]。また、プラセボ群を投与24週後にオファツムマブに切り替えた結果、年間再発率は投与24週後までは0.684で、投与24~48週後では0.083であった。投与24週時における有害事象発現率はオファツムマブ群 69.8%(30/43例)、プラセボ群81.0%(17/21例)であり、有害事象プロファイルも海外第Ⅲ相試験と同様であった。APOLITOS試験はプラセボから実薬へ連続した治療で変化を観察することができ、オファツムマブの効果を知る上で非常にインパクトの大きい試験であった。
抗CD20抗体療法では免疫グロブリン濃度の低下が懸念されるが、海外第Ⅲ相試験および国際共同第Ⅱ相試験を終了した患者を対象に、オファツムマブを継続投与した海外第Ⅲb相試験(ALITHIOS試験:多発性硬化症の早期介入と病状進行管理 図2および海外第Ⅲb相試験〔ALITHIOS試験〕 試験概要)では、最長3.5年までの経過観察において、血清IgM濃度の漸減を認めたものの基準値範囲内であった16)。IgM濃度およびIgG濃度の低下と重篤な感染症との関連性は示されなかった16)。
また、オファツムマブのMSを対象とした臨床試験で進行性多巣性白質脳症(PML)の報告はされなかった17)。同様に、B型肝炎ウイルス(HBV)の再活性化による肝炎も報告されなかった17)。しかしながら、これらのリスクには十分注意し、特にHBV再活性化予防のため、オファツムマブ投与前にHBs抗原、HBs抗体およびHBc抗体を測定しておく必要がある。
オファツムマブは、少量頻回投与により免疫不全を引き起こすリスクを低減しつつ、効果を発揮するよう設計されている。維持期は4週間に1回の皮下投与で済むことから、患者の日常生活における負担も少ない。免疫再構築療法としての側面も有しており、オファツムマブはMS治療において重要な役割を果たす可能性が期待される。
1)Schumacher GA, et al.: Ann N Y Acad Sci. 1965; 122: 552-568.
2)Zamvil S, et al.: Nature. 1985; 317(6035): 355-358.
3)Laterre EC, et al.: Neurology. 1970; 20(10): 982-990.
4)Avasarala JR, et al.: Arch Neurol. 2001; 58(12): 2044-2045.
5)Obermeier B, et al.: Nat Med. 2008; 14(6): 688-693.
6)Serafini B, et al.: Brain Pathol. 2004; 14(2): 164-174.
7)Magliozzi R, et al.: Ann Neurol. 2010; 68(4): 477-493.
8)Eggers EL, et al.: JCI Insight. 2017; 2(22): e92724.
9)Comi G, et al.: Ann Neurol. 2021; 89(1): 13-23.
10)von Essen MR, et al.: Brain. 2019; 142(1): 120-132.
11)Howlett-Prieto Q, et al.: Mult Scler. 2021; 27(14): 2170-2179.
12)Li R, et al.: Sci Transl Med. 2015; 7(310): 310ra166.
13)Cencioni MT, et al.: Nat Rev Neurol. 2021; 17(7): 399-414.
14)Spelman T, et al.: JAMA Neurol. 2021; 78(10): 1197-1204.
15)Kira J, et al.: Mult Scler. 2022; 28(8) :1229-1238.
16)Hauser SL, et al.: Mult Scler. 2022; 28(10): 1576-1590.
17)ケシンプタ皮下注20mgペン電子添文:2024年 6月改訂(第5版)
ご所属、ご講演内容については2024年12月作成時点のものです