クロザリル 国内臨床試験
治療抵抗性統合失調症患者に対するClozapineの安全性と有効性を検討する24週間、多施設共同、オープン試験(第Ⅲ相試験:1301試験)1)
■ 目的
治療抵抗性統合失調症患者に対するクロザリルの安全性と有効性を24週間にわたり検討する。
■ 対象
治療抵抗性統合失調症患者
以下の基準をすべて満たす患者を対象とした。
- DSM-IV診断基準により「統合失調症」と診断された患者
下記に示した抗精神病薬による治療のうち、2つ以上に反応がみられなかった注)治療抵抗性の患者:
・リスペリドン4mg/日以上を6週間以上投与
・ペロスピロン24mg/日以上を6週間以上投与
・オランザピン15mg/日以上を6週間以上投与
・クエチアピン400mg/日以上を6週間以上投与
(注)治療に反応がみられない:GAF評点が41点以上に相当する状態になったことがないこと
- 性別不問、同意取得時18歳以上65歳未満の患者
- 入院患者
- Visit1(登録前)のBPRS合計点が45点以上の患者
- 本人及び代諾者から治験参加の文書同意が得られた患者
■ 症例(評価例)数
43例
■ 試験デザイン及び投与方法
試験デザイン:
多施設共同、非対照、非盲検試験
投与方法:
初回投与日には12.5mgを1日1回朝投与した。原則として、3週間かけて200mg/日まで増量することとし、有害事象発現により規定の漸増が困難であると医師が判断した場合には、より緩徐な増量を行うことを可とした。漸増終了後は、臨床効果と耐容性を観察しながら、医師の判断により適宜増減*した。また、最大効果が得られた後は、漸減して可能な限り低用量で維持することとした。
*増量については、以下の留意事項に従うこととした。
- 4日間以上、同じ用法用量で投与した後でないと増量してはいけない。
- 1回の増量は100mgを上限とする。
- 投与量が200mg/日以上の場合は分割投与とする。
300mg/日以上である場合には3分割以上の投与が望ましい。また、総1日量は均等に分けずに、就寝時に多く投与してもよい。 - 1日投与量は600mgを上限とする。
投与中止時:
好中球減少症・無顆粒球症、心筋炎・心筋症等の重篤な有害事象発現のため本薬の投与を緊急に中止しなくてはならない場合は、精神症状の再燃など十分に注意した。また、緊急を要さない場合は、2週間かけ精神症状の変化に注意しながら漸減終了することとした。
投与期間:
治療期24週間(漸増期3週間、維持期21週間)、漸減期2週間(中止時)、後観察期4週間
| 国内で承認されたクロザリルの用法及び用量 通常、成人にはクロザピンとして初日は12.5mg(25mg錠の半分)、2日目は25mgを1日1回経口投与する。 3日目以降は症状に応じて1日25mgずつ増量し、原則3週間かけて1日200mgまで増量するが、1日量が50mgを超える場合には2~3回に分けて経口投与する。維持量は1日200~400mgを2~3回に分けて経口投与することとし、症状に応じて適宜増減する。ただし、1回の増量は4日以上の間隔をあけ、増量幅としては1日100mgを超えないこととし、最高用量は1日600mgまでとする。 |
■ 評価項目
主要評価項目:
安全性
有害事象、血液学的一般検査、Clozapine患者モニタリングシステム(CPMS-J)の一般化可能性
副次評価項目:
有効性
BPRS(Brief Psychiatric Rating Scale)合計スコア変化量の推移、BPRS合計スコア20%以上の改善例の割合
以下の18項目*からなり、評価は「1.なし」、「2.ごく軽度」、「3.軽度」、「4.中等度」、「5.やや重度」、「6.重度」、及び「7.最重度」の7段階で行った。
*心気症、不安、情動的引きこもり、概念の統合障害、罪責感、緊張、衒奇症と不自然な姿勢、誇大性、抑うつ気分、敵意、猜疑心、幻覚による行動、運動減退、非協調性、不自然な思考内容、情動の平板化、興奮、見当識障害
看護師によるClinical Global Impression of Change(CGI-C)
CGI-Cは全般評価に関するベースラインからの変化を示す。「1.著明改善(Very much improved)」、「2.中等度改善(Much improved)」、「3.軽度改善(Minimally improved)」、「4.不変(No change)」、「5.軽度悪化(Minimally worse)」、「6.中等度悪化(Much worse)」、「7.著明悪化(Very much worse)」の7段階で患者の状態を評価した。なお、評価者は医師に相談することなく独自の判断により評価した。
第三者によるClinical Global Impression of Severity(CGI-S)
(ビデオ撮影に同意が得られた患者のみ)
CGI-Sは全般評価に関する重症度を示す。「1.Normal, not at all ill(正常)」、「2.Borderline mentally ill(精神疾患の境界線上)」、「3.Mildly ill(軽度の精神疾患)」、「4.Moderately ill(中等度の精神疾患)」、「5. Markedly ill(顕著な精神疾患)」、「6.Severely ill(重度の精神疾患)」、「7.Among the most extremely ill patients(非常に重度の精神疾患)」の7段階で患者の状態を評価した。 ベースライン及び投与12週後で実施されるBPRS評価時の患者の診察状況をビデオに録画した。患者ごとの2本のビデオテープ(ベースライン及び投与12週後)はランダム化され、その後、本試験の実施に関与しない3名の精神科医よりなる第三者評価者が、ランダム化された患者のビデオ映像(最初にベースラインその後投与12週後の閲覧又はその逆)により患者の状態を観察し、個々にCGI-S評価を実施した。
安全性
- DIEPSS(Drug Induced Extra-Pyramidal Symptoms Scale)
- 体重、血圧、脈拍数、体温、心電図、臨床検査
■ 解析計画
BPRSの元データ尺度、投与開始前日からの変化量、CGI-C及びCGI-S評価について記述統計量を算出し、平均値の推移図を作成した。BPRS合計スコアのベースラインとの比較は、paired t検定を用いて行った。ベースラインからのBPRS変化率の20%以上改善例の割合及び両側95%信頼区間を算出した。BPRS、CGI-C及びCGI-Sの計数値については、各カテゴリーの度数及び割合を算出した。
■ 判定基準
BPRS合計スコア改善例とは、投与前のBPRS合計スコアを基準として各評価時点でスコアが20%以上低下した患者と規定した。
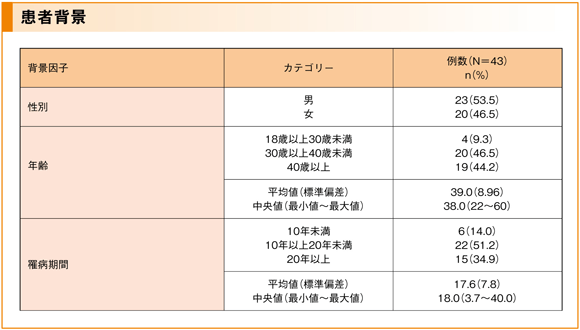
■ 患者背景
■ 安全性
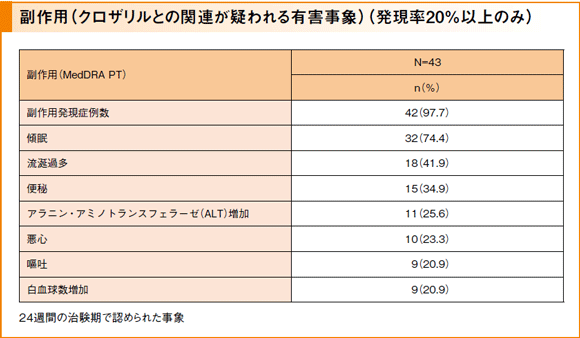
主要評価項目:副作用*
副作用は43例中42例(97.7%)に発現しました。特に発現率が高かった副作用は、傾眠32例(74.4%)で、以下、流涎過多18例(41.9%)、便秘15例(34.9%)、アラニン・アミノトランスフェラーゼ増加11例(25.6%)、悪心10例(23.3%)、嘔吐9例(20.9%)、白血球数増加9例(20.9%)でした。重篤な副作用として、イレウス2件、腸炎1件、発熱1件、腎機能障害1件、無顆粒球症1件が認められました。また、本試験において死亡例は認められませんでした。投与中止にいたった副作用として、好中球減少症2件、心室機能不全1件、白血球数減少1件、腸炎1件、発熱1件、腎機能障害1件、好酸球数増加1件、白血球数増加1件、肝障害1件、無顆粒球症1件、好酸球増加症1件が認められました。
*クロザリルとの関連が疑われる有害事象
また、本試験において、無顆粒球症が1例(2.3%)に発現しましたが、CPMS-Jの投与中止基準に従い、クロザリルの投与は中止され、患者は回復しました。これにより、CPMS-Jは問題なく稼動し、患者の安全性を確保する上で有用なモニタリングシステムであることが確認されました。
■ 有効性
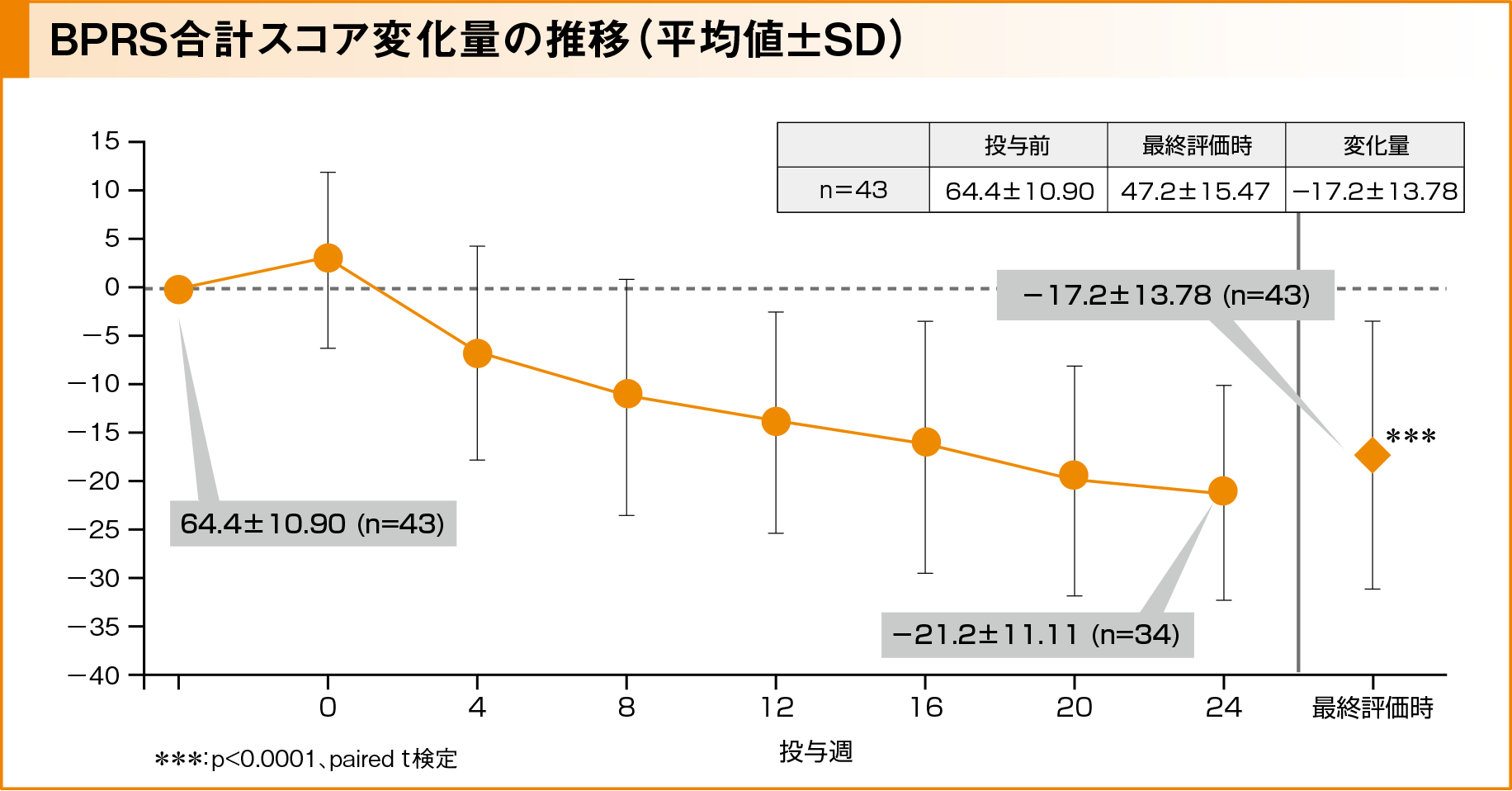
副次評価項目:BPRS合計スコア変化量の推移
BPRS合計スコアは、投与前は64.4±10.90(平均値±標準偏差、以下同様)で、投与4週後から24週後まで低下し、変化量が投与12週後で-14.0±11.33、投与24週後で-21.2±11.11でした。最終評価時のスコアは47.2±15.47、変化量が-17.2±13.78であり、投与前と比較して有意に低下しました(p<0.0001、paired t検定、欠損値はLOCFを用いて補完)。
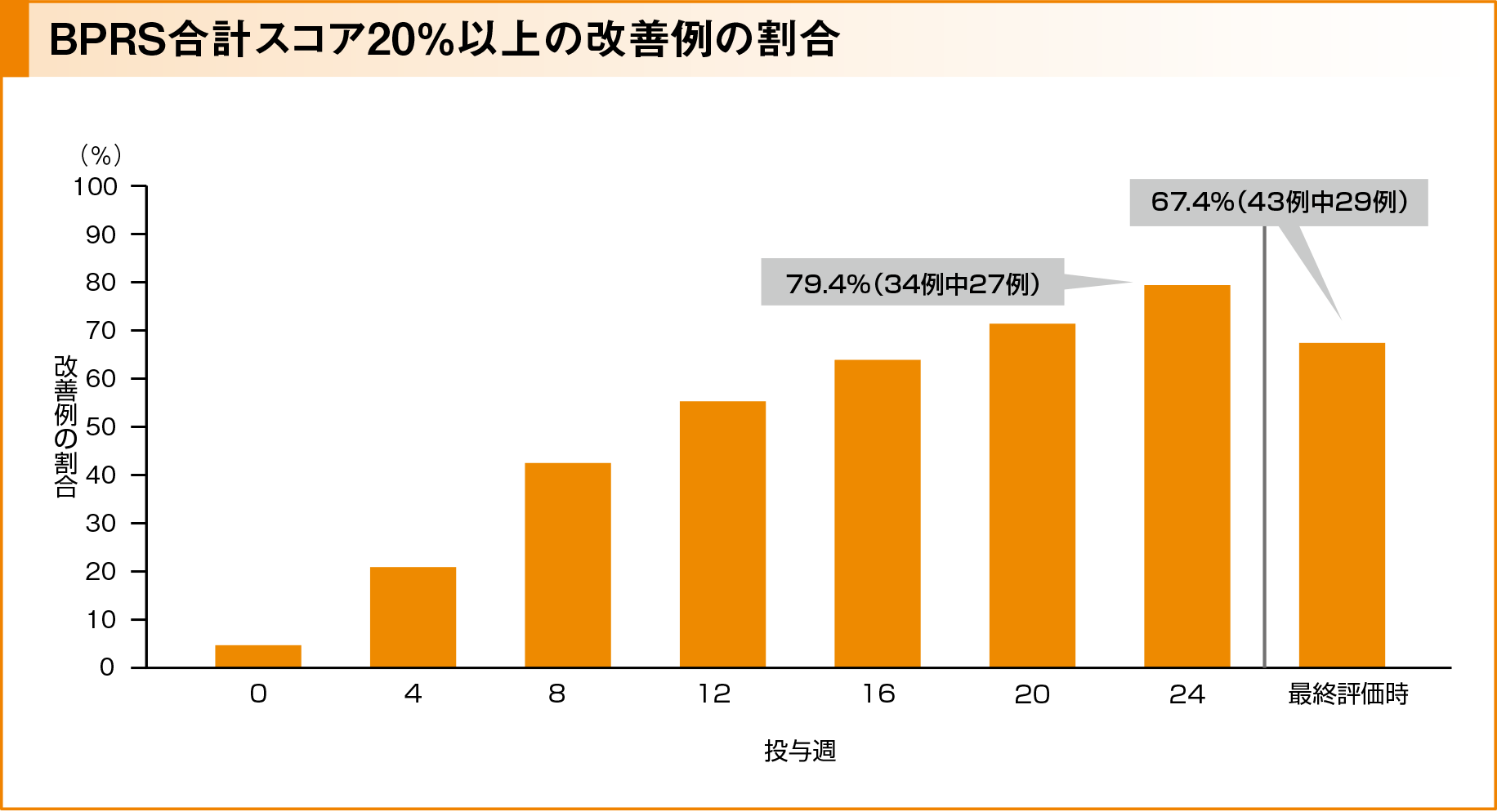
副次評価項目:BPRS合計スコア20%以上の改善例の割合
BPRS合計スコア改善例*は投与4週後から9例に示され、24週後まで増加し、投与12週後で21例(55.3%)、投与24週後で27例(79.4%)、最終評価時で29例(67.4%)でした。
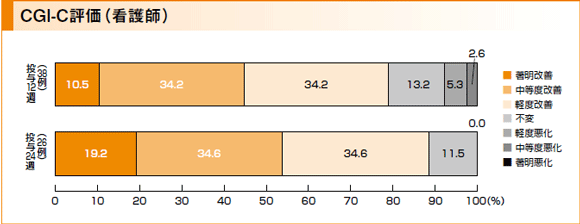
副次評価項目:CGI-C評価
患者の状態(全般評価)について、ベースラインからの変化を看護師独自の判断で評価したところ、投与12週後では、中等度改善以上の患者が38例中17例(44.7%)に、軽度または中等度悪化の患者が38例中3例(7.9%)に示されました。投与24週後では、中等度改善以上の患者が26例中14例(53.8%)に示されましたが、軽度悪化~著明悪化の患者は示されませんでした。
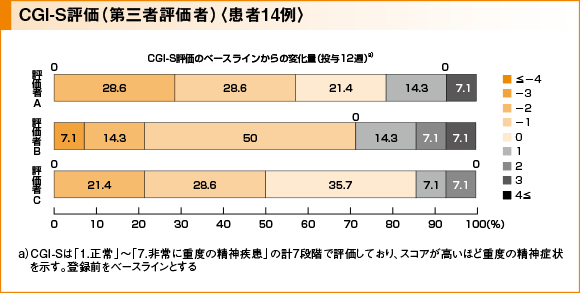
副次評価項目:CGI-S評価
BPRSでの本剤の効果を、他の有効性指標から裏付けるために、第三者の精神科医による患者のビデオ映像に基づくCGI-Sを実施しました。投与12週後にベースラインからスコアが改善した患者は、評価者A、B、及びCで、それぞれ14例中8例(57.1%)、10例(71.4%)、7例(50.0%)、スコアが悪化した患者はそれぞれ14例中3例(21.4%)、4例(28.6%)、2例(14.3%)でした。評価者3名のいずれの評価でも、スコアが4段階以上改善又は悪化した患者は示されませんでした。
主要文献 1)社内資料:治療抵抗性統合失調症患者に対するClozapineの安全性と有効性を検討する24週間、多施設共同、オープン試験(CLEX123J1301)[承認時評価資料(第Ⅲ相試験)] |
クロザリルのお問い合わせ
デジタルコミュニケーターもしくはノバルティスダイレクトへお問い合わせください。
デジタルコミュニケーター
電話番号 0800-222-8814(通話料無料)
業務時間 月〜金 9:00~17:30(祝日及び当社休日を除く)
ノバルティスダイレクト
電話番号 0120-003-293(通話料無料)
受付時間 月〜金 9:00~17:30(祝日及び当社休日を除く)