Revolade® en PTI
Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
El resumen de los componentes físicos y mentales2.
La puntuación del subgrupo de ítems del cuestionario Functional Assessment of Cancer Therapy-thrombocytopenia (FACT-Th6) utilizado para evaluar el impacto de la hemorragia y los hematomas en la calidad de vida de los pacientes2.
Al inicio del estudio, ~51 % de los pacientes tenían un número de plaquetas ≤15.000/μL.
En la semana 1, el 24 % de los pacientes alcanzaron un número de plaquetas ≥50.000/μL vs. el 14 % con placebo.
Las tasas de respuesta con REVOLADE® fueron consistentes entre todos los grupos de edad
Al inicio del estudio, ~62 % de los pacientes tenían un número de plaquetas ≤15.000/μL.
Las tasas de respuesta con REVOLADE® fueron consistentes entre todos los grupos de edad.
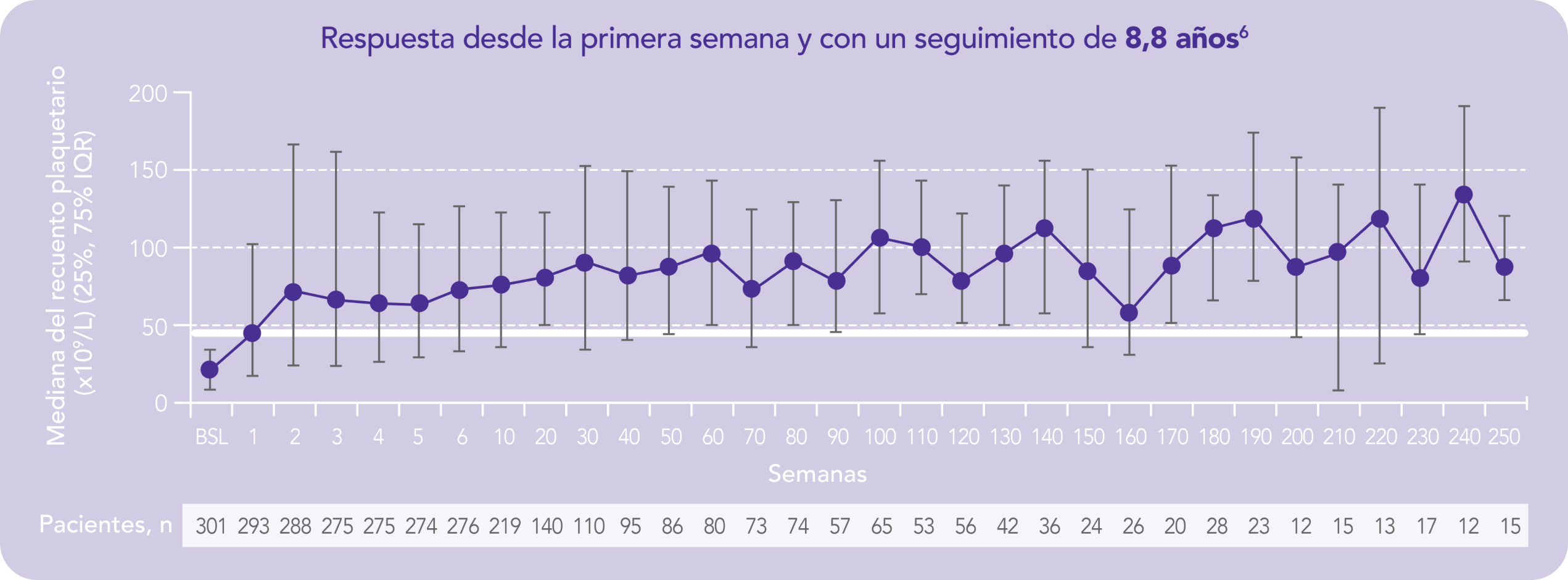
Incluyó a 302 adultos con PTI que habían completado un estudio anterior de REVOLADE®
Los datos son de hasta 8,8 años de tratamiento continuo con REVOLADE®
Incluyó a 197 adultos con PTI previamente tratada y recuento basal de plaquetas <30 x 109/L.
Los pacientes recibieron tratamiento estándar local más REVOLADE® 50 mg una vez al día o placebo durante 6 meses.
- Las modificaciones de dosis se basaron en la respuesta plaquetaria individual, hasta un máximo de 75 mg una vez al día y un mínimo de 25 mg una vez al día.
La variable principal fue la probabilidad de respuesta (definida como un recuento de plaquetas de ≥50 x 109/L y ≤400 x 109/L) durante el tratamiento.
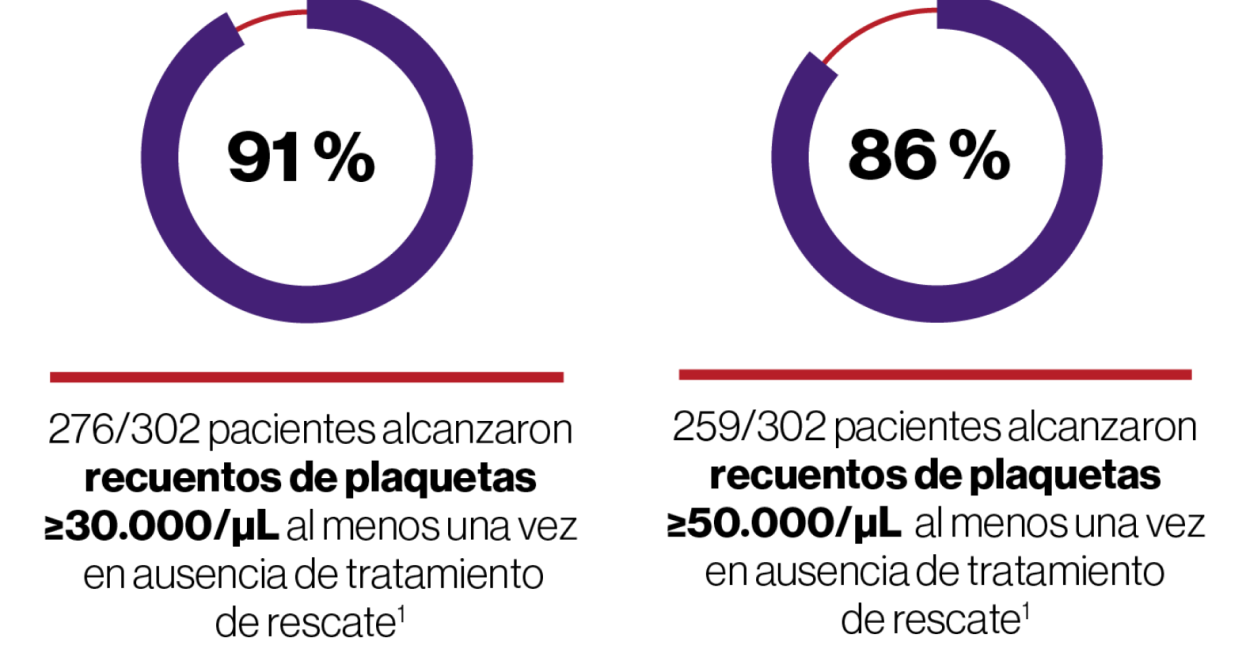
- El 79% de los pacientes tratados con REVOLADE® respondieron al tratamiento al menos una vez durante el estudio frente al 28 % con placebo.
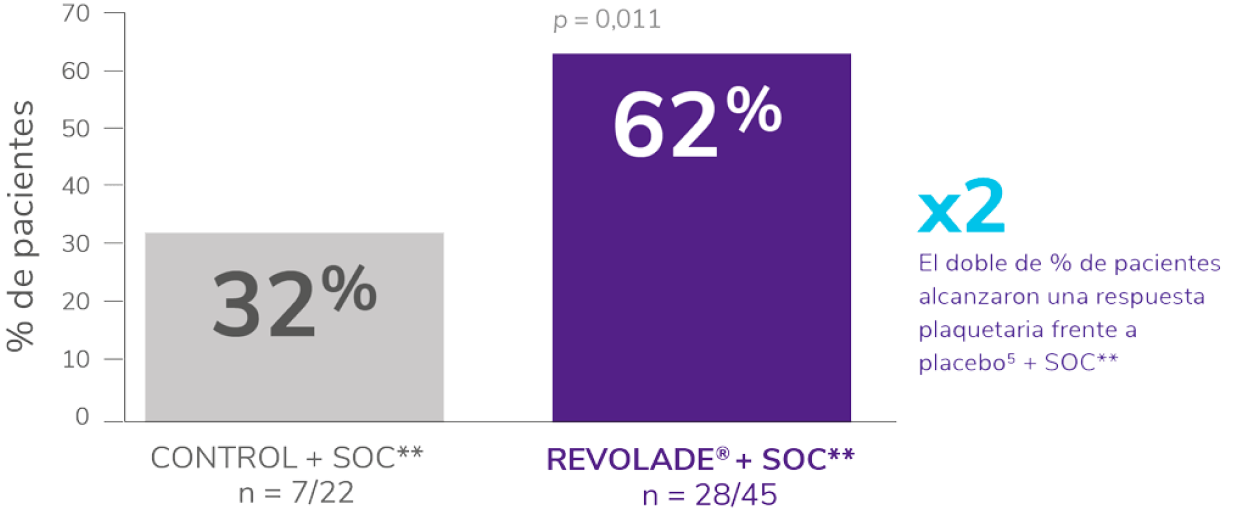
Incluyó a 67 niños ≥ 1 año con PTI de más de 6 meses de duración, en recaída o refractaria.
Los pacientes fueron asignados al azar 2:1 al tratamiento con REVOLADE® (n = 45) o placebo (n = 22) durante 7 semanas.
Se permitió el uso concomitante de una terapia estable de mantenimiento de la PTI (p. ej., corticosteroides).
- El 51 % de los pacientes tenían recuentos de plaquetas ≤15 x 109/L.
- El 84 % de los pacientes tratados con REVOLADE® y el 86 % de los pacientes tratados con placebo habían recibido >2 terapias previas para PTI.
- 5 pacientes en el grupo REVOLADE® y ninguno en el grupo placebo habían sido esplenectomizados previamente.
La variable principal fue la proporción de pacientes que alcanzaron el recuento de plaquetas ≥50 x 109/L al menos una vez entre las semanas 1 y 6 en el periodo aleatorizado, doble ciego del estudio, en ausencia de terapia de rescate.
La fase doble ciego fue seguida por una fase abierta en la que los pacientes recibieron tratamiento con REVOLADE® durante un periodo de hasta 24 semanas.
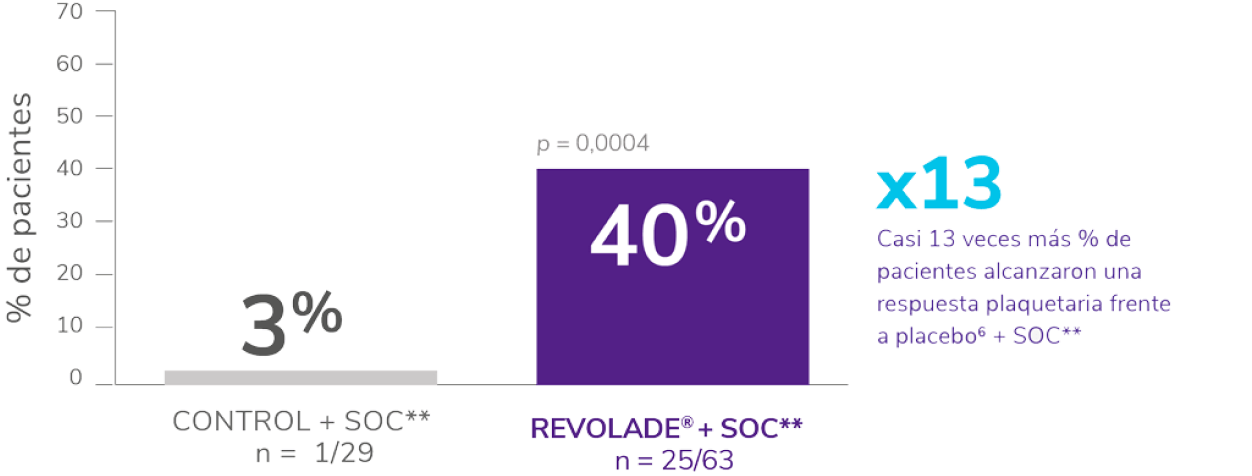
Incluyó a 92 niños ≥1 año con PTI crónica en recaída o refractaria.
Los pacientes fueron asignados al azar 2:1 al tratamiento con REVOLADE® (n = 63) o placebo (n = 29).
Se permitió el uso concomitante de una terapia estable de mantenimiento de la PTI (p. ej., corticosteroides).
Al inicio del estudio:
- El 62 % de los pacientes tenían recuentos de plaquetas ≤15 x 109/L.
- El 73 % de los pacientes tratados con REVOLADE® y el 90 % de los pacientes tratados con placebo habían recibido >2 terapias previas para PTI.
- 4 pacientes en el grupo REVOLADE® y ninguno en el grupo placebo habían sido esplenectomizados previamente.
La variable principal fue la proporción de pacientes que alcanzaron el recuento de plaquetas ≥50 x 109/L durante ≥6 semanas entre las semanas 5 y 12 en el periodo aleatorizado, doble ciego del estudio en ausencia de terapia de rescate.
- La fase doble ciego fue seguida por una fase abierta con REVOLADE® de 24 semanas.
Grupo de Trabajo de la SEHH y GEPTI. Directrices de diagnóstico, tratamiento y seguimiento de la PTI. 2021. Disponible en: https://www.gepti.es/images/stories/recursos/2022/02/GUIA-PTI-2021.pdf
Abrahamson PE, et al. The incidence of idiopathic thrombocytopenic purpura among adults: a population-based study and literature review. Eur J Haematol. 2009;83(2):83-9.
Hedman A, Henter JI, Hedlund I, et al. Prevalence and treatment of chronic idiopathic thrombocytopenic purpura of childhood in Sweden. Acta Paediatr. 1997;86(2):226-7.
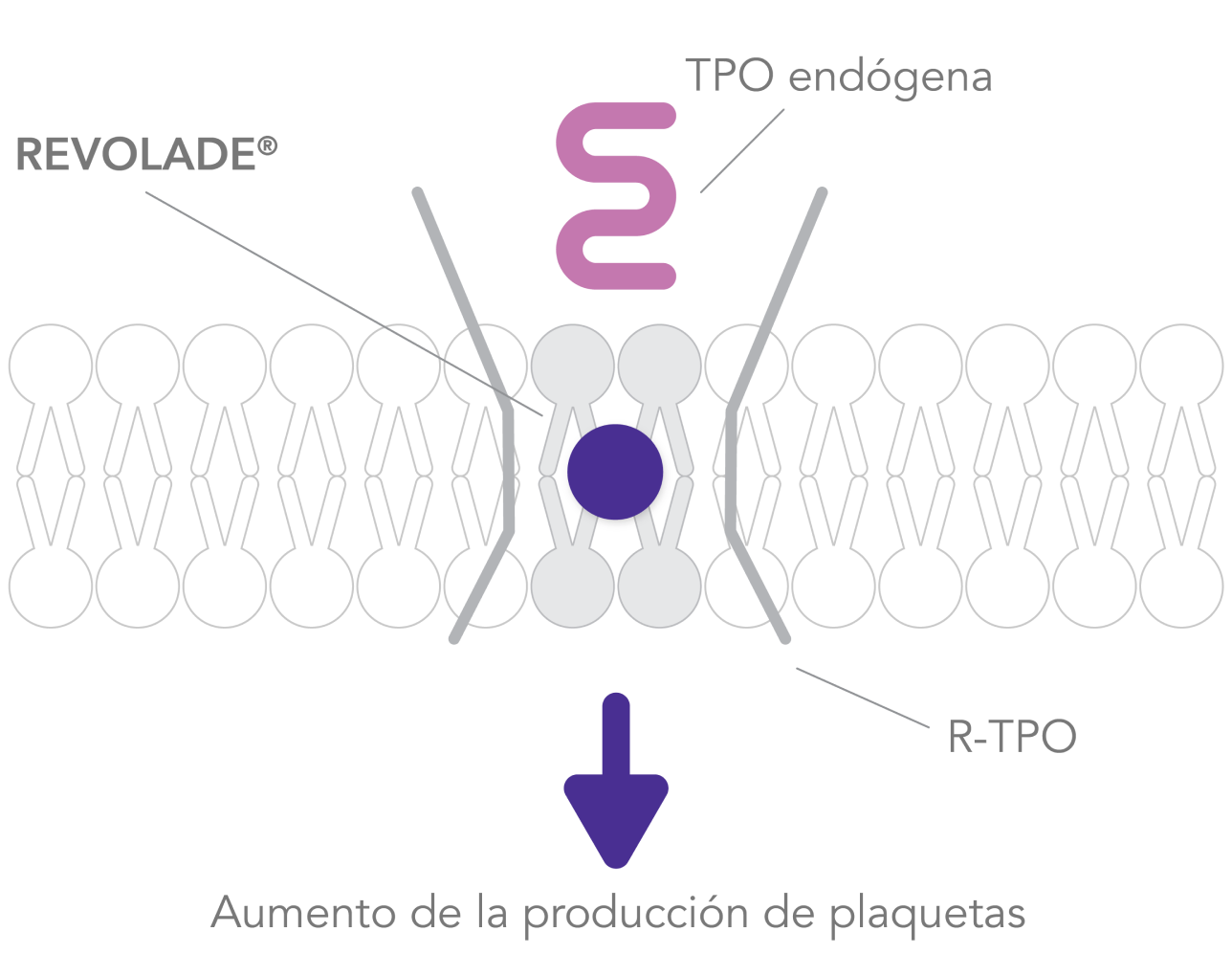
REVOLADE® es un agonista no peptídico del R-TPO(también c-MPL)2 que interactúa con el dominio transmembrana del R-TPO e inicia las cascadas de señalización similares pero no idénticas a las de la TPO endógena, induciendo la proliferación y diferenciación desde las células progenitoras de la médula ósea5
REVOLADE® mejora considerablemente la activación de STAT3/5, AKT y MAPK, en mayor medida que la TPO. Esto lleva a la amplificación de los megacariocitos y la sobreproducción de plaquetas6
Ficha técnica de REVOLADE®.
Kuter DJ. Biology and Chemistry of Thrombopoietic Agents. Semin Hematol. 2010;47(3): 243-8.
Lum SH, et al. Eltrombopag for the treatment of aplastic anemia: current perspectives. Drug Des Devel Ther. 2016;10:2833-43.
Kuter DJ. The biology of thrombopoietin and thrombopoietin receptor agonists. Int J Hematol. 2013;98(1):10-23.
Kuter DJ. New thrombopoietic growth factors. Blood. 2007;109(11):4607-16.
Raslova H, et al. Eltrombopag, a potent stimulator of megakaryopoiesis. Haematologica. 2016;101:1443-5.
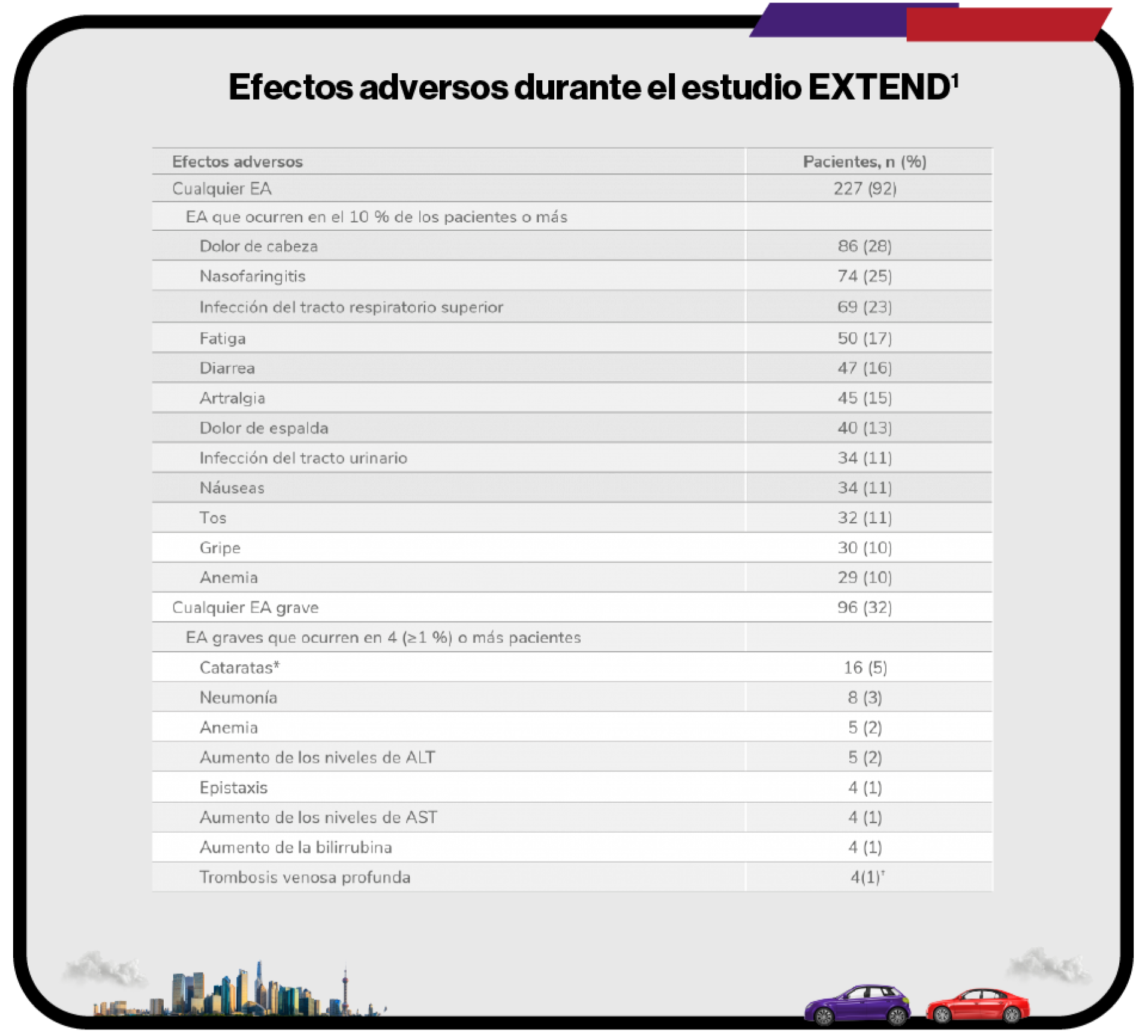
41 pacientes (14 %) abandonaron debido a efectos adversos en el estudio EXTEND a largo plazo1.
Wong RSM, et al.Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-36.
Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. Lancet. 2011;377(9763):393-402.
Khelif A, et al. Changes in health-related quality of life with long-term eltrombopag treatment in adults with persistent/chronic immune thrombocytopenia: Findings from the EXTEND study. Am J Hematol. 2019;94:200-8.
Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015;2(8):e315-25.
Grainger JD, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015;386(10004):1649-58.
Ficha técnica de REVOLADE®.
Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-36. .
Ficha técnica de REVOLADE®.
Bao W, et al. Improved regulatory T-cell activity in patients with chronic immune thrombocytopenia treated with thrombopoietic agents. Blood. 2010;116(22):4639-45.
Ghadaki B, et al. Sustained remissions of immune thrombocytopenia associated with the use of thrombopoietin receptor agonists. Transfusion. 2013;53(11):2807-12.
Liu X, et al. Thrombopoietin receptor agonists shift the balance of Fcγ receptors toward inhibitory receptor IIb on monocytes in ITP. Blood. 2016;128(6):852-61.
Eficacia
Adultos
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
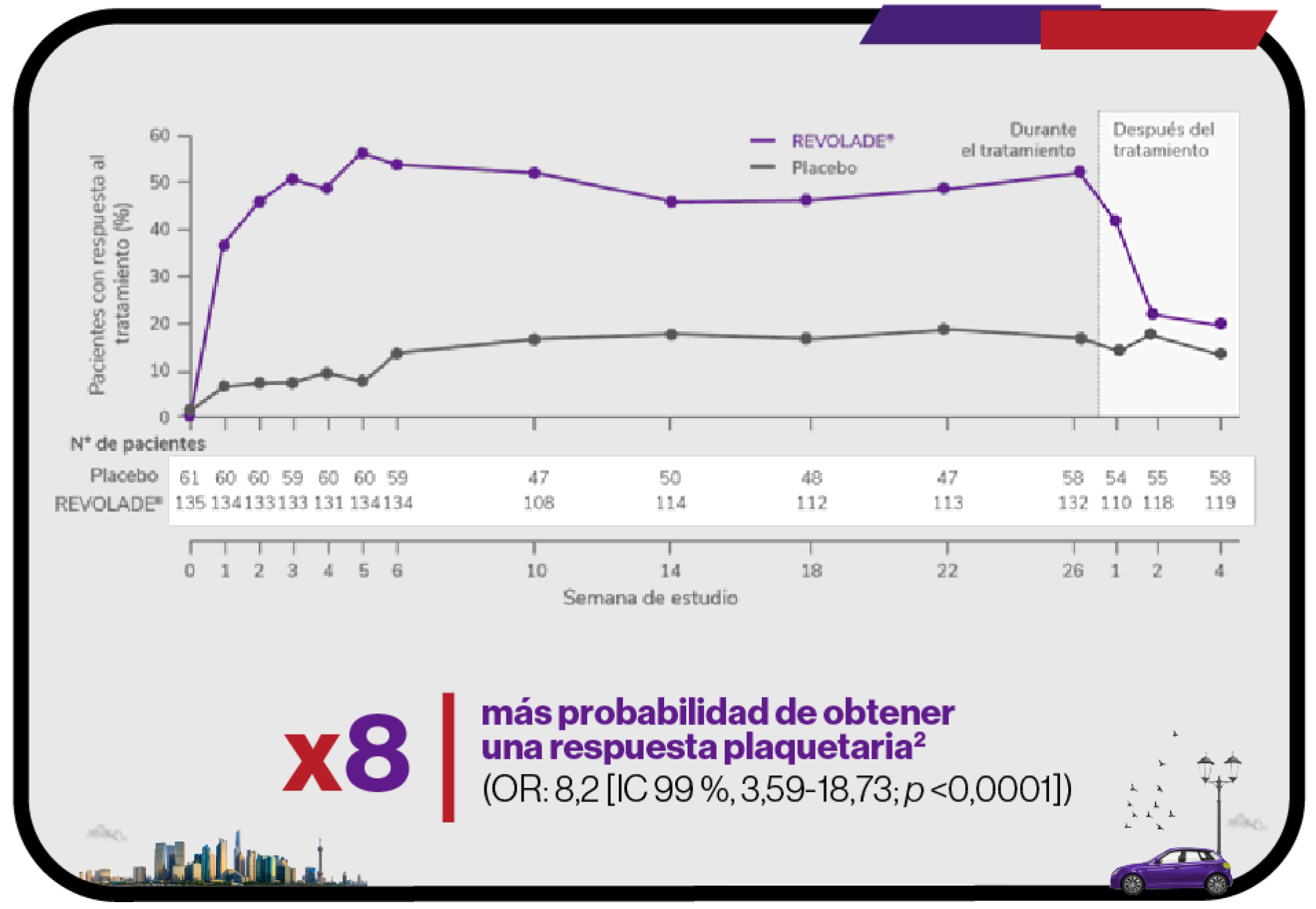
REVOLADE® proporciona una respuesta rápida, sostenida, elevada y significativa1,2
Rápida y sostenida1
Respuesta desde la primera semana y con un seguimiento de 8,8 años1
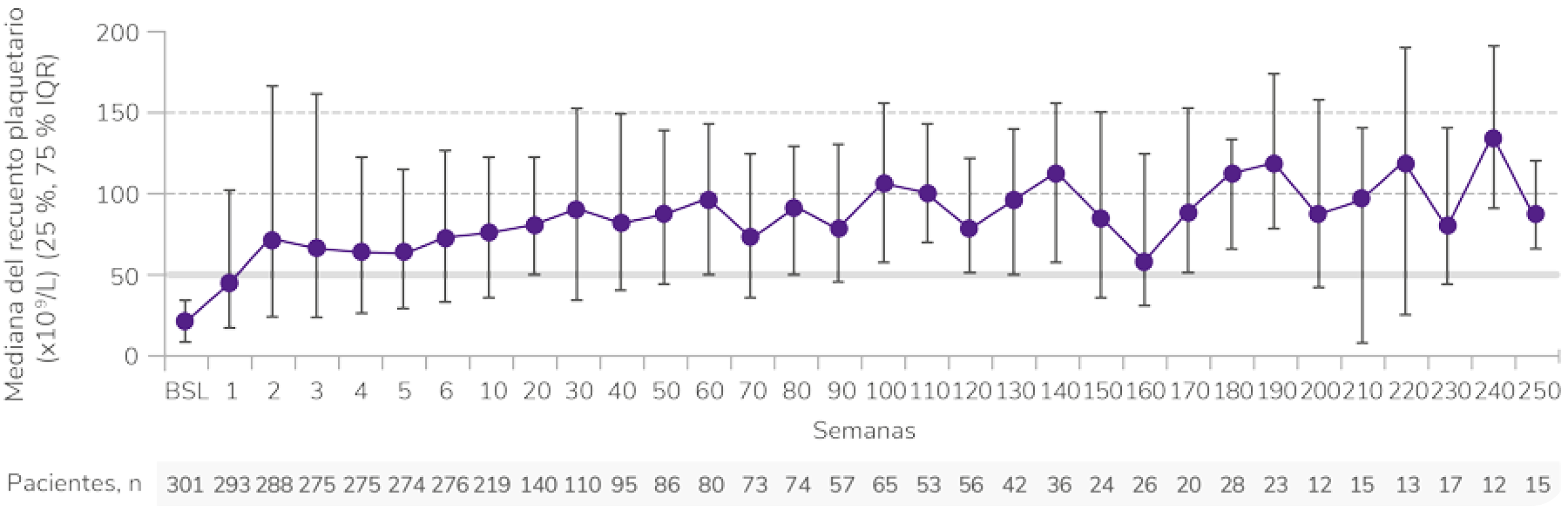
Elevada1

Significativa1
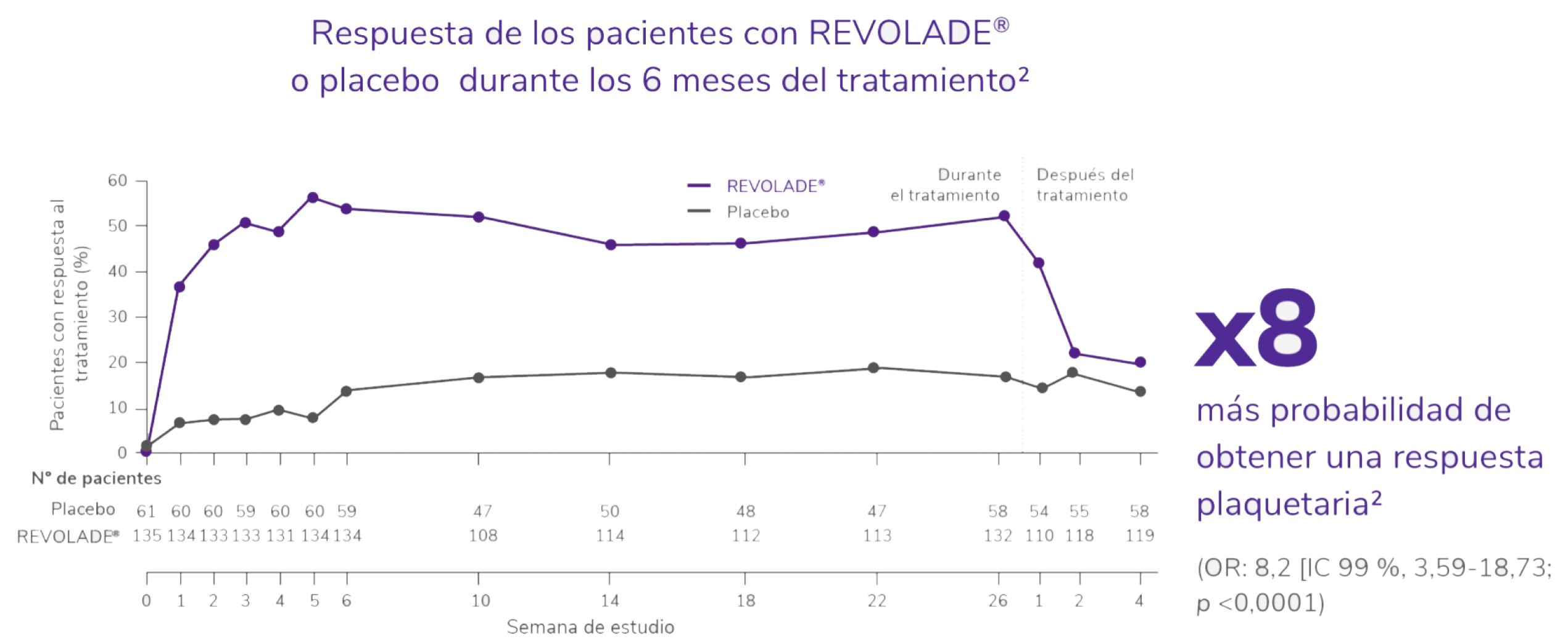
IC: Intervalo de Confianza; OR: odds ratio.
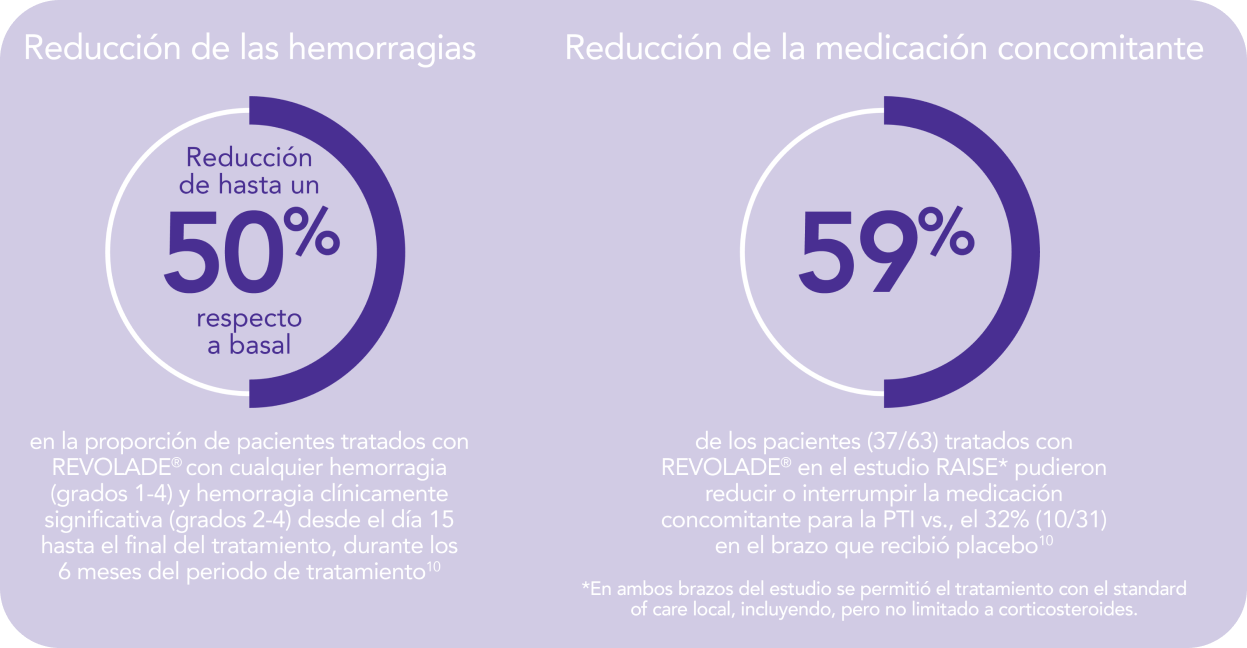
REVOLADE® reduce las hemorragias en pacientes con PTI que son refractarios a un tratamiento previo1,2
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una reducción de las hemorragias1,2
REVOLADE® permite a los pacientes con PTI reducir el uso de medicación concomitante1,2
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® reduce la necesidad de medicación concomitante1,2
Reducción del uso de medicación concomitante

REVOLADE® ha demostrado también mejorar la calidad de vida relacionada con la salud2,3
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® protege y mejora de manera significativa la calidad de vida de los pacientes2,3
Resultados del estudio RAISE2
REVOLADE® mejora significativamente las puntuaciones en algunos dominios de los cuestionarios de calidad de vida SF-36v2 y FACT-Th6 a la semana 262
Cambios medios respecto al basal en las escalas SF-36v2 y FACT-Th6 (RAISE)2
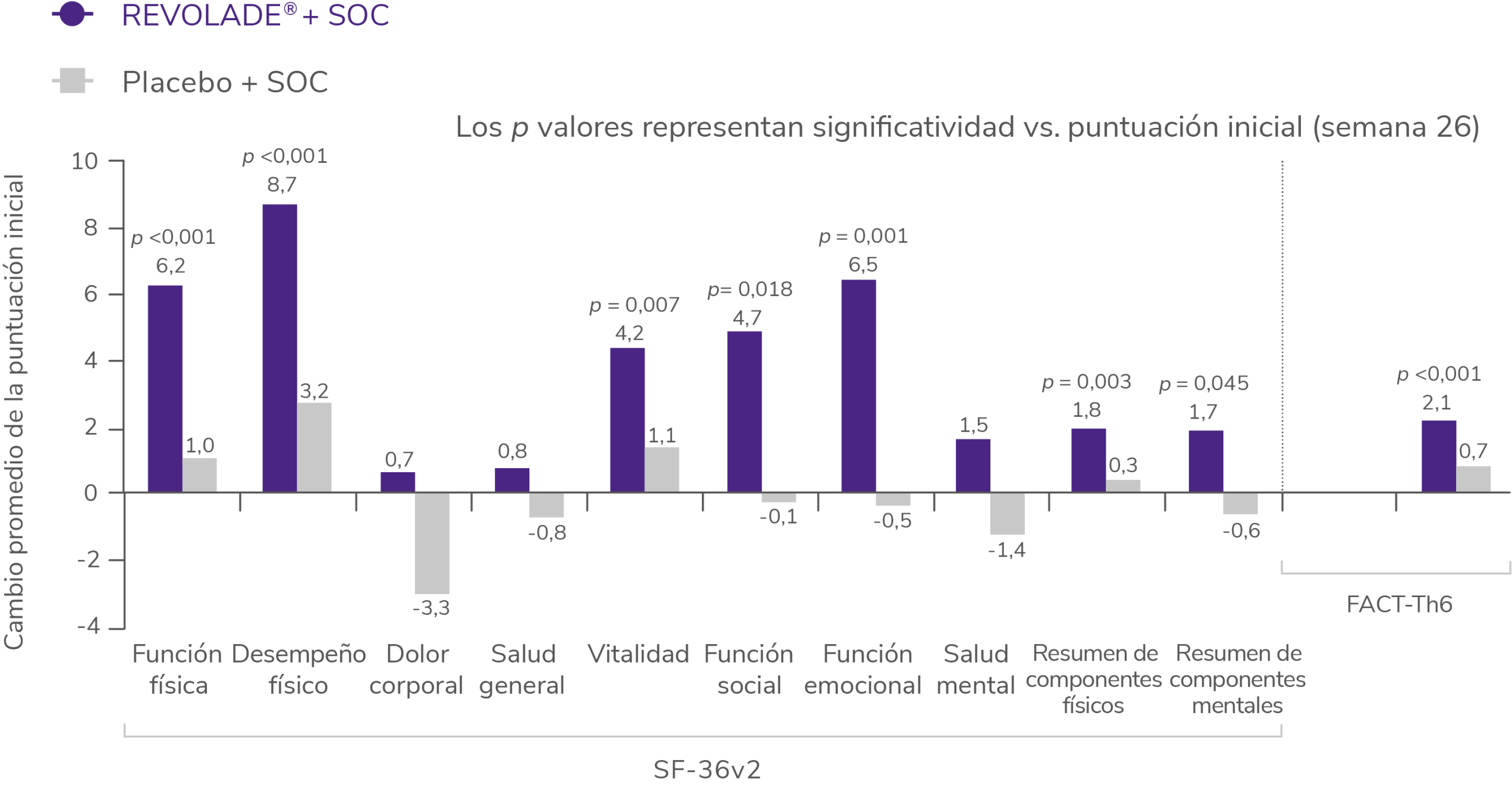
La calidad de vida relacionada con la salud se midió según la versión de memoria aguda del formulario abreviado 36 (Short Form-36), versión 2 (SF-36v2). El efecto de las hemorragias en la calidad de vida se evaluó con un subconjunto de 6 ítems del cuestionario Functional Assessment of Cancer Therapy-thrombocytopenia, (FACT-Th6, evaluación funcional del tratamiento del cáncer-trombocitopenia).
Tal y como se muestra en la figura, los pacientes que recibieron REVOLADE® reportaron mejoras significativas respecto al basal en 5 de 8 dominios del Short Form-36, versión 2 (SF-36v2) que determinan la calidad de vida2.
Adicionalmente, se observaron cambios significativos en:
Sobre el SF-36v22
La versión de memoria aguda del cuestionario SF-36v2 se utilizó para medir la calidad de vida relacionada con la salud expresada en la puntuación de 8 dominios de puntuaciones y 2 resúmenes de componentes

Resultados del estudio EXTEND
REVOLADE® proporciona mejoras en las puntuaciones desde el basal en las medidas relacionadas con3:

Las mejoras en la calidad de vida observadas con REVOLADE® se asociaron significativamente con3:

Pediatría
REVOLADE® proporciona una respuesta rápida y sostenida en pacientes pediátricos (≥1 año) con PTI que son refractarios a un tratamiento previo4-6
En pacientes pediátricos (≥1 año de edad) con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una respuesta rápida y sostenida
Rápida, respuestas visibles ya en la semana 15
Fase abierta del estudio

Sostenida, respuestas mantenidas durante ≥6 semanas6
Fase abierta del estudio

REVOLADE® proporciona una reducción de las hemorragias y la medicación concomitante en niños con PTI5,6
En pacientes pediátricos (≥1 año de edad) con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una reducción de las hemorragias

OMS: Organización Mundial de la Salud; PTI: trombocitopenia inmune primaria.
En pacientes pediátricos (≥1 año de edad) con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® proporciona una reducción de la medicación concomitante
Fase abierta del estudio
Reducción o suspensión del uso de medicaciones concomitantes para la PTI con REVOLADE®
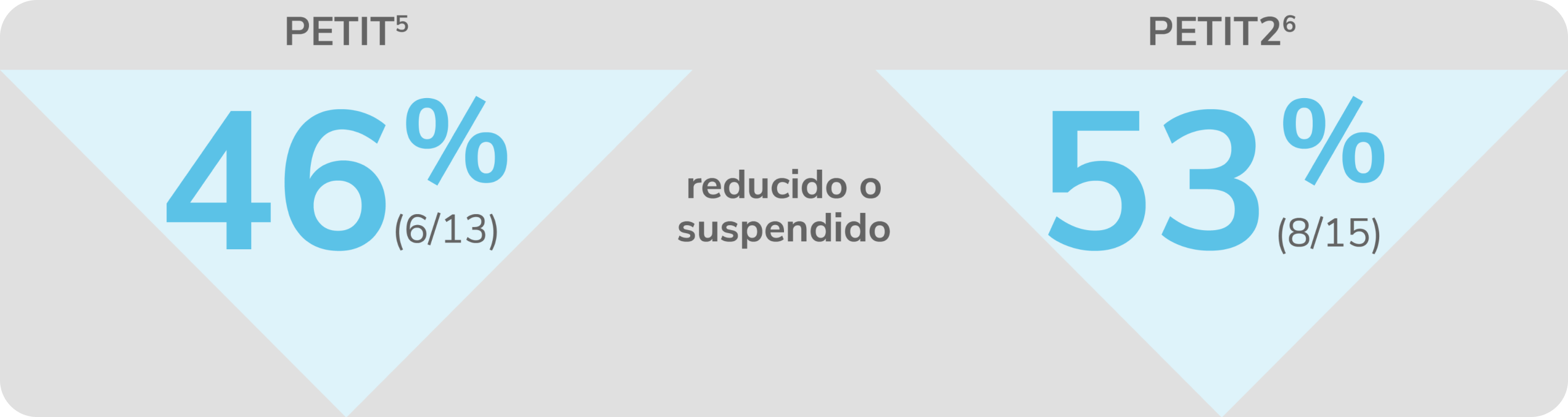
Diseño de estudios
En pacientes adultos con PTI que son refractarios a un tratamiento previo
Estudios de REVOLADE® en trombocitopenia inmune primaria (PTI)
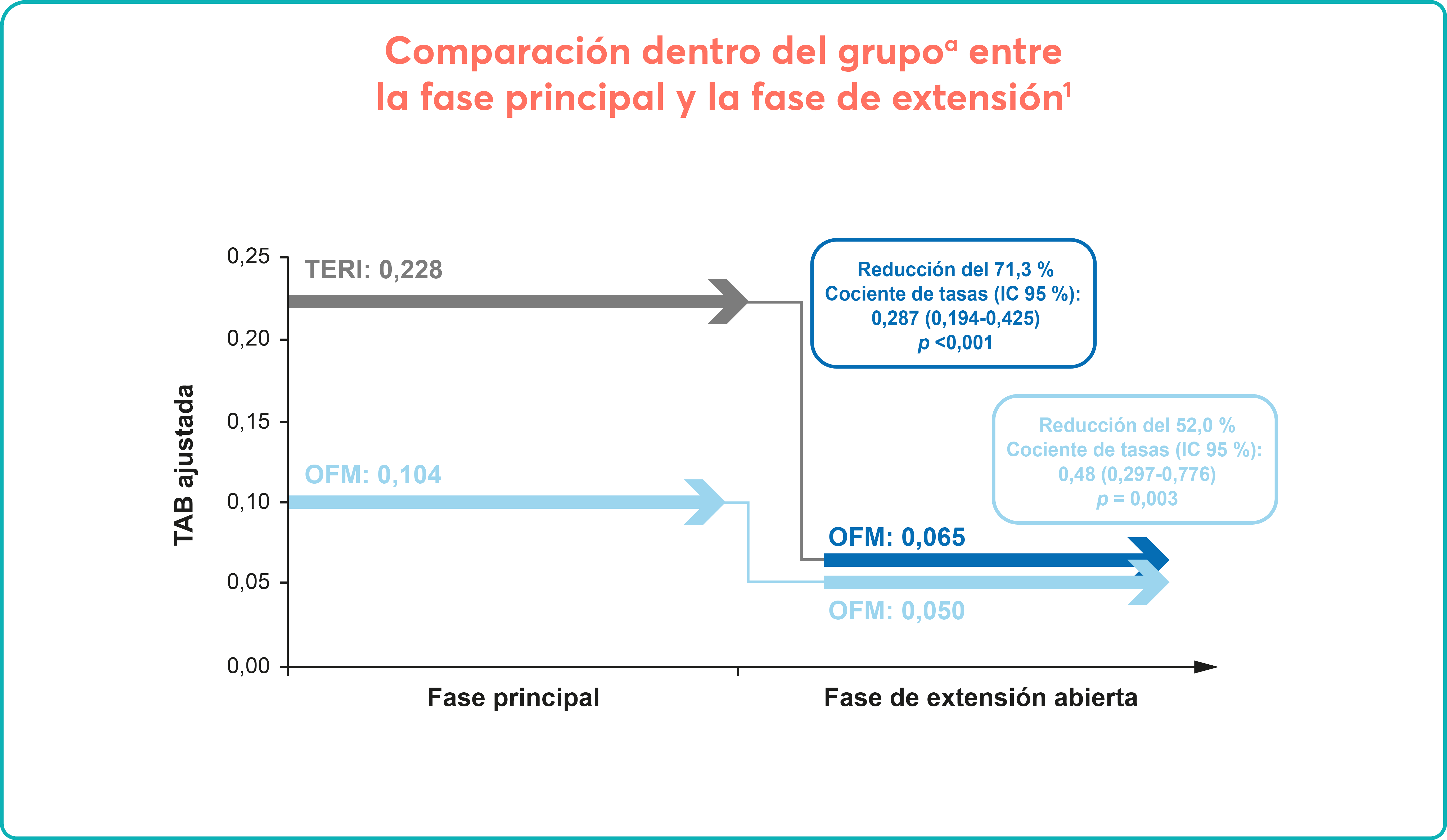
EXTEND1
Estudio de extensión abierto para evaluar la seguridad y eficacia a largo plazo de REVOLADE®
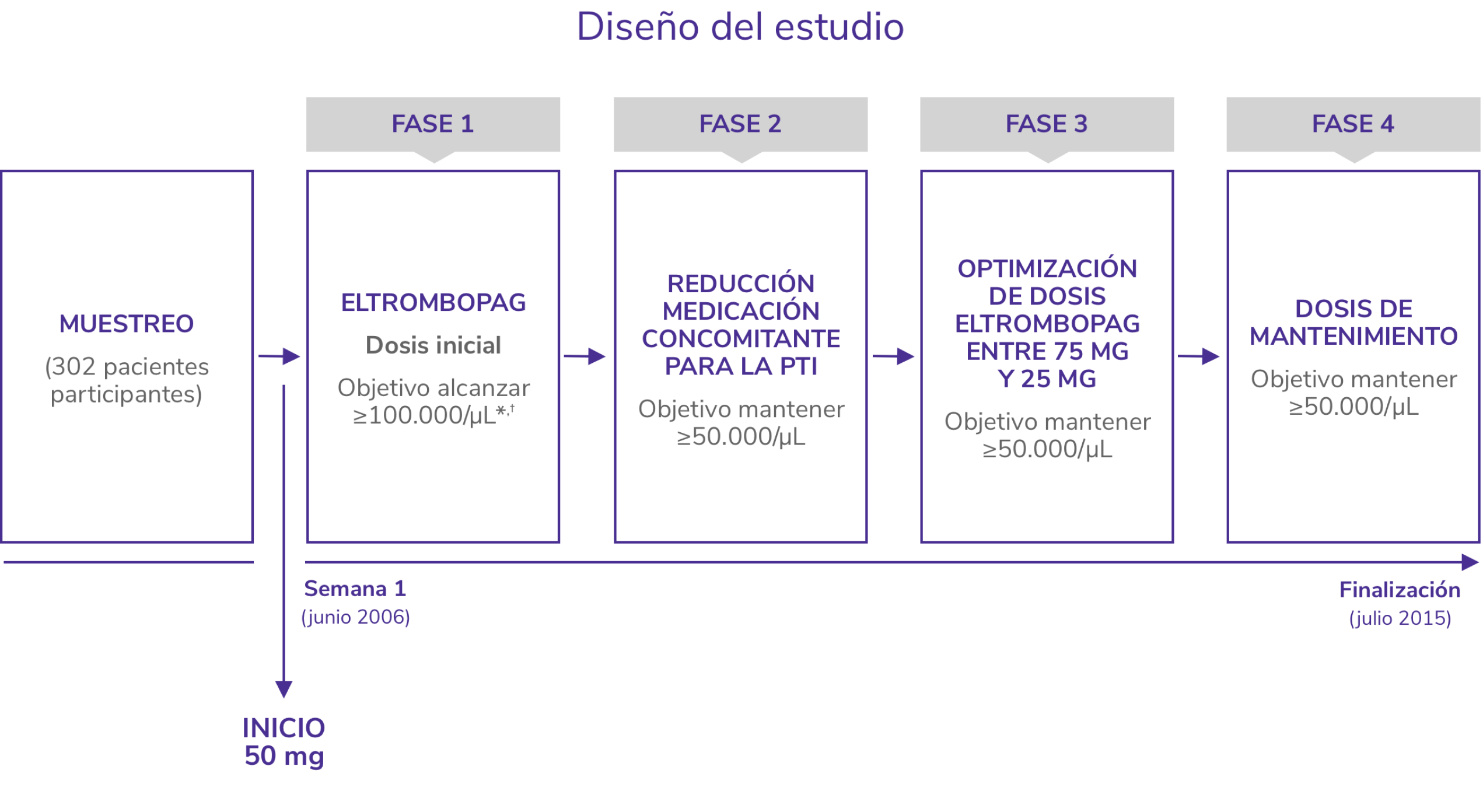
*Pacientes en ambos brazos recibieron SOC según las normas locales de tratamiento incluyendo pero sin limitarse a corticoides, IgIV, danazol, azatioprina, micofenolatom anti-D, ciclosporina, ciclofosfamida, rituximab y vincristina/vinblastina.
†Eltrombopag de inició a 50 mg/día.
SOC: standard of care
RAISE2
Estudio de fase 3, aleatorizado, doble ciego, controlado con placebo
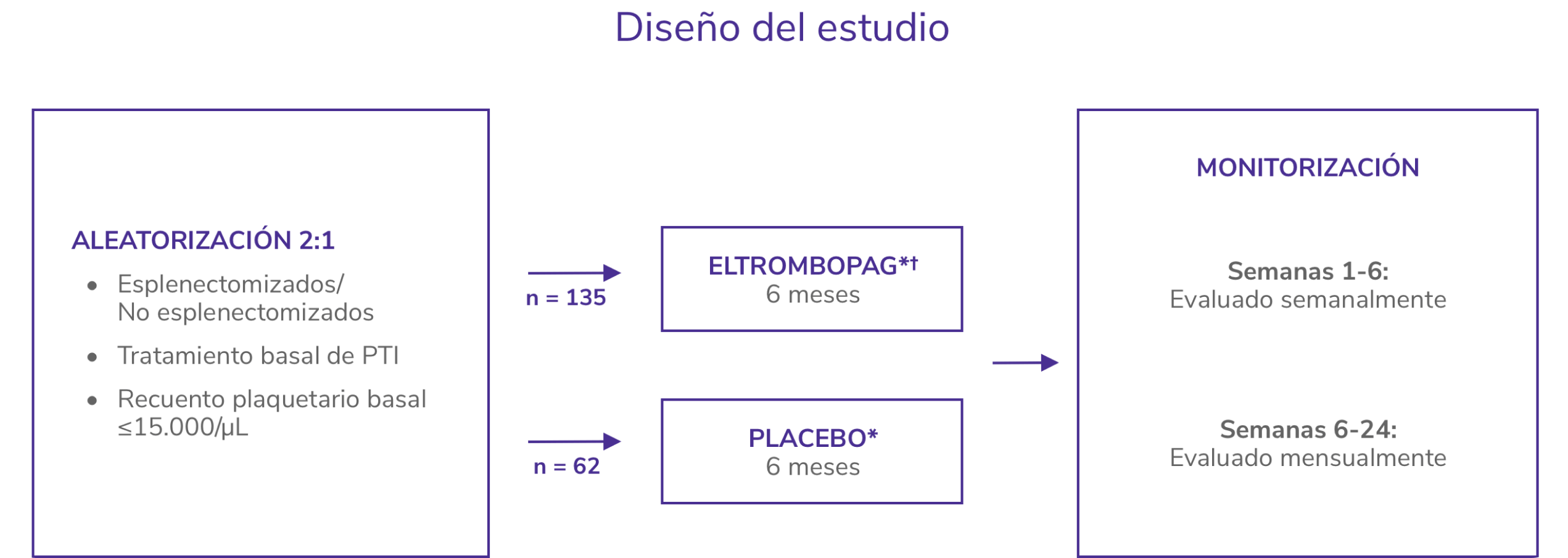
SOC: standard of care.
*Los pacientes recibieron SOC en ambos brazos, según las normas locales de tratamiento, incluyendo pero no limitado a corticosteroides. * Eltrombopag de inició a 50 mg/día.
PTI: trompocitopenia inmune primaria.
PETIT4,5
Estudio de 3 partes, de cohorte escalonada, abierto y doble ciego, aleatorizado, y controlado con placebo
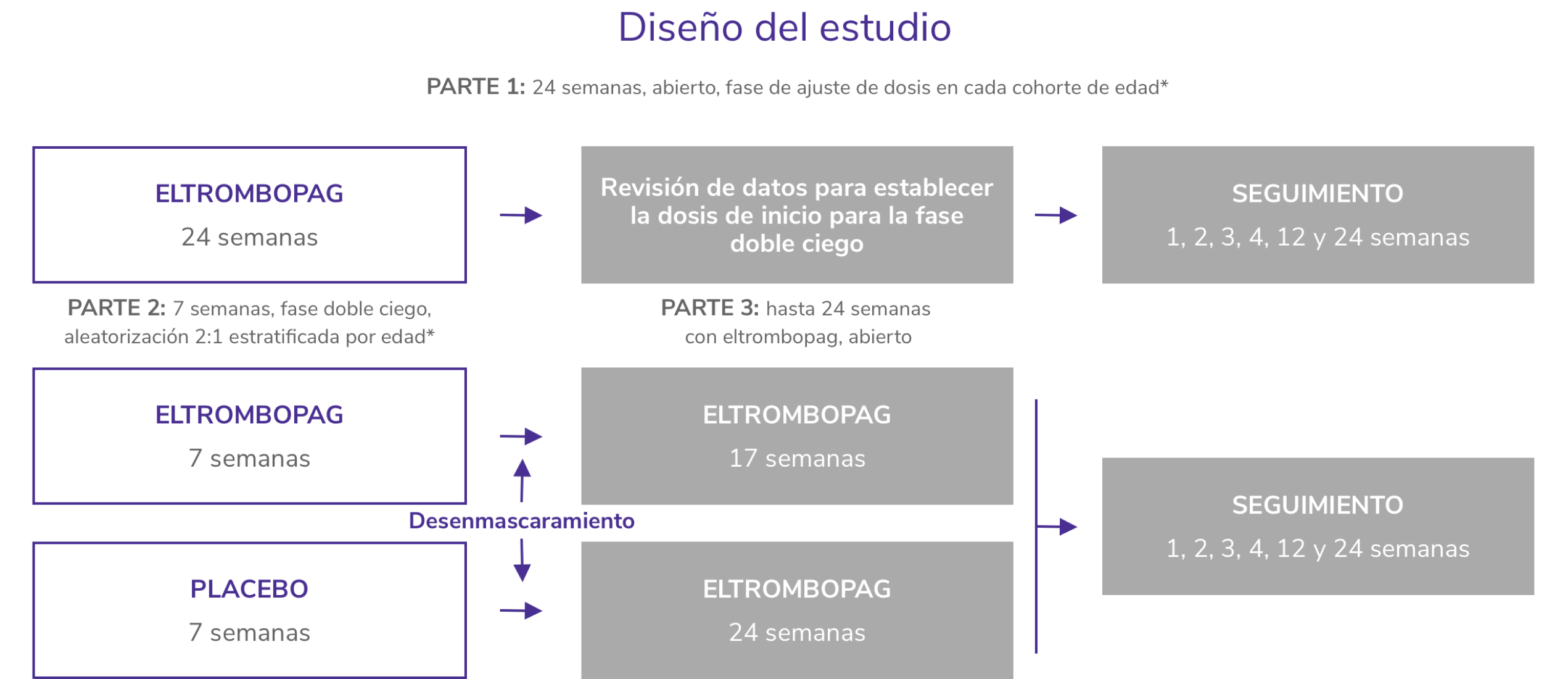
*Cohortes de edad: 12-17 años; 6-11 años y 1-5 años de edad.
PETIT26
Estudio fase 3, de dos partes, una fase doble ciego controlado con placebo de 13 semanas, seguida de una fase abierta de 24 semanas para evaluar la eficacia y seguridad de REVOLADE®

*Cohortes de edad: 12-17 años; 6-11 años y 1-5 años de edad.
PTI: trompocitopenia inmune primaria.
Referencias
Mecanismo de acción
En pacientes con trombocitopenia inmune primaria (PTI), que son refractarios a un tratamiento previo
REVOLADE® estimula la producción de plaquetas1 y no promueve anticuerpos neutralizantes4
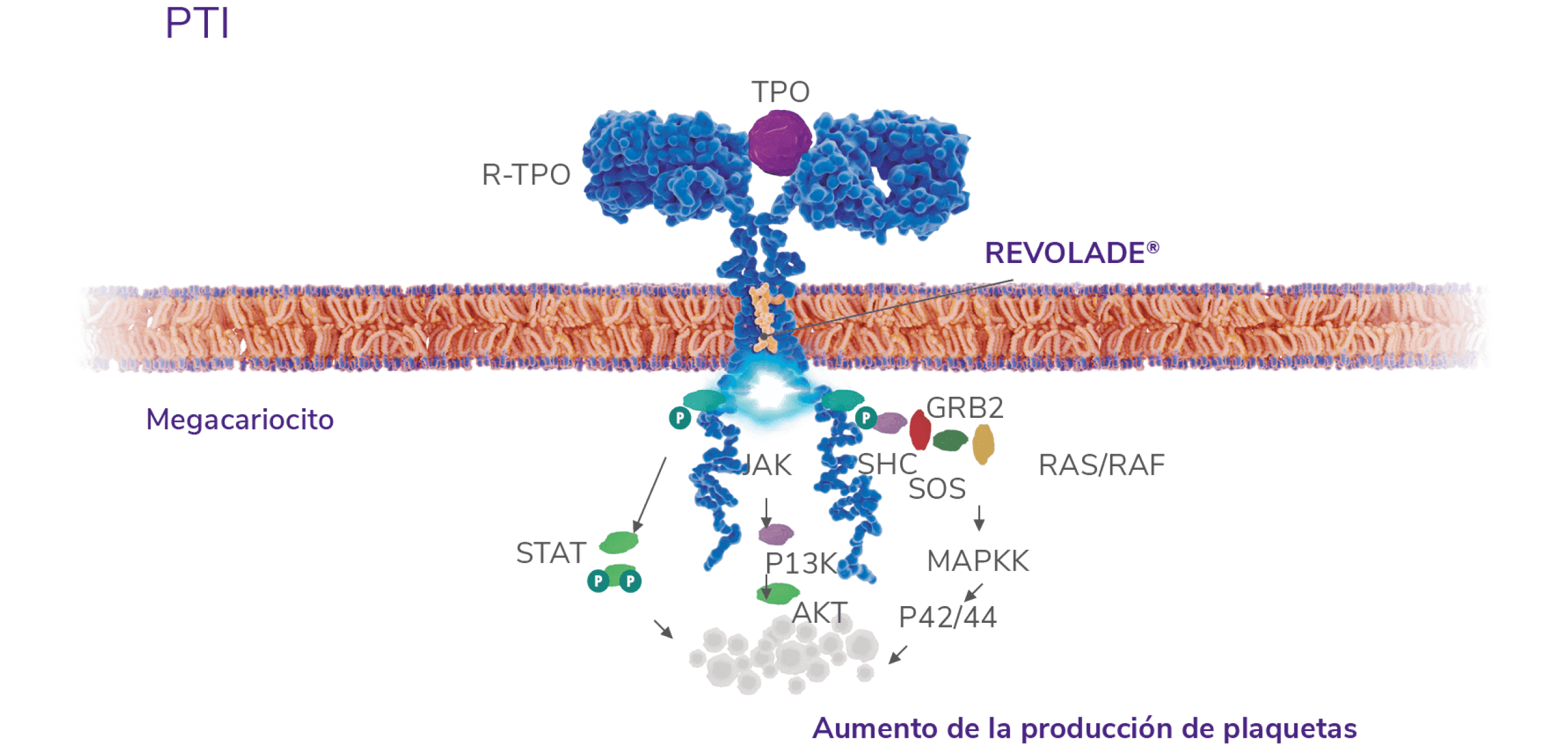
AKT: proteína quinasa B; GRB2: Growth factor Receptor-Bound protein 2; JAK: quinasa Janus; MAPK: Mitogen-Activated Protein Kinases; P42/P44: p42/p44 Mitogen-Activated Protein Kinases (o ERK2 y ERK1); P13K: fosfatidilinositol 3-quinasa; RAF: Rapidly Accelerated Fibrosarcoma; RAS: RAt Sarcoma virus; R-TPO: receptor de la trombopoyetina; SHC: proteína adaptadora SHC; SOS: Son of Sevenless; STAT: Signal Transducer and Activator of Transcription; TPO: trombopoyetina; PTI: trombocitopenia inmune primaria.
 VIDEO
VIDEO
ES2211155132
PTI: trombocitopenia inmune primaria.
Referencias
Seguridad
Adultos
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
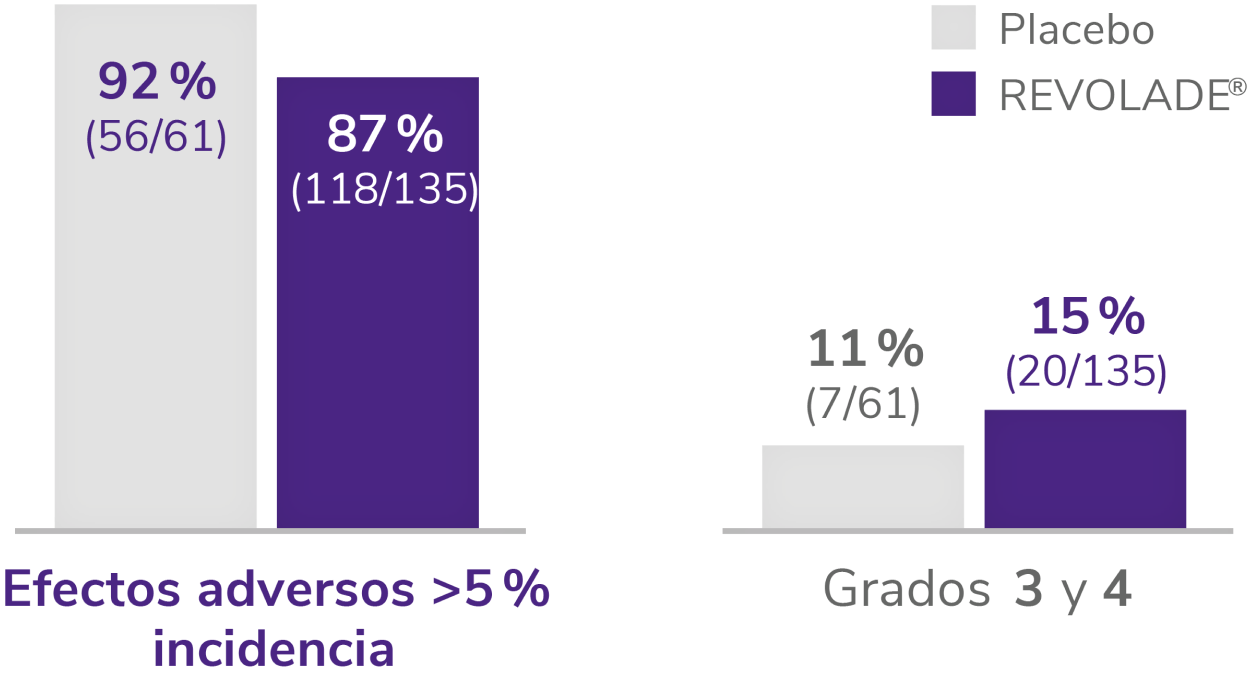
REVOLADE® tiene un perfil de seguridad demostrado
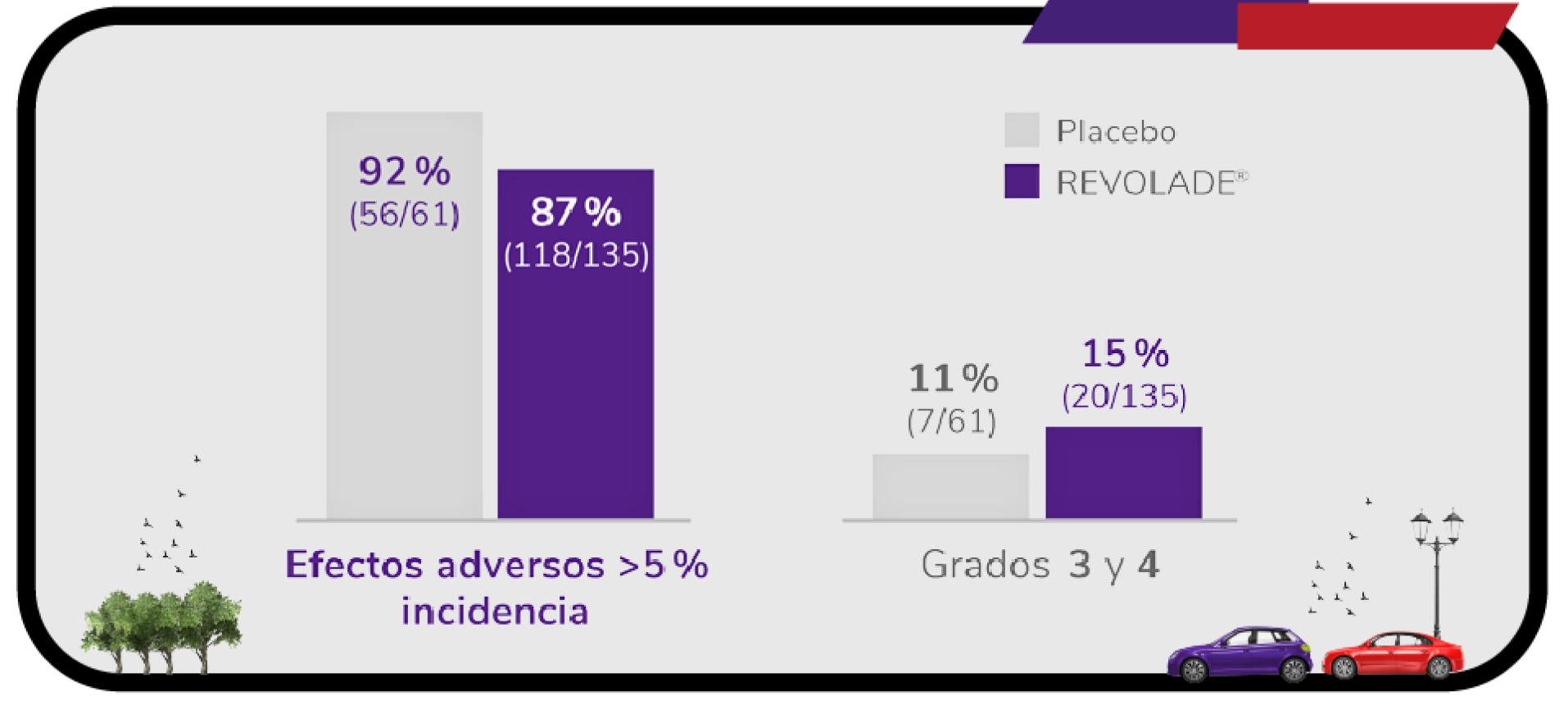
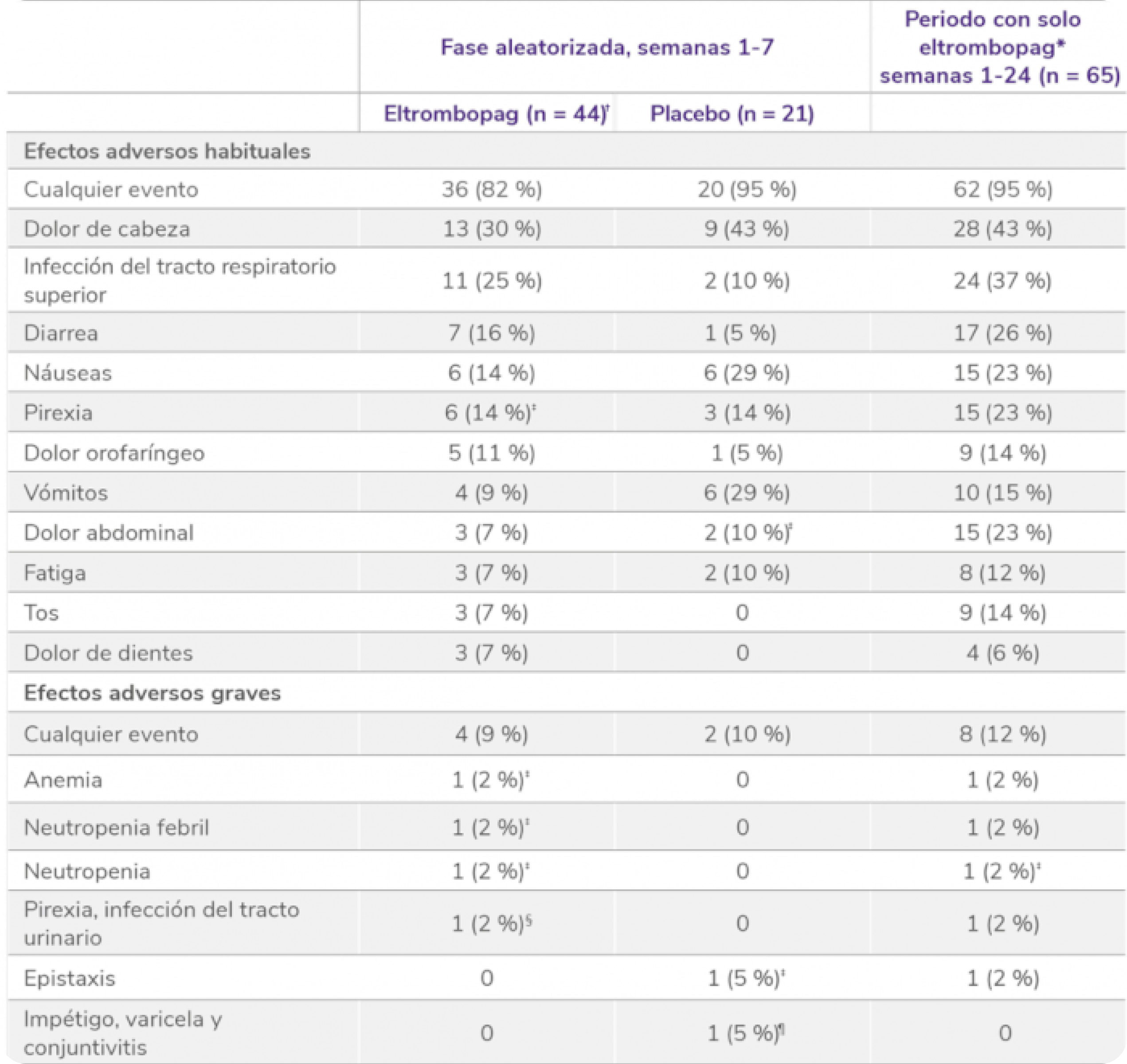
Efectos adversos durante el estudio EXTEND1
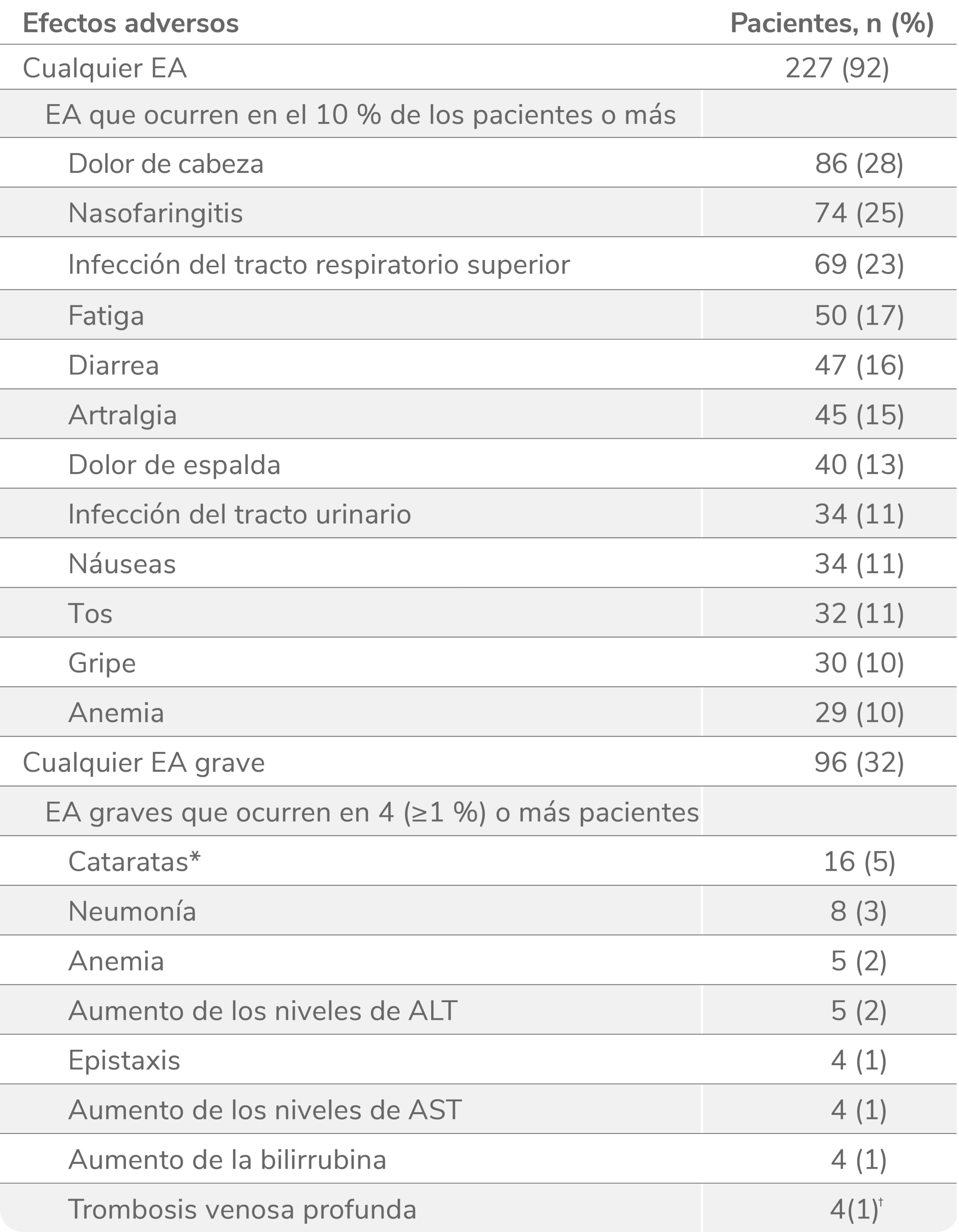
Efectos adversos durante la terapia (n = 302).
EA:efectos adversos; ALT: alanina aminotransferasa, AST: aspartato aminotransferasa.
*El protocolo del estudio requería que las cataratas fueran reportadas como EA grave.
†Las trombosis venosas profundas indicadas se categorizaron por el término principal. Un paciente tuvo 2 trombosis venosas profundas. Otro paciente se le clasificó como que había sufrido una trombosis y más tarde se consideró que sufrió una trombosis venosa profunda.
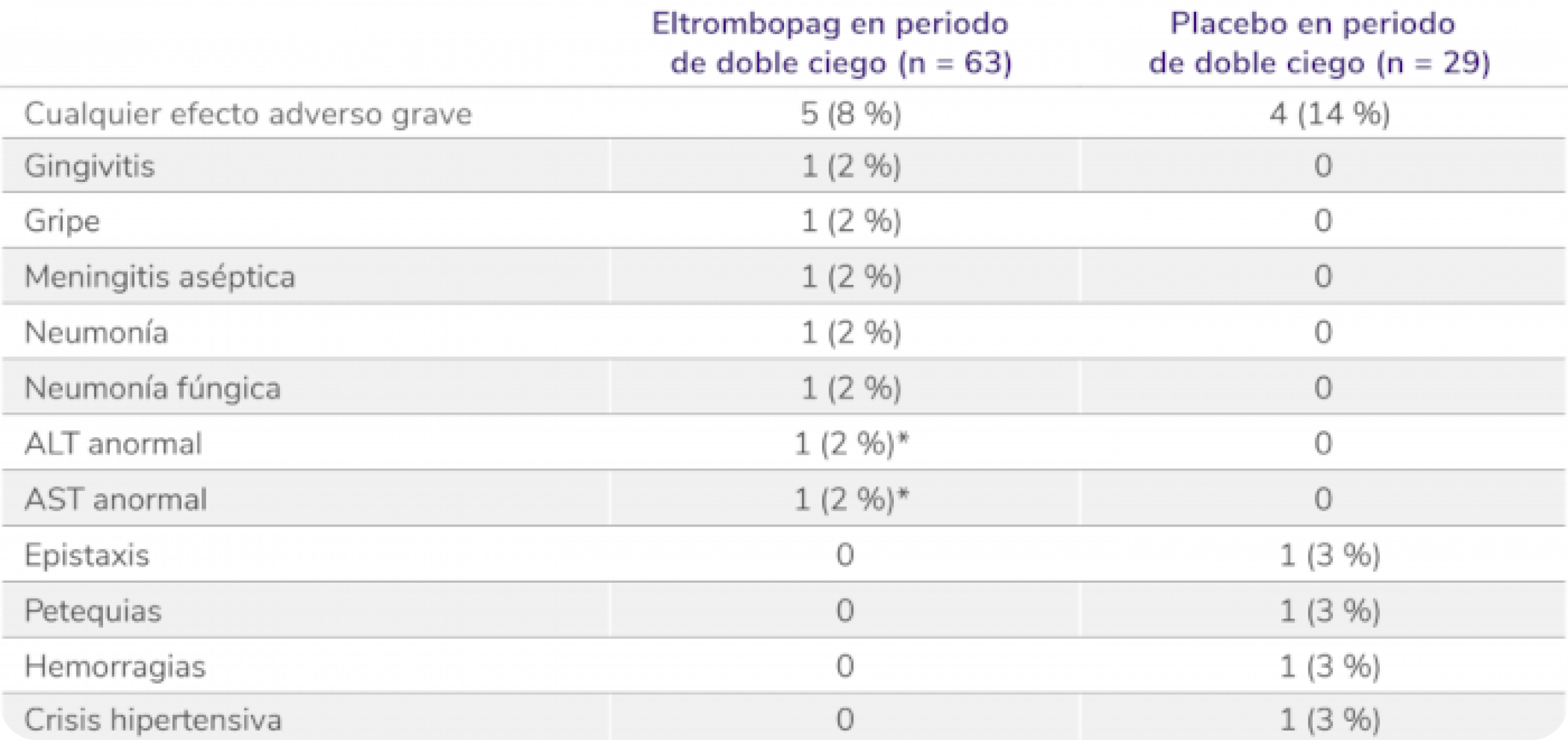
Pediatría
En pacientes pediátricos (≥ 1 año de edad) con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo
REVOLADE® tiene un perfil de seguridad demostrado
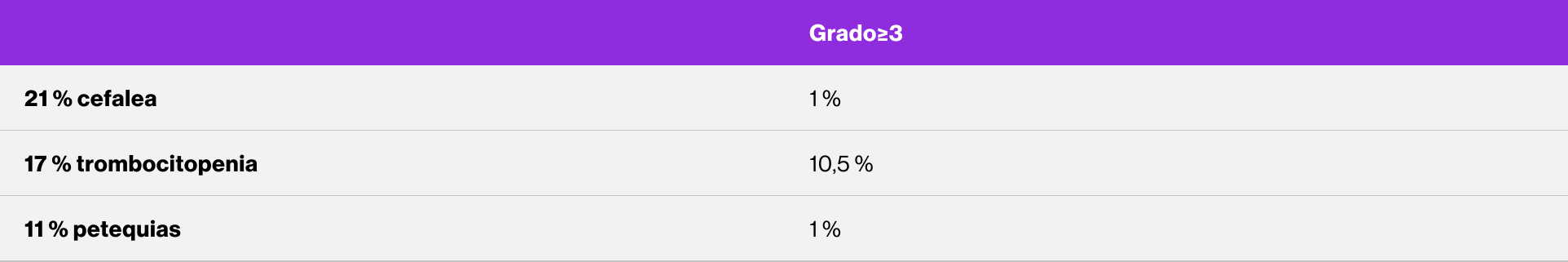
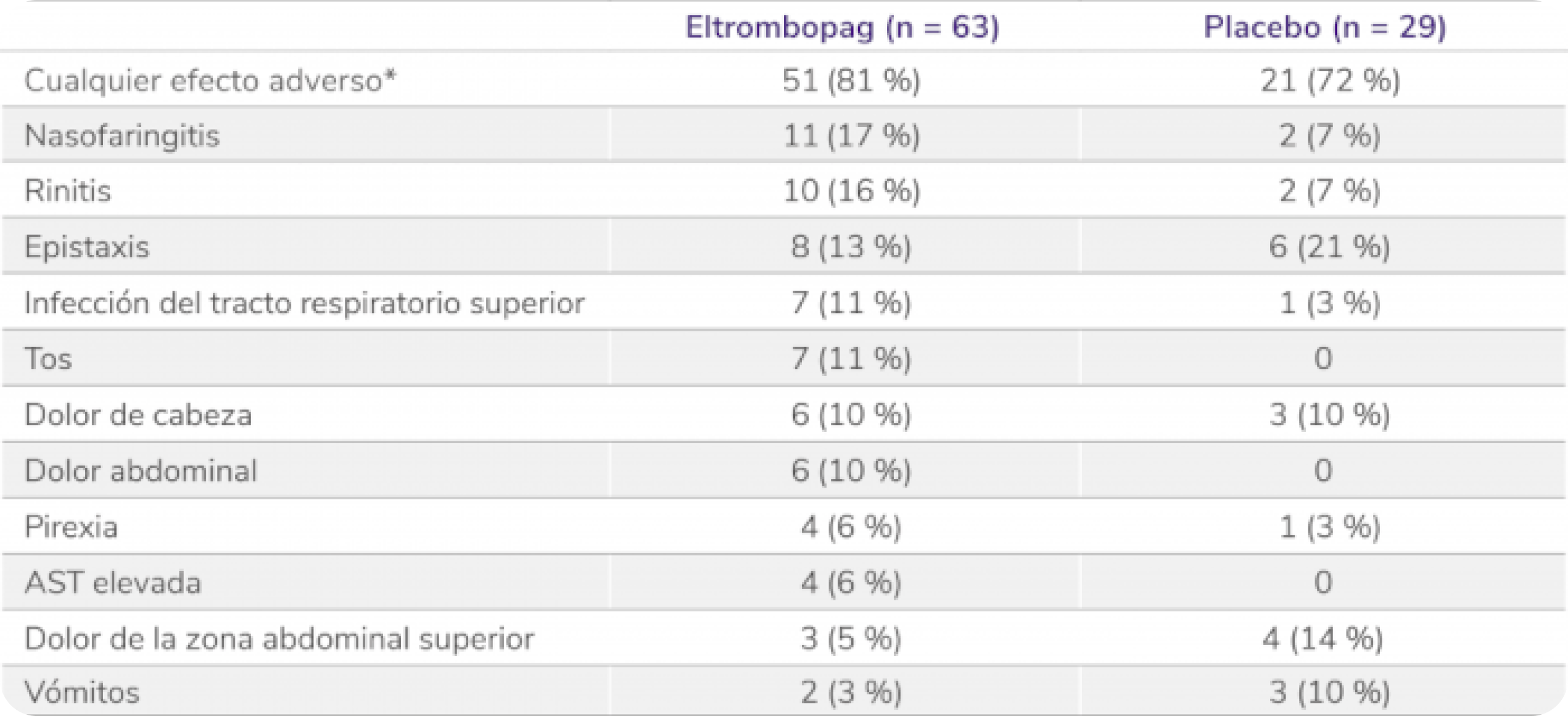
Perfil de seguridad sólido en el estudio PETIT4
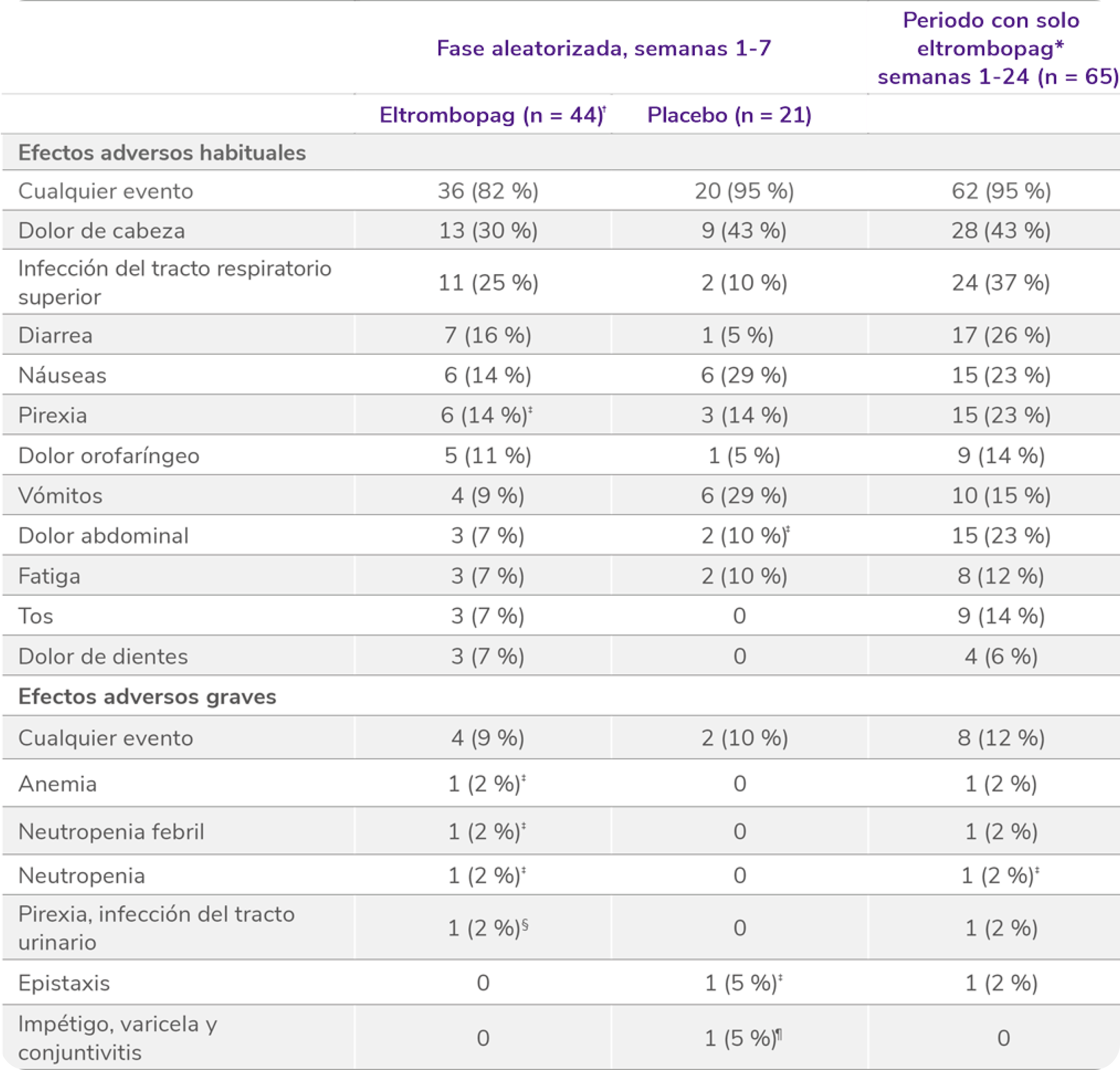
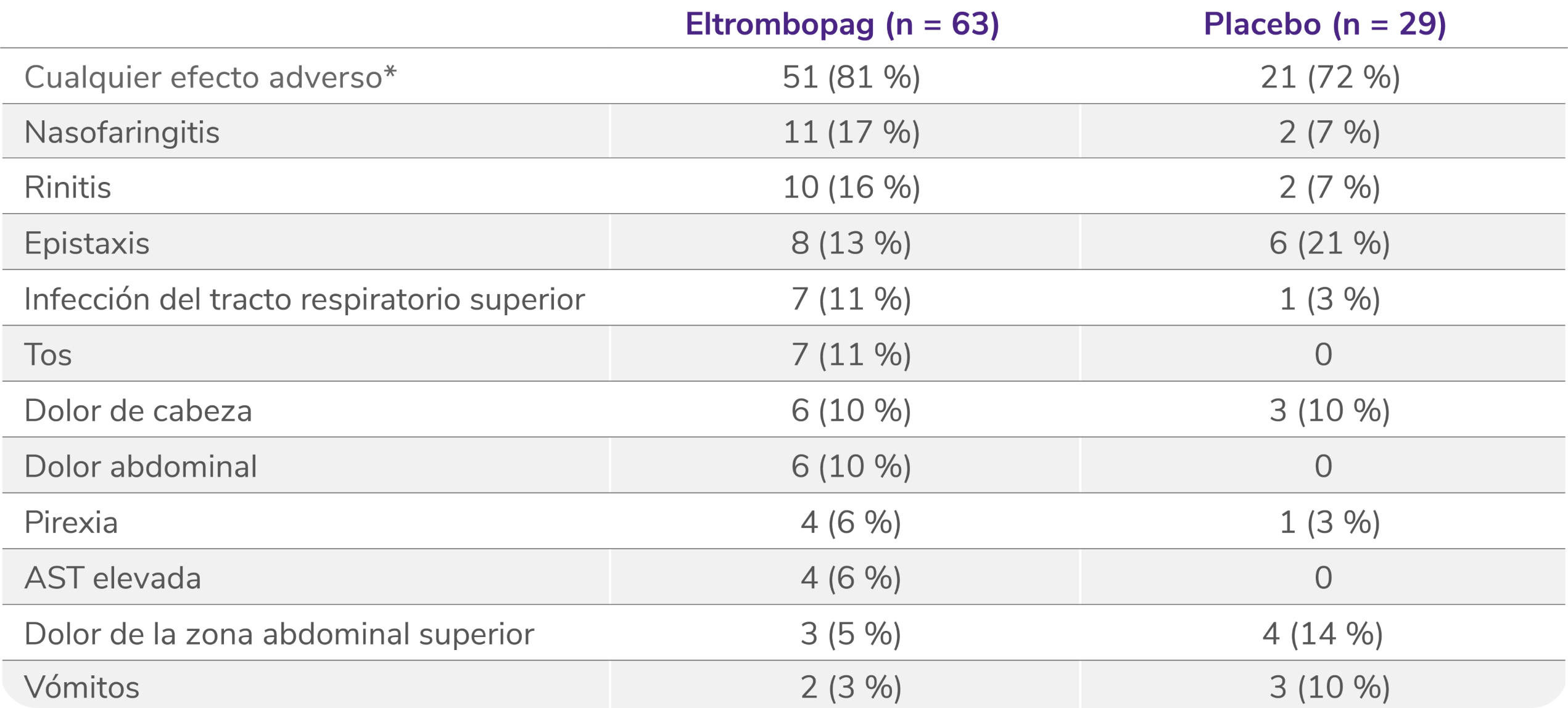
Los datos son n (%). Como efectos adversos se consideraron el número de eventos ocurridos en al menos el 5 % de los pacientes que recibieron eltrombopag durante el período de doble ciego. Los pacientes podían experimentar más de un efecto adverso.
AST: aspartato aminotransferasa.
*Efectos adversos ocurridos con cualquier frecuencia
Efectos adversos graves en la fase doble ciego aleatorizada5
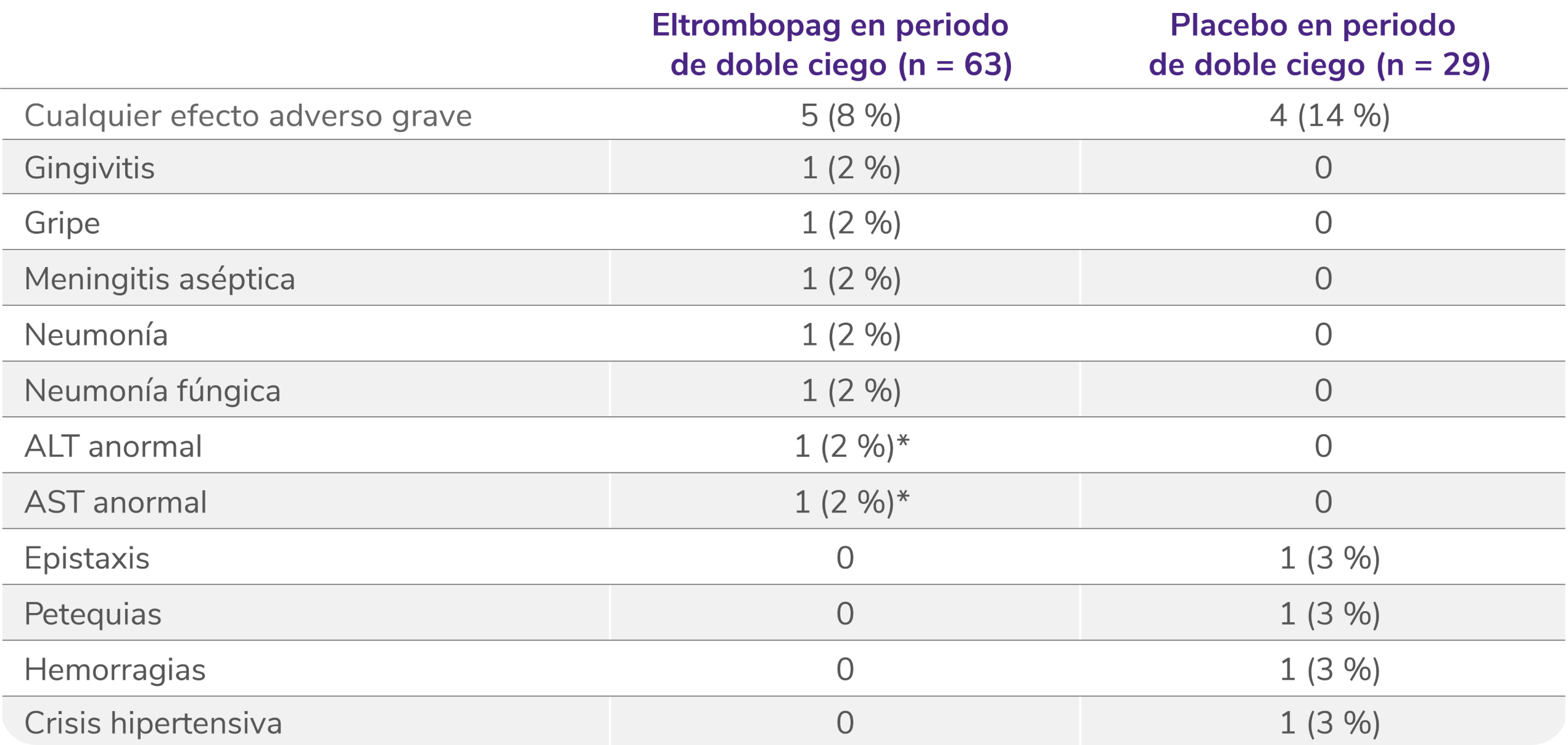
Los datos son n (%). Las frecuencias se basan en el número de pacientes que experimentan el evento. Los pacientes podían experimentar más de un efecto adverso.
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa.
*Considerado por el investigador como relacionado con el tratamiento.
PTI: trombocitopenia inmune primaria.
Referencias
Dosis y administración
Dosis y administración
Con una administración oral,
REVOLADE® puede ayudar a sus pacientes a controlar su PTI donde quiera que estén
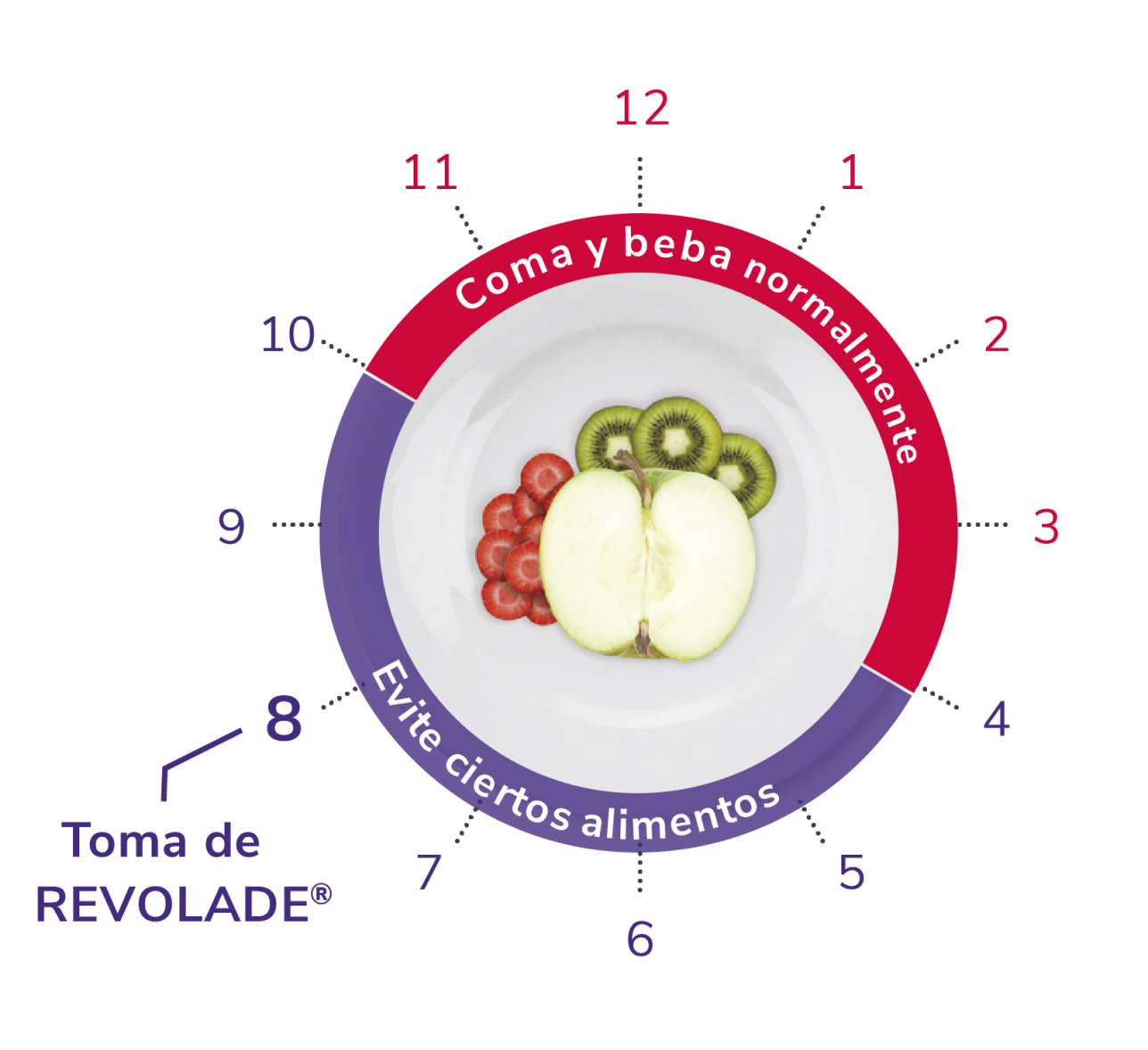
Posología de REVOLADE® en PTI
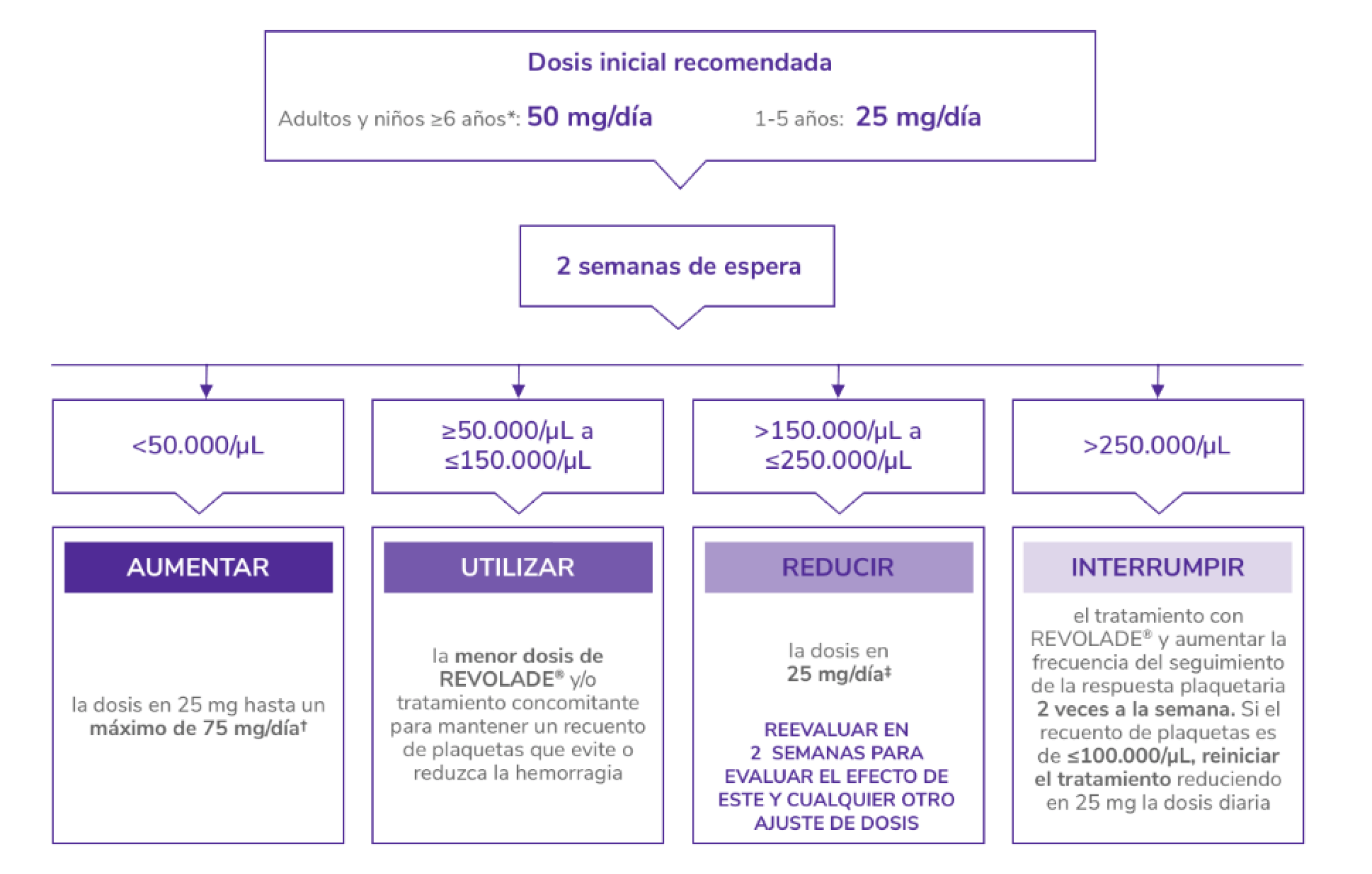

PTI: trombocitopenia inmune primaria.
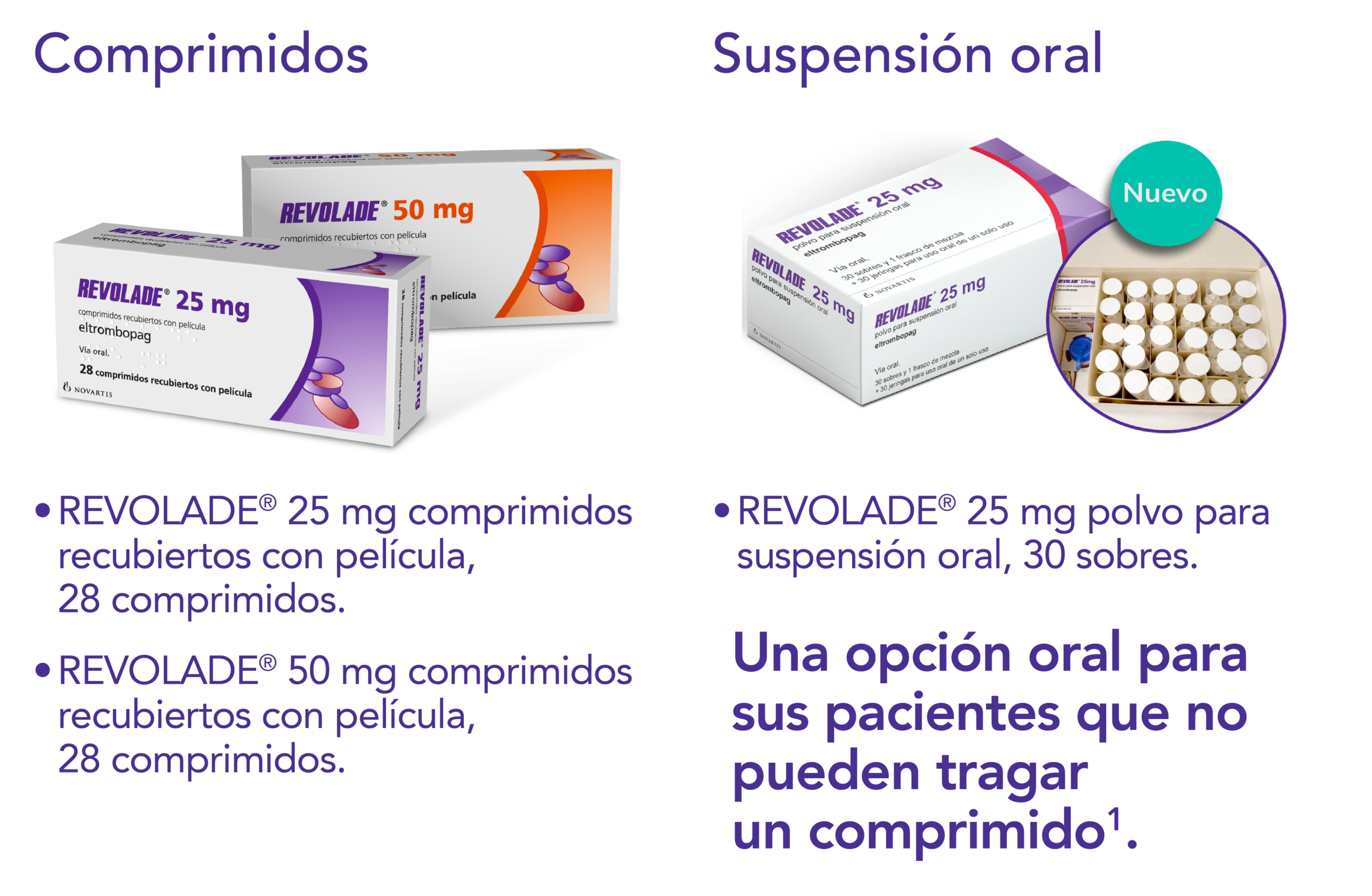
Presentaciones
Comprimidos y suspensión oral
REVOLADE® está disponible en comprimidos y polvo para suspensión oral1.
Presentaciones

 VIDEO
VIDEO
Preparación y administración de REVOLADE® polvo para suspensión oral1
*Descartar la suspensión, si no se administra en los 30 minutos tras la preparación
Referencias
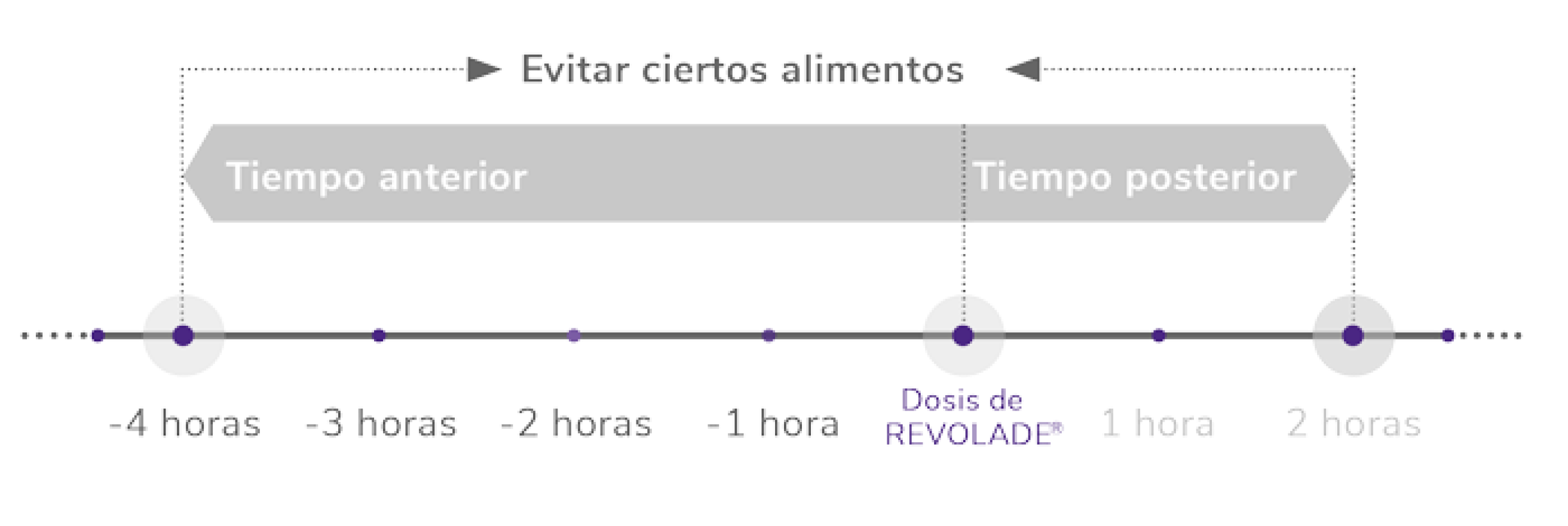
Pautas dietéticas
1 vez al día, vía oral1
Encontrar el momento del día apropiado que se adapte a la vida del paciente facilita la rutina

*Como hierro, calcio, aluminio, magnesio, selenio y zinc.
Referencia
Respuesta inmunomoduladora
Referencias
Bao W, et al.Ficha técnica de REVOLADE®.
Desmond R, et al.GEPAR REVOLADE®: https://www.ema.europa.eu/en/documents/variation-report/revolade-h-c-111....
Liu X, et al. EPAR NPLATE®: https://www.ema.europa.eu/en/documents/variation-report/nplate-h-c-942-i....
Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015; 2(8): e315-e325.
Grainger JD, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015; 386 (10004): 1649-1658.
Wong RSM, et al. Safety and effcacy of long term treatment of chronic/persistent ITP with eltrombopag :final results of the EXTEND study. Blood . 2017;130(23):2527 2536. Blood. 2018;131(6):709.
Resultados en PubMed. Último acceso: septiembre 2023. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/?term=eltrombopag+AND+((immune+thrombocytopenia)+OR+(severe+aplastic+anemia))
Resultados en PubMed. Último acceso: septiembre 2023. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/?term=eltrombopag+AND+((immune+thrombocytopenia)+OR+(severe+aplastic+anemia))
Bussel JB, et al. Effect of eltrombopag on platelet counts and bleeding during treatment of chronic idiopathic thrombocytopenic purpura: a randomised, double-blind, placebo-controlled trial. Lancet. 2009 Feb 21;373(9664):641-8.
Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6 month, randomised , phase 3 study. Lancet. 2011;377(9763):393 402.
Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6 month, randomised , phase 3 study. Lancet. 2011;377(9763):393 402.
Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536. Brynes RK, et al. Acta Haematol. 2017;137:66-72.
Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536. Brynes RK, et al. Acta Haematol. 2017;137:66-72.
Olnes MJ, et al. Eltrombopag and improved hematopoiesis in refractory aplastic anemia. N Engl J Med. 2012 Jul 5;367(1):11-9
Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-1825.
Afdhal NH, et al. Eltrombopag increases platelet numbers in thrombocytopenic patients with HCV infection and cirrhosis, allowing for effective antiviral therapy. Gastroenterology. 2014;146(2):442-452.e1.
Gonzalez-Porras JR, Bastida JM. Eltrombopag in immune thrombocytopenia: efficacy review and update on drug safety. Ther Adv Drug Saf. 2018;9(6):263-285.
Bussel JB, et al. Eltrombopag for the treatment of chronic idiopathic thrombocytopenic purpura. N Engl J Med. 2007;357(22):2237-2247.
Bussel JB, et al. Effect of eltrombopag on platelet counts and bleeding during treatment of chronic idiopathic thrombocytopenic purpura: a randomised, double-blind, placebo-controlled trial. Lancet. 2009;373(9664):641-648.
Bussel JB, et al. Repeated short-term use of eltrombopag in patients with chronic immune thrombocytopenia (ITP). Br J Haematol. 2013;160(4):538-546.
Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. Lancet. 2011;377(9763):393-402.
Olnes MJ, et al. Eltrombopag and improved hematopoiesis in refractory aplastic anemia. N Engl J Med. 2012;367(1):11-19.
Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-1825.
Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015;2(8):e315-e325.
Grainger JD, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015;386(10004):1649-1658.
Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536.
Se trata de una enfermedad rara.
Existencia de experiencia personal limitada con otras terapias.
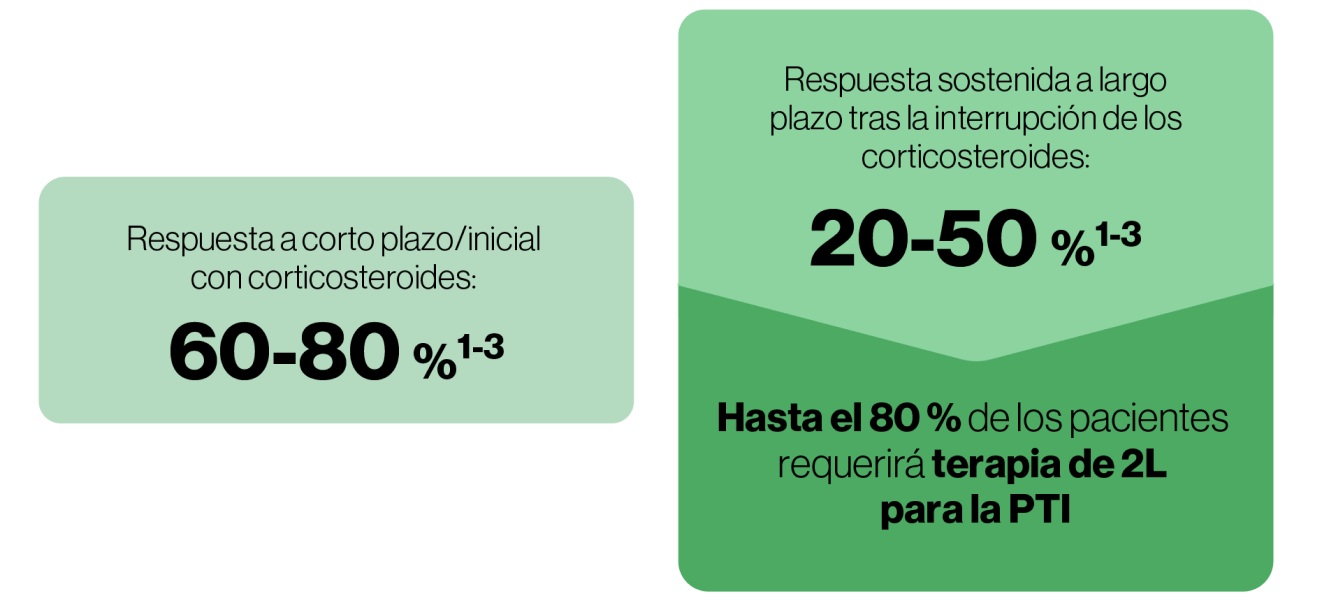
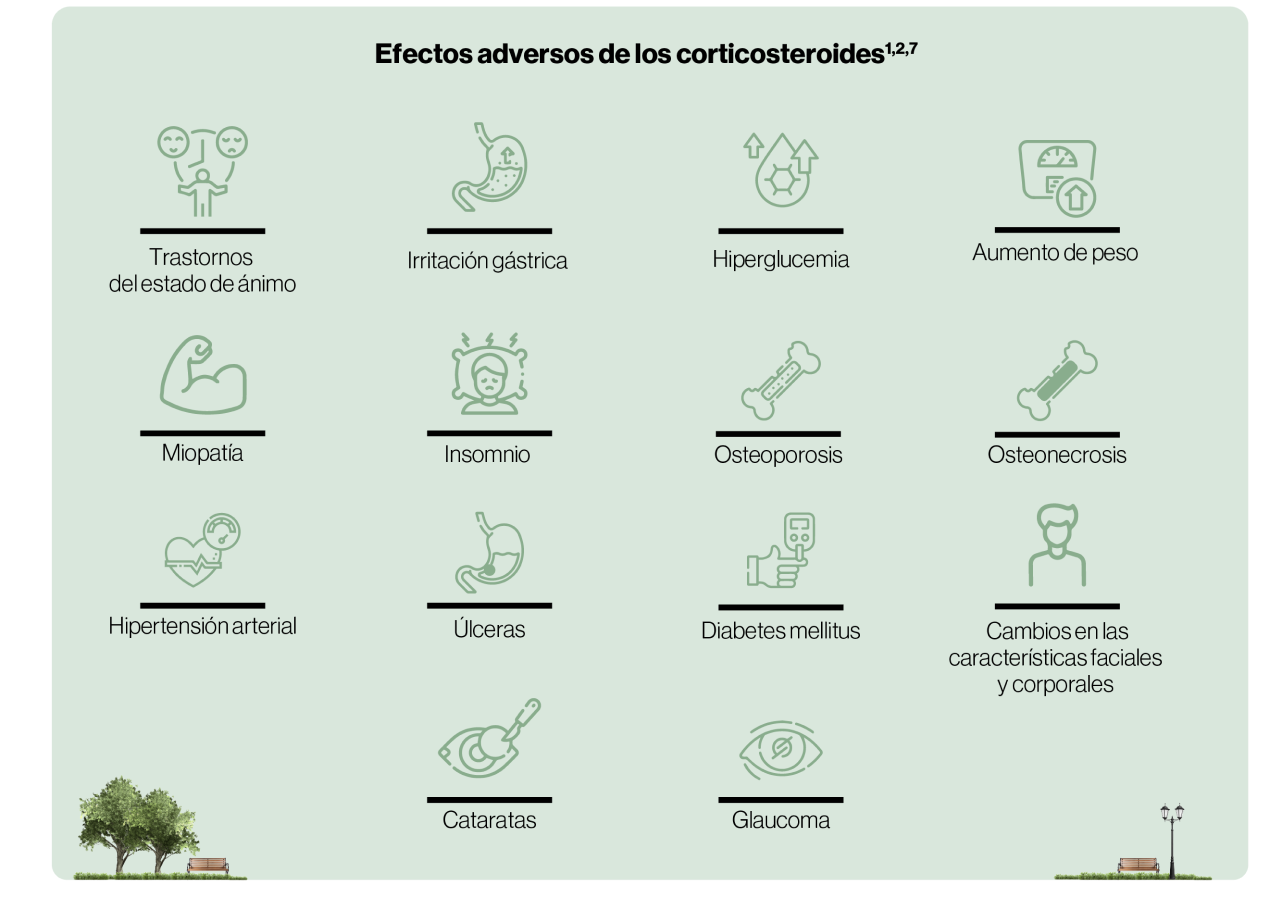
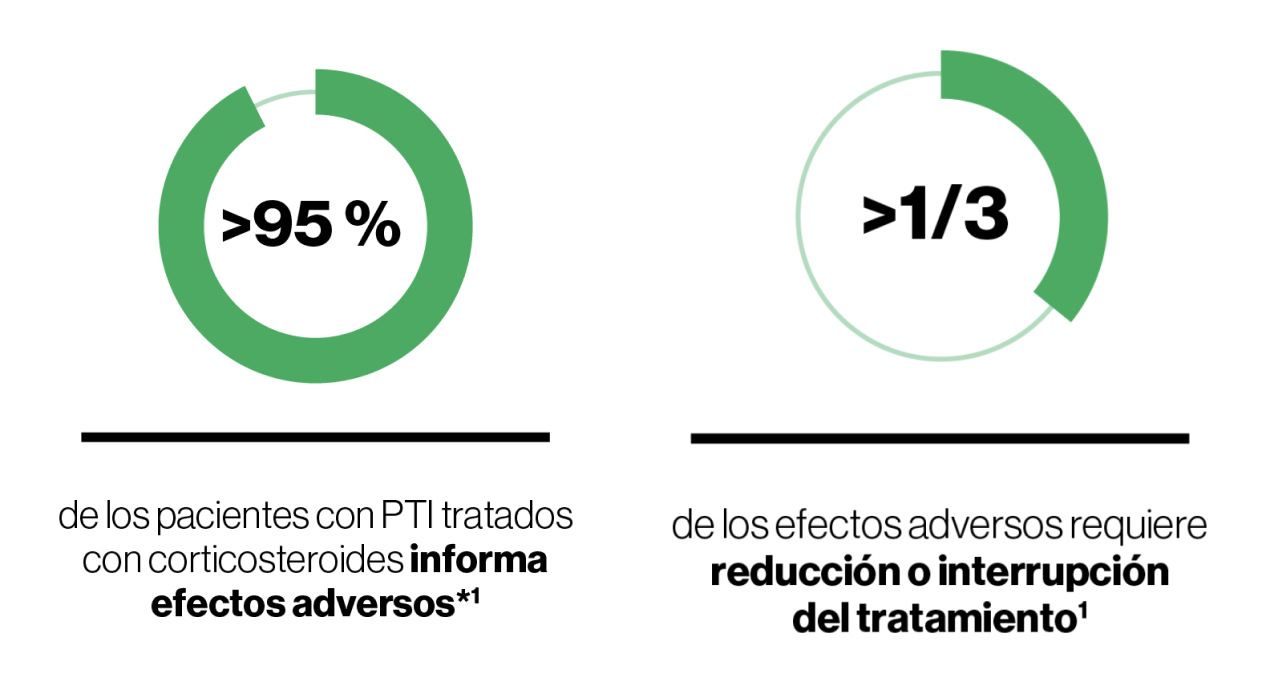
No se recomienda la administración repetida o sostenida de corticosteroides debido a la posibilidad de efectos adversos y el impacto negativo en la calidad de vida9.
El tratamiento prolongado con corticosteroides no mejora la respuesta del paciente, pero probablemente empeorará los efectos adversos9.
Las altas tasas de recurrencia demuestran que los corticosteroides reducen los síntomas, pero no cambian el curso de la enfermedad9.
Cuker A, Liebman HA. Corticosteroid overuse in adults with immune thrombocytopenia: Cause for concern. Res Pract Thromb Haemost. 2021;5:e12592.
Palau J, et al. Characteristics and management of primary and other immune thrombocytopenias: Spanish registry study. Hematology. 2017;22(8):484-492.
Lozano ML, et al. Real-life management of primary immune thrombocytopenia (ITP) in adult patients and adherence to practice guidelines. Ann Hematol. 2016;95:1089-1098.
Kubasch AS, et al. Disease management of patients with immune thrombocytopenia—results of a representative retrospective survey in Germany. Ann Hematol. 2020;99:2085-2093.
Meyer O, et al. Treatment patterns in adults with immune thrombocytopenia before, during and after use of thrombopoietin receptor agonists: a longitudinal prescription database study from Germany. Hematology. 2021;26(1):697-708.
Cuker A, et al. Overuse of corticosteroids in patients with immune thrombocytopenia (ITP) between 2011 and 2017 in the United States. EJHaem. 2023;4(2):350-357.
Cooper N, et al. Immune thrombocytopenia (ITP) World Impact Survey (iWISh): Patient and physician perceptions of diagnosis, signs and symptoms, and treatment. Am J Hematol. 2021;96(2):188-198.
Cooper N, et al. Immune thrombocytopenia (ITP) World Impact Survey (I-WISh): Impact of ITP on health-related quality of life. Am J Hematol. 2021;96(2):199-207.
Matzdorff A, et al. Expert Report on Immune Thrombocytopenia: Current Diagnostics and Treatment – Recommendations from an Expert Group from Austria, Germany, and Switzerland. Oncol Res Treat 2023;46(suppl 2):5-44.
Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536.
Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. Lancet. 2011;377(9763):393-402.
Ficha técnica de REVOLADE®.
Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015;2(8):e315-e325.
Grainger JD, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015;386(10004):1649-1658.
Revolade es único
REVOLADE® es único porque TÚ lo haces posible
 VIDEO
VIDEO
Aprobado para 4 indicaciones
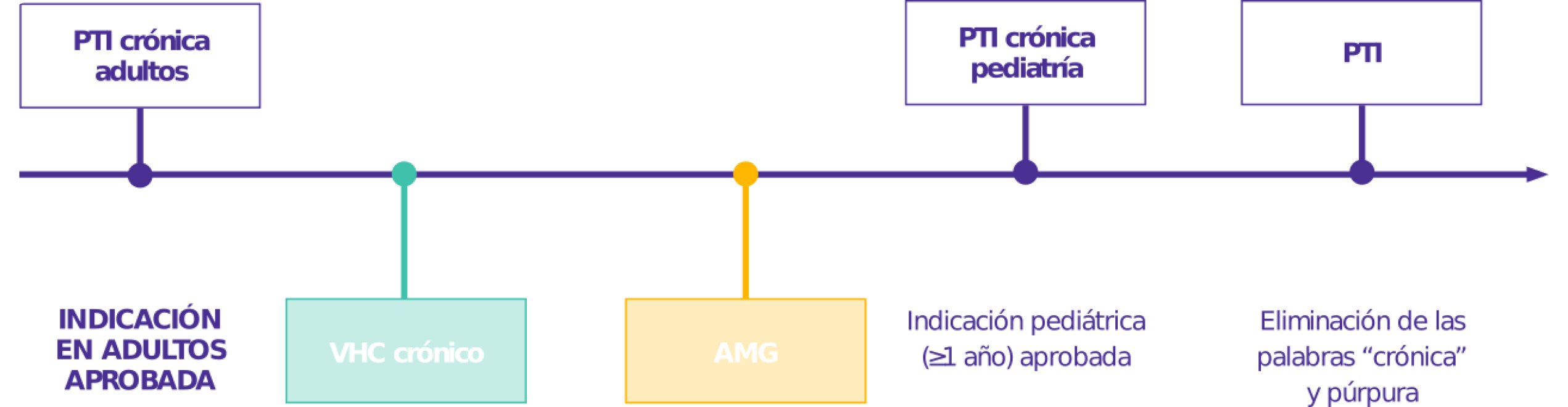
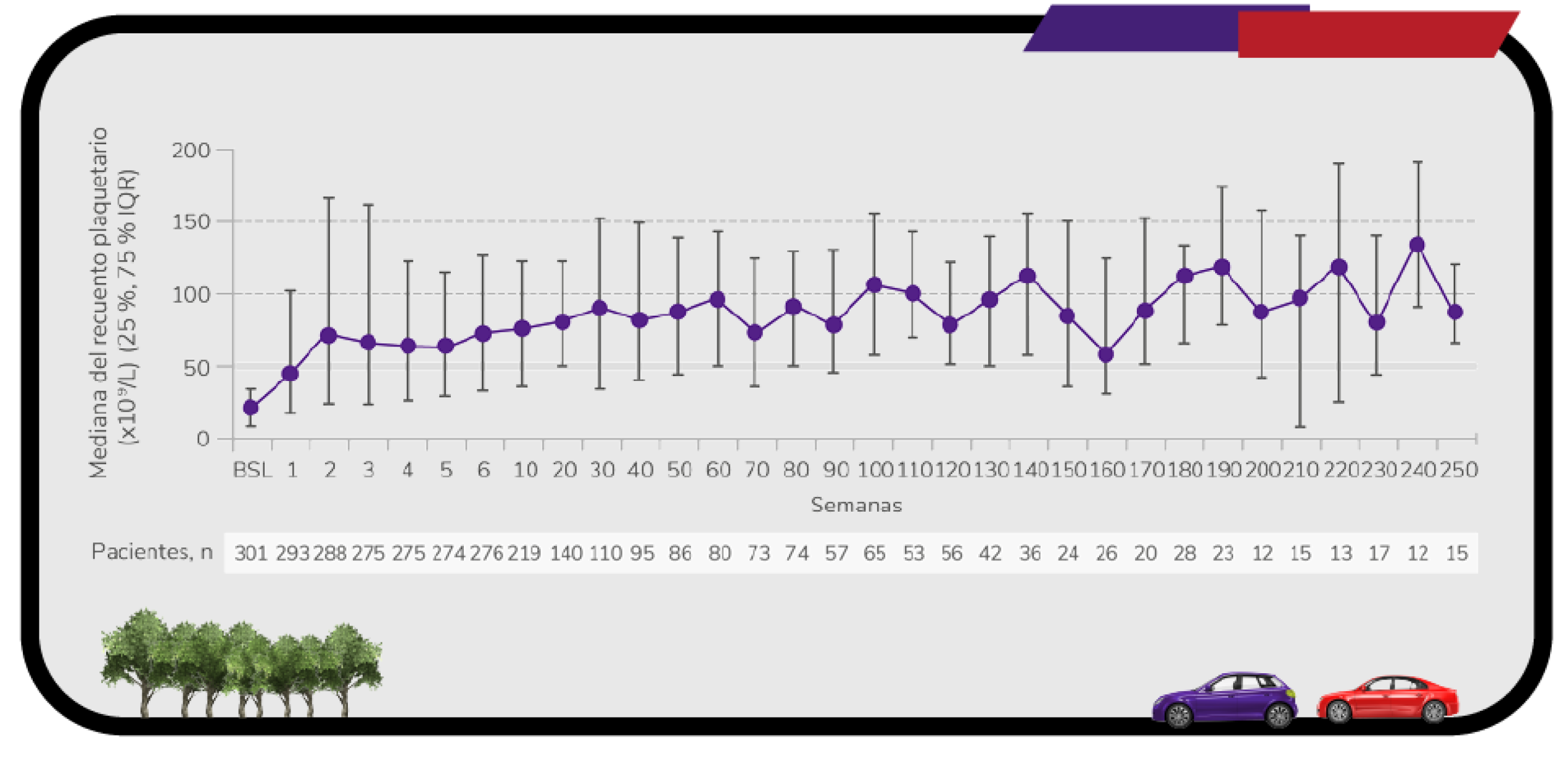
Amplia experiencia demostrada
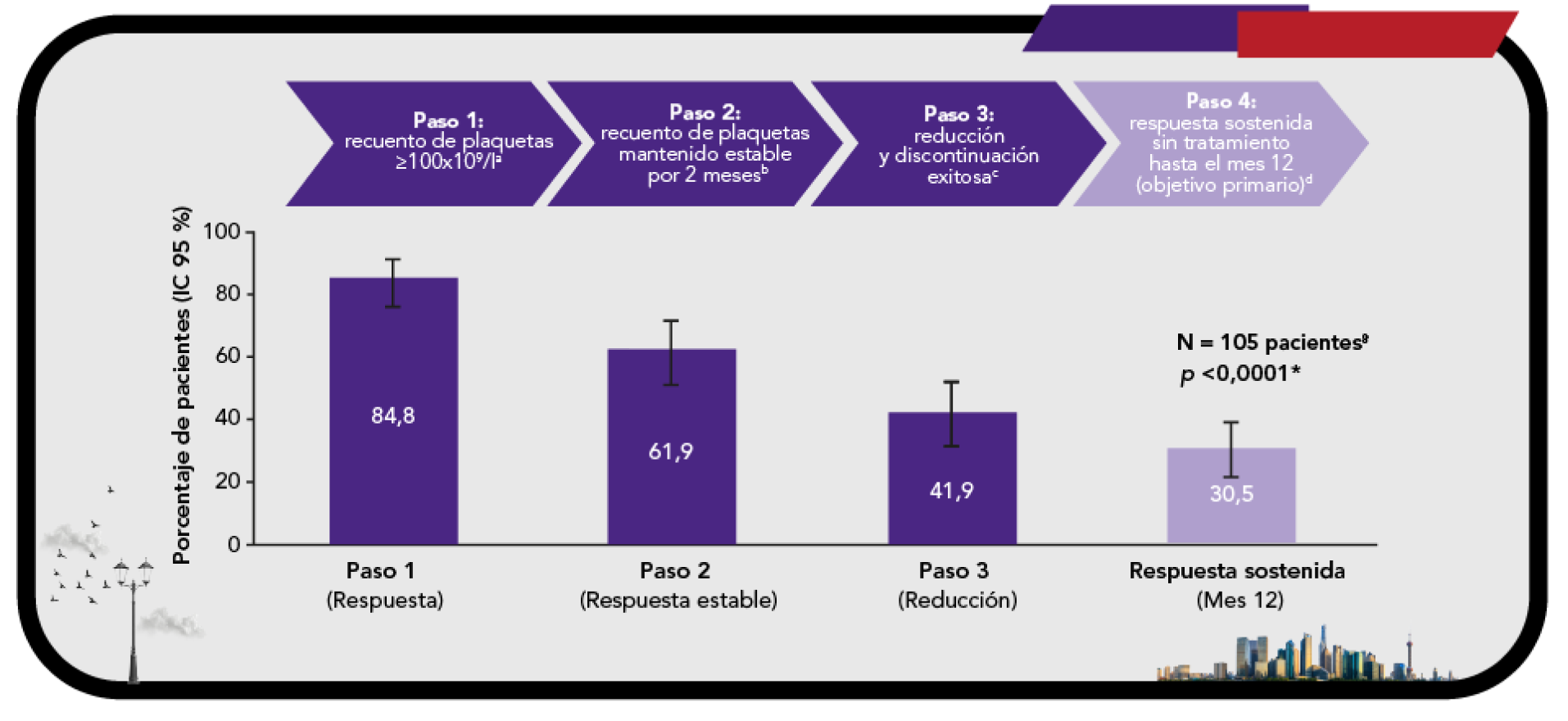
Con un estudio de extensión de casi 9 años, evaluando la seguridad y eficacia a largo plazo en PTI adultos6
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo REVOLADE® proporciona una respuesta elevada6


Comodidad para el paciente
Discontinuación tratamiento

Referencias

Referencias
IT´S TIME TO CHANGE
 VIDEO
VIDEO
Sobreuso de corticosteroides en 1L en la PTI
Entre las razones para el uso excesivo/prolongado de los corticosteroides en la PTI en contra de las recomendaciones de múltiples guías nacionales e internacionales se incluye1,6:
Otros motivos apuntados son9:
*Canadá, China, Colombia, Egipto, Francia, Alemania, India, Italia, Japón, España, Turquía, Reino Unido y Estados Unidos.
1L: primera línea; 2L: segunda línea; 3L: tercera línea; AR-TPO: agonistas del receptor de la trombopoyetina; PTI: trombocitopenia inmune primaria.
Impacto del uso prolongado de corticosteroides
 VIDEO
VIDEO
 VIDEO
VIDEO

¿Qué recomienda la guía GEPTI?

*En estudios de encuesta.
1L: primera línea; 2L: segunda línea; AR-TPO: agonistas del receptor de la trombopoyetina; PTI: trombocitopenia inmune primaria.
Recomendaciones de las guías


Visualiza la píldora de la Dra. Cristina Pascual Izquierdo, hematóloga en el Hospital General Universitario Gregorio Marañón (Madrid), sobre las recomendaciones de la guía GEPTI en cuanto a las dosis y la duración del tratamiento de la PTI con corticosteroides.


Puedes acceder al contenido completo de las Directrices de diagnóstico, tratamiento y seguimiento de la PTI del GEPTI para conocer en detalle las recomendaciones sobre el uso de corticosteroides en el tratamiento de 1L de la PTI.
REVOLADE®, respuesta rápida y sostenida en la PTI1-5
Elevada1
Significativa2
Respuesta de los pacientes con REVOLADE® o placebo durante los 6 meses del tratamiento2
REVOLADE® proporciona una reducción de las hemorragias1,2

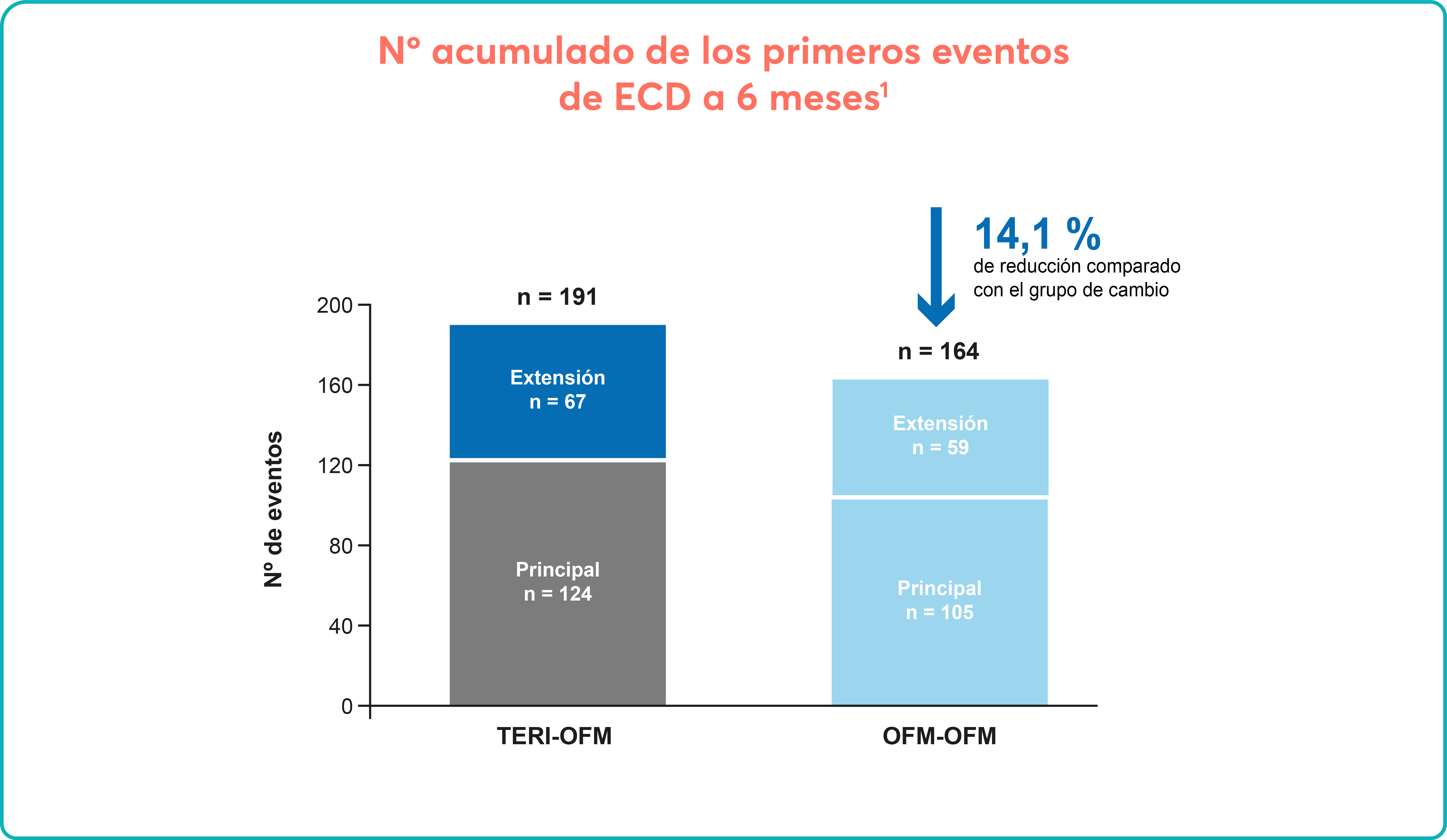
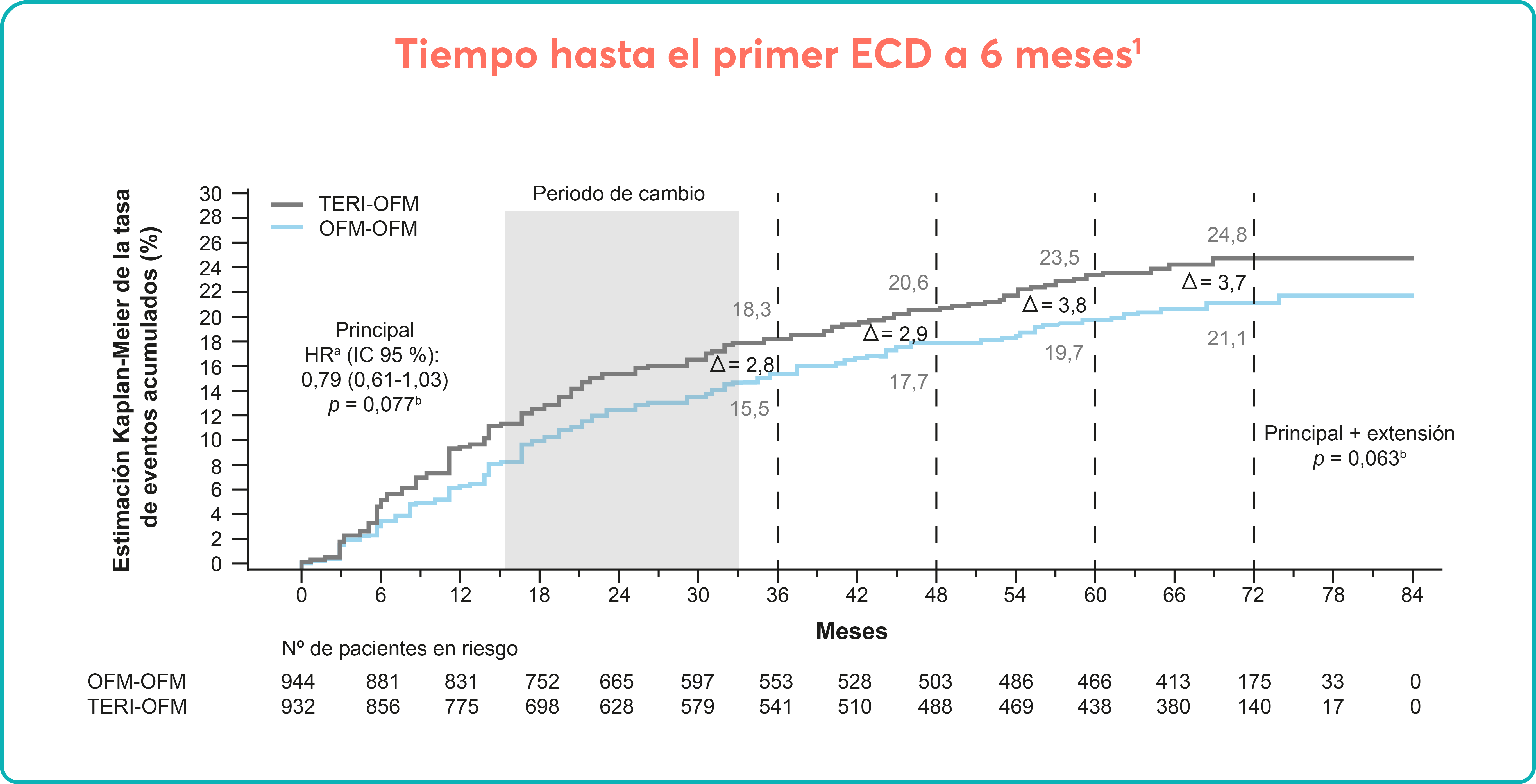
En el mes 24, el 19 % de los pacientes mantuvo respuesta sostenida sin tratamiento en ausencia de eventos hemorrágicos o de tratamiento de rescate3 |
Para tu comodidad, también podrás disponer de un resumen de esta evidencia en formato PDF. Esperamos que te resulte útil.