Jakavi® en Mielofibrosis
El tratamiento de la esplenomegalia o los síntomas relacionados con la enfermedad en pacientes con mielofibrosis (MF) (también conocida como mielofibrosis idiopática crónica).
Ficha Técnica de Jakavi (ruxolitinib).
Vanucchi AM, et al. Advances in understanding and management of myeloproliferative neoplasms. CA Cancer J Clin. 2009:59:171-191.
Levine RL, et al. Role of JAK2 in the pathogenesis and therapy of myeloproliferative disorders. Nat Rev Cancer. 2007;7(9):673-683.
Tefferi A, et al. CALR vs JAK2 vs MPL-mutated or triple-negative myelofibrosis: clinical, cytogenetic and molecular comparisons. Leukemia. 2014;28(7):1472-7.
Quintás-Cardama A, et al. Preclinical characterization of the selective JAK1/2 inhibitor INCB018424: therapeutic implications for the treatment of myeloproliferative neoplasms. Blood. 2010;115(15):3109-3117.
Harrison C, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis. N Engl J Med. 2012;366(9):787-798.
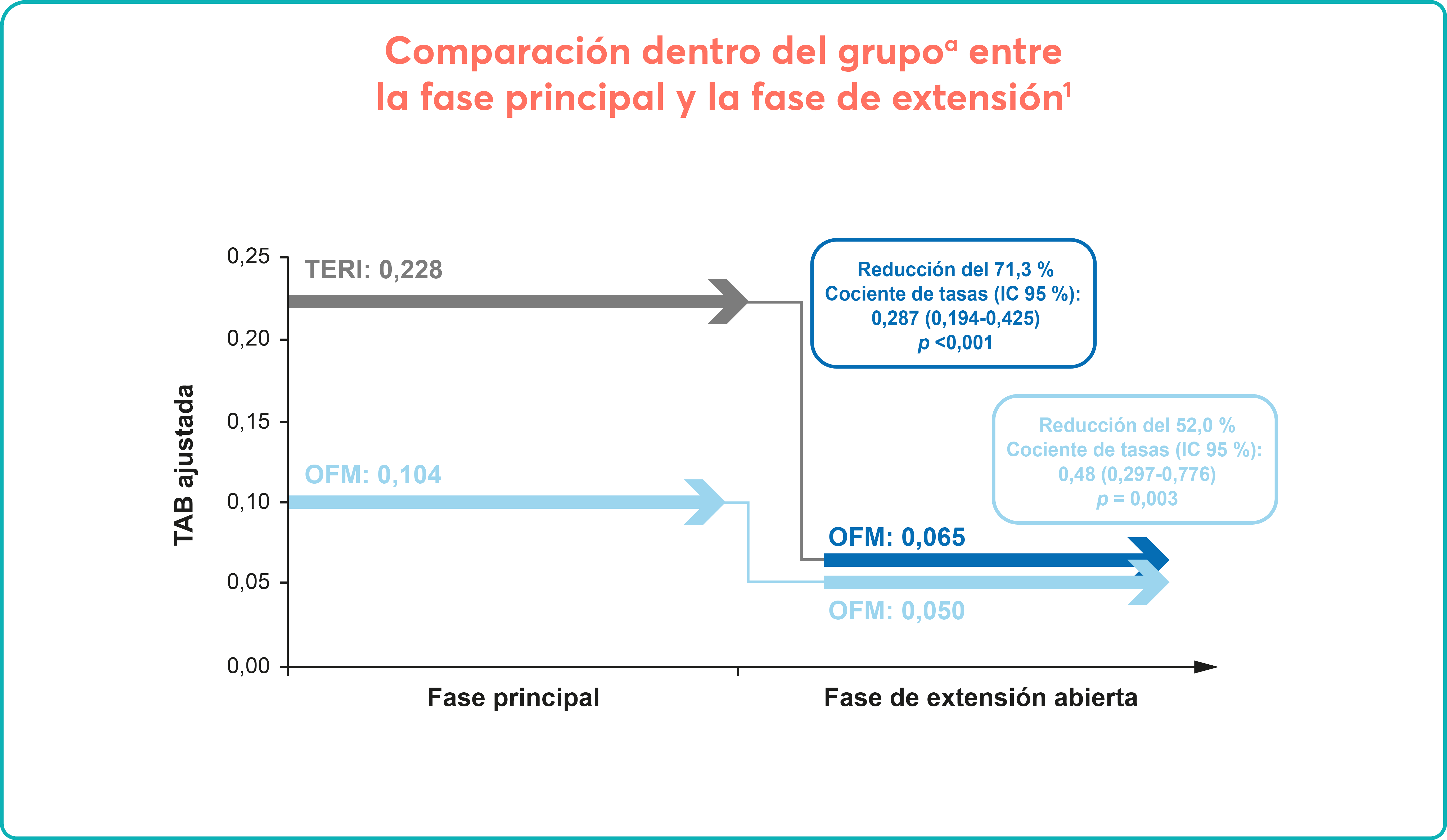
La mayoría de los EA no hematológicos notificados fueron de grado 1-2.2
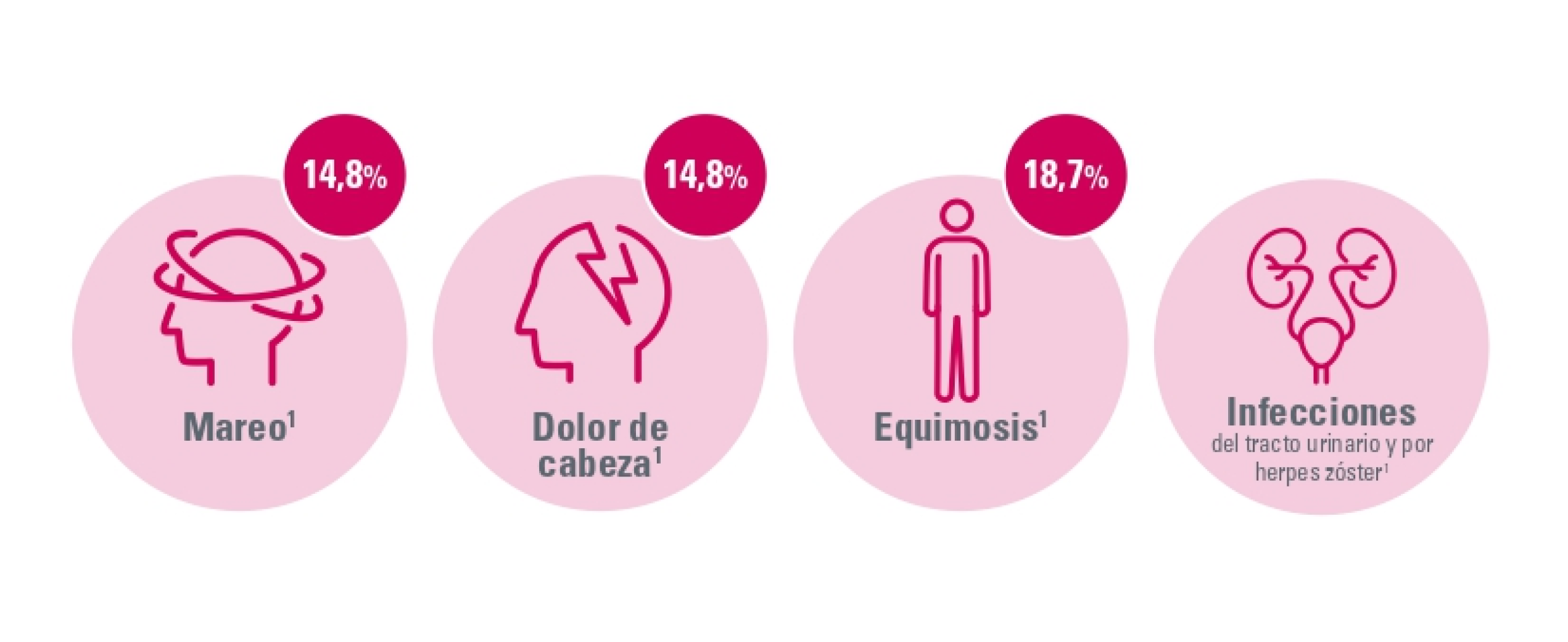
Los EA no hematológicos más frecuentes fueron:
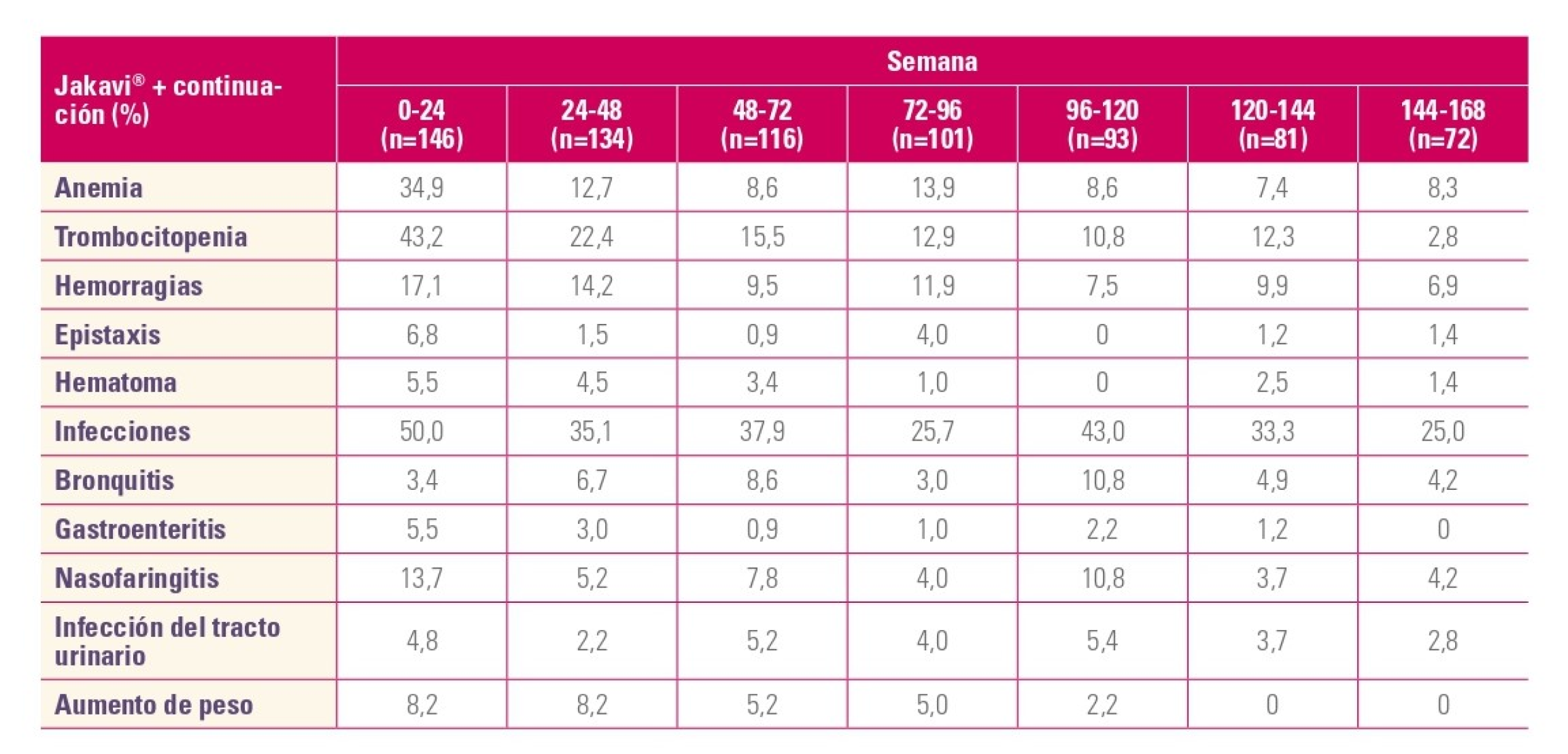
Los EA no hematológicos, en general, con Jakavi disminuyeron con el tiempo y vs. MTD:
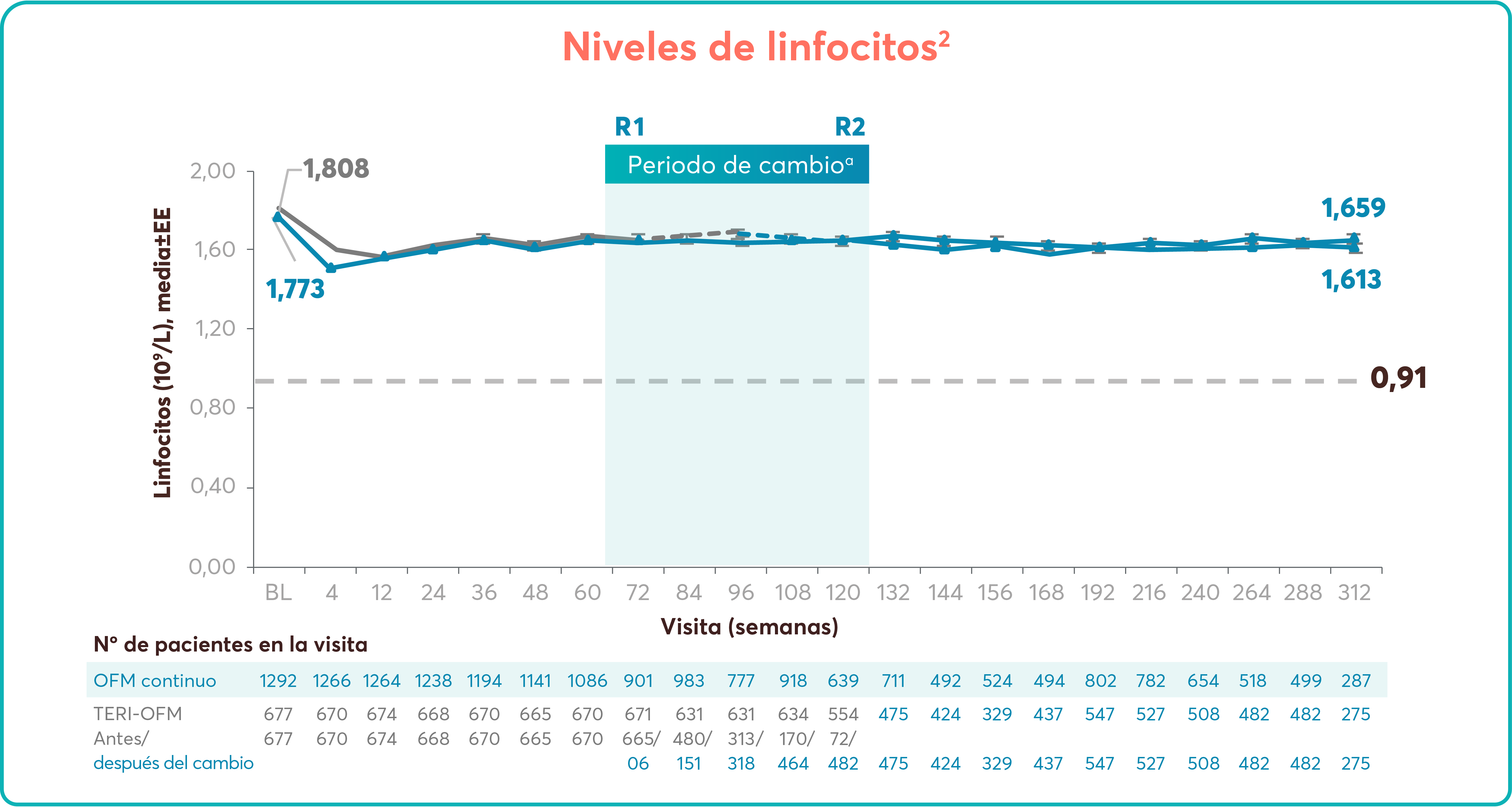
Estos resultados son consistentes con el conocido mecanismo de acción de Jakavi.2
En general ambos fueron manejables, con cambios de dosis y transfusiones, mejorando con el tiempo y sin causar el abandono del tratamiento.2
Únicamente el 2,6% y el 3,2%, respectivamente, de pacientes cesaron el tratamiento, indicando que los eventos adversos eran manejables en la mayoría de pacientes.
Principalmente fueron de grado 1/2 e incluyen diarrea, pirexia, fatiga y astenia.
Los efectos adversos no hematológicos graves de grado 3/4 se describieron en un porcentaje bajo de los pacientes, exceptuando la astenia (16%).
Los porcentajes en pacientes con infecciones descritas también fueron bajos.
No se ha descrito reactivación de hepatitis B en ningún caso2.
Jakavi se debe tomar oralmente, con o sin ingesta de comida.
Si se salta una dosis, el paciente no debe tomar una dosis adicional pero debe tomar la siguiente dosis prescrita.
Antes de iniciar el tratamiento con Jakavi debe realizarse un recuento completo de células sanguíneas, incluyendo un recuento diferencial de leucocitos.
Los recuentos completos de células sanguíneas deben monitorizarse cada 2-4 semanas hasta la estabilización de la dosis y pasar a una monitorización según las indicaciones clínicas.
La dosis de inicio no debe incrementarse durante las 4 primeras semanas de tratamiento y posteriormente, con una frecuencia no superior a intervalos de 2 semanas.
Ficha técnica de Jakavi.
Duración del mantenimiento de una reducción de ≥ 35% en el volumen del bazo respecto al inicio.
Proporción de pacientes que presentaron una reducción ≥ 50% en la puntuación total de síntomas desde el inicio hasta la semana 24, determinado mediante el diario del MFSAF v2.0.
Cambio en la puntuación total de síntomas desde el inicio hasta la semana 24 medido por el diario MFSAF v2.0 modificado.
Supervivencia global.
34 (47%) de los pacientes recibieron hidroxiurea.
49 (67%) de los pacientes recibieron 1 o más tratamientos.
24 (33%) no recibieron medicación.
Proporción de pacientes que alcanzaron una reducción de ≥35% en el volumen del bazo en la semana 24 respecto al inicio.
Duración del mantenimiento de una reducción de ≥35% del volumen del bazo respecto al inicio.
Tiempo hasta reducción de ≥35% del volumen del bazo.
Las estimaciones Kaplan-Meier sobre la probabilidad de mantener la respuesta del bazo en las semanas 48 y 144 fueron 73% (IC 95%, 61-82) y 50% (IC 95%, 36-63), respectivamente.4
Un 53,4% de los pacientes en el brazo de Jakavi® alcanzaron una reducción ≥35% en el volumen del bazo en cualquier momento del tratamiento y un 97,1% de los pacientes consiguieron un beneficio clínico con alguna reducción del volumen del bazo.2
Proporción de pacientes con una reducción ≥ 50% palpable en la longitud del bazo
Resultados informados por el paciente: evaluación funcional de la terapia contra el cáncer-linfoma puntuación total y evaluación funcional de la terapia de enfermedades crónicas (escala de fatiga)
Supervivencia libre de progresión
Supervivencia sin transformación a leucemia mieloide aguda (supervivencia libre de AML)
Supervivencia global
Las estimaciones Kaplan-Meier sobre la probabilidad de mantener la respuesta del bazo en las semanas 48 y 96 fueron de 88% (IC 95%, 86-90%) y 78% (IC 95%, 75-81%), respectivamente1
En la semana 24, 56,5% de los pacientes consiguieron una reducción del tamaño del bazo igual o superior al 50% y un 61,4% y 66,5% a las semanas 48 y 96 respectivamente1.
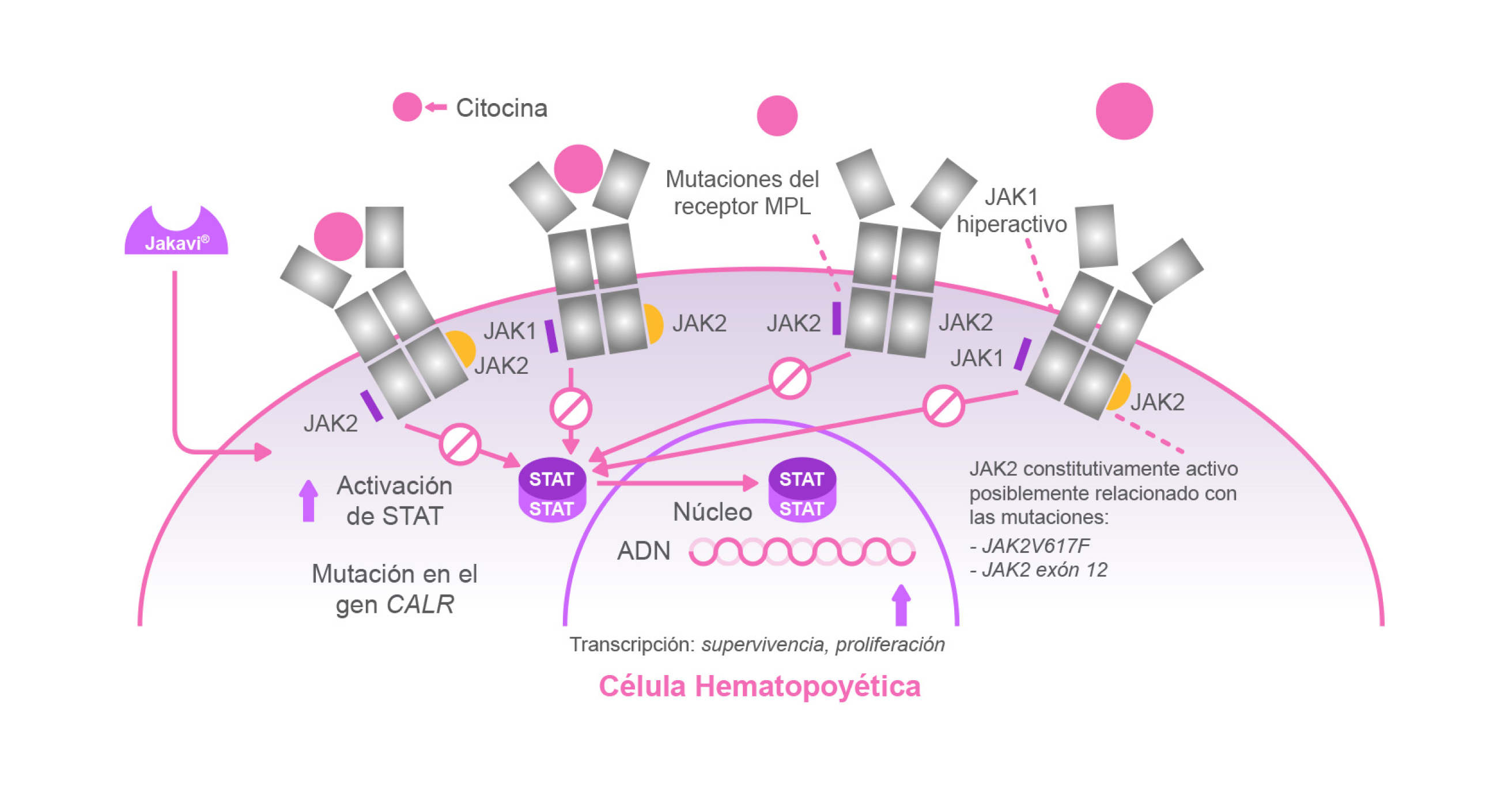
Sobre Jakavi®
Jakavi (ruxolitinib) es la primera terapia dirigida, administrada por vía oral, aprobada por la EMA y FDA para:1
Es un potente inhibidor de las proteínas JAK1 y JAK2, quinasas que juegan un papel importante en la hematopoyesis y en la función inmunológica.1
Referencia
Mecanismo de acción
 VIDEO
VIDEO
Referencias
Seguridad-COMFORT I/II
Jakavi® ha demostrado un perfil de seguridad consistente a largo plazo y presenta una buena tolerabilidad en pacientes con MF.1,3
Perfil de seguridad bien definido sin nuevos efectos adversos descritos o aparición de patrones inesperados a los 5 años de seguimiento.1
Efectos adversos no hematológicos

Efectos adversos hematológicos
Los efectos adversos más comunes en pacientes tratados con Jakavi fueron anemia (82,4%) y trombocitopenia (69,8%).4
MTD: Mejor Terapia Disponible.
Referencias:
1. Verstovsek S, et al. Efficacy, safety, and survival with ruxolitinib in patients with myelofibrosis: results of a median 3-year follow-up of COMFORT-I. Haematologica, 2015; 100(4):479-88. 2. Cervantes F, et al. Three-year efficacy, safety, and survival findings from COMFORT-II, a phase 3 study comparing ruxolitinib with best available therapy for myelofibrosis. Blood, 2013; 122(25):4047-53. 3. Harrison C, et al. JAK inhibition with ruxolinitib versus best available therapy for myelofibrosis. N Engl J Med, 2012; 366(9):787-798. 4. Ficha Técnica de Jakavi. (ruxolitinib). Disponible en: https://cima.aemps.es/cima 5. Gupta V, et al. The impact of anemia on overall survival in patients with myelofibrosis treated with ruxolitinib in the COMFORT studies. Haematologica. 2016 Sep 1. pii: haematol.2016.151449. 6. Verstovsek S, et al. A double-blind, placebo controlled trial of ruxolitinib for myelofibrosis. N Engl J Med. 2012;366(9):799-807.
Seguridad JUMP
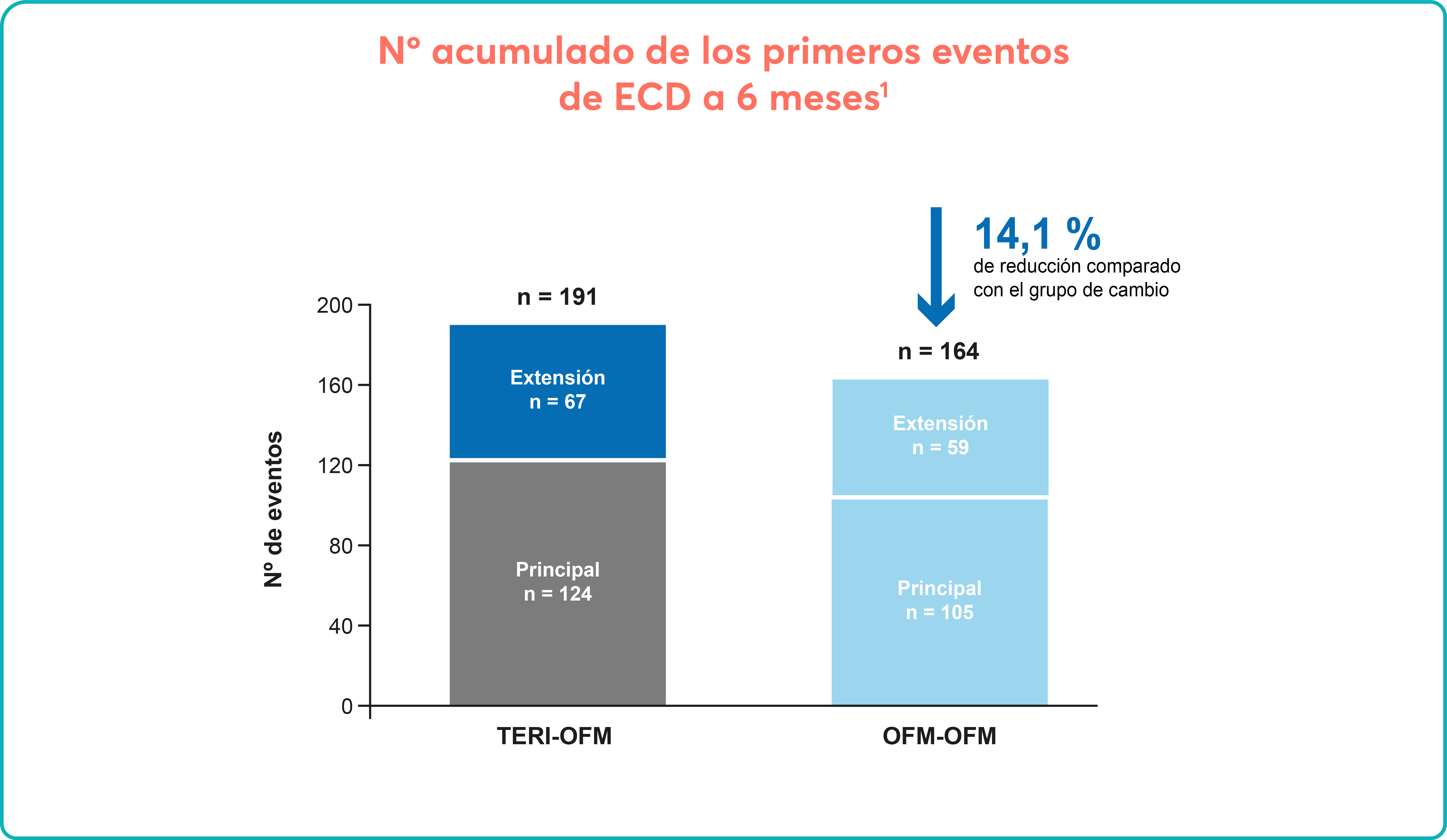
Entre los efectos adversos graves que se describieron en 369 pacientes (32,3%), entre los que se incluyes anemia, neumonía, pirexia, fallo cardiaco, disnea, dolor abdominal, hemorragia gastrointestinal, trombocitopenia, fibrilación cardiaca atrial y deterioro general de la salud física1,2.
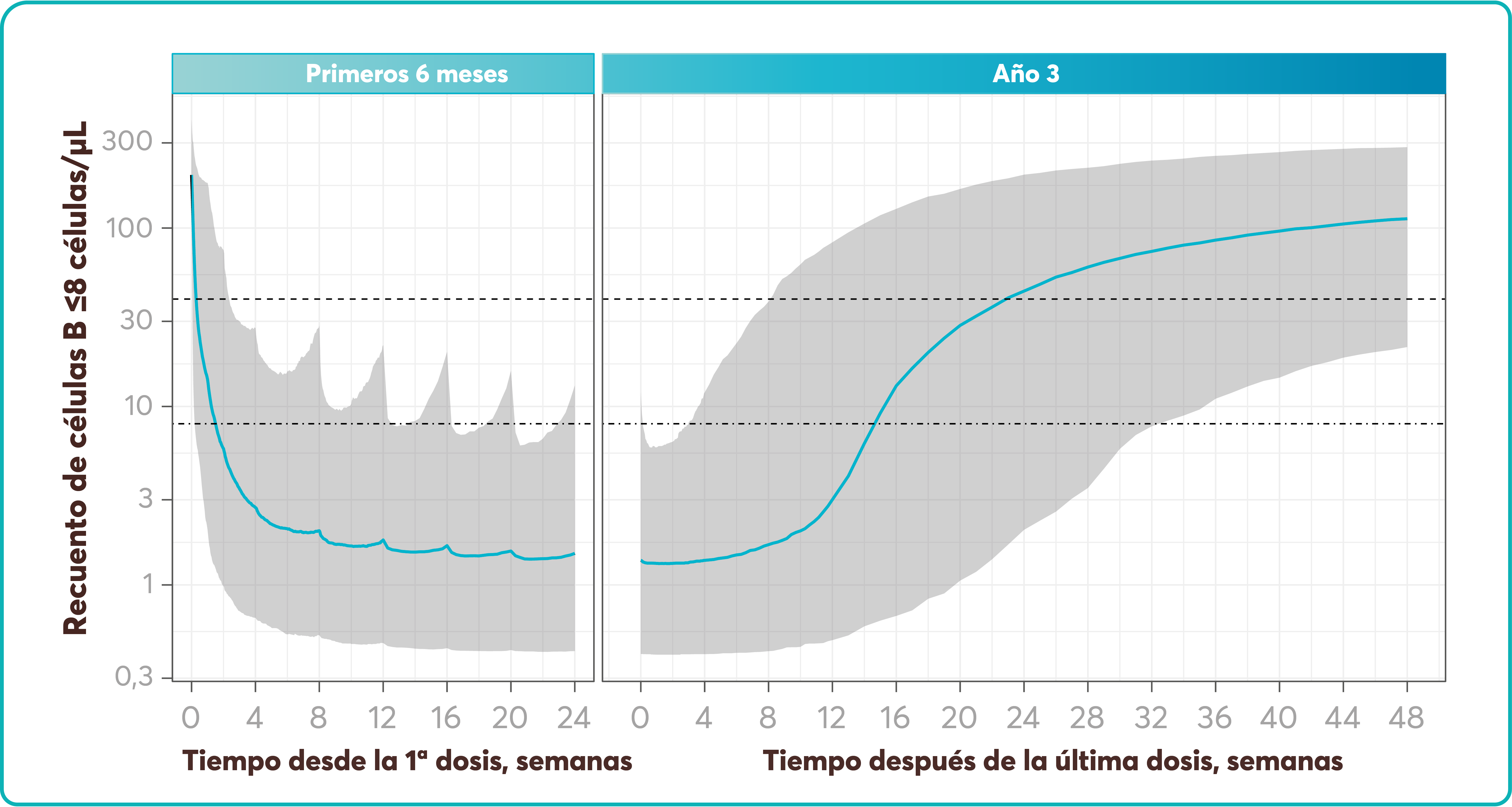
Efectos adversos hematológicos
En concordancia con los resultados obtenidos en los estudios COMFORT, los efectos adversos más comunes hematológicos fueron anemia (59,5%) y trombocitopenia (53,5%)2
La media de los niveles de hemoglobina se vio disminuida (108 g/L) durante las primeras 8-12 semanas pero se recuperaron a lo largo del tiempo. La media de plaquetas también disminuyó en las primeras 4 semanas y se mantuvo estable el resto del estudio2.
Efectos adversos no hematológicos2
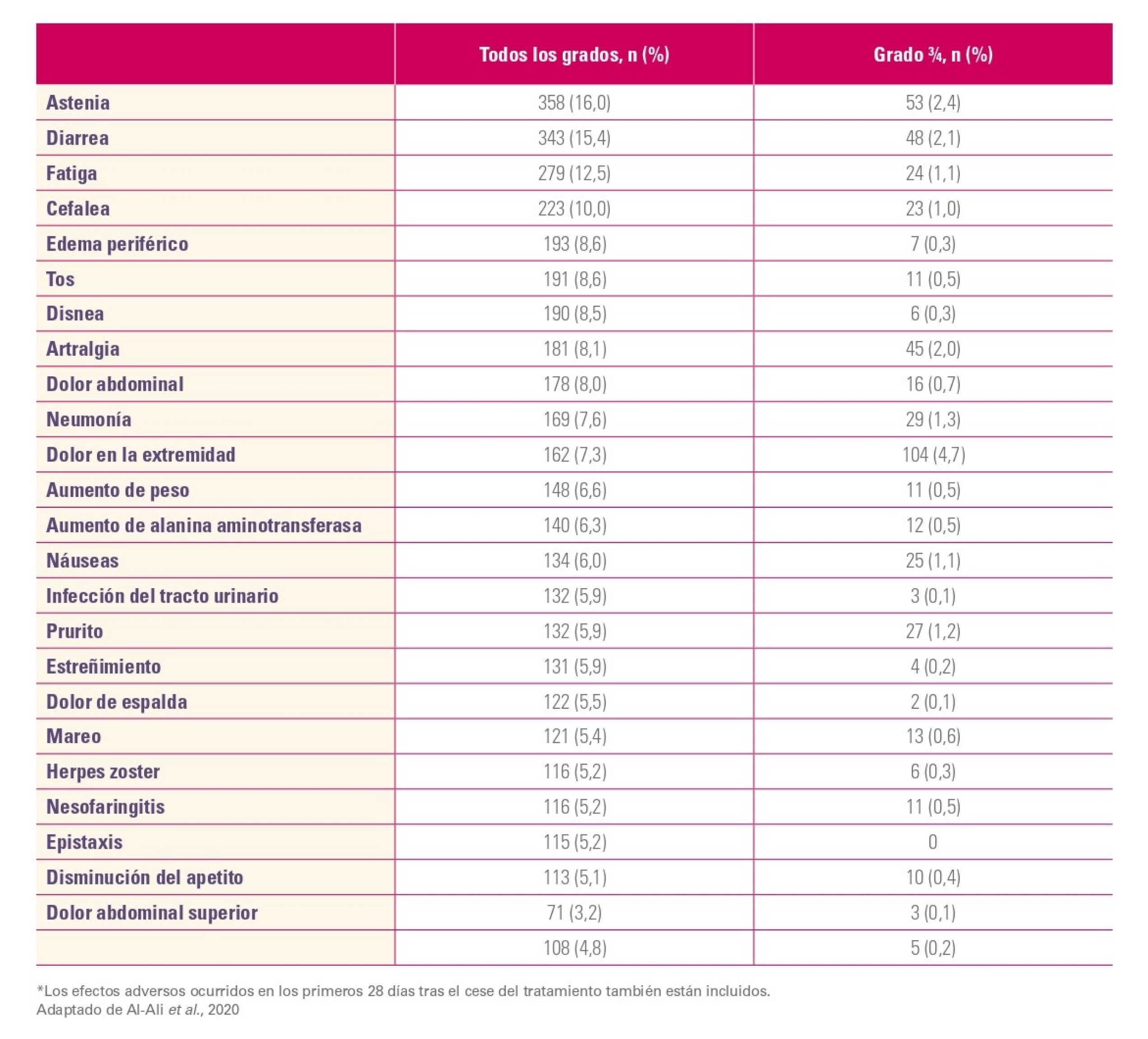
Referencias:
1. Al-Ali et al. Safety and efficacy of ruxolitinib in an open-label, multicenter, single-arm phase 3b expanded-access study in patients with myelofibrosis: a snapshot of 1144 patients in the JUMP trial. Haematologica, 2016, 101(9), 1065–1073.
2. Al-Ali et al. Primary analysis of JUMP, a phase 3b, expanded-access study evaluating the safety and efficacy of ruxolitinib in patients with myelofibrosis, including those with low platelet counts. Br J Haematol. 2020;189(5):888-903.
Dosis y recomendaciones
Jakavi® está indicado para el tratamiento de la esplenomegalia o los síntomas relacionados con la enfermedad en pacientes adultos con mielofibrosis primaria (también conocida como mielofibrosis idiopática crónica), mielofibrosis secundaria a policitemia vera o mielofibrosis secundaria a trombocitemia esencial.1
La dosis máxima de Jakavi es de 25 mg y las dosis disponibles de los comprimidos son: 5 mg, 10 mg, 15 mg y 20 mg1.
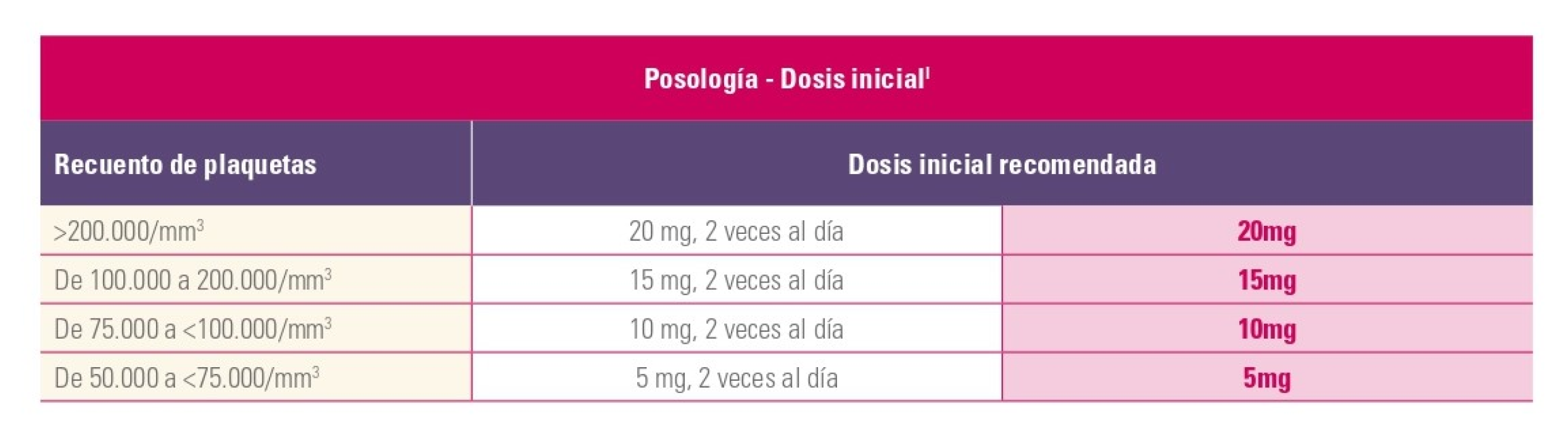
Monitorización
El tratamiento con Jakavi puede continuarse mientras el balance beneficio-riesgo se mantenga positivo.1
Se debe monitorizar el hemograma completo, incluyendo un recuento diferencial de leucocitos, cada 2-4 semanas hasta que se estabilicen las dosis y, posteriormente, según esté indicado clínicamente1.
El tratamiento debe interrumpirse después de 6 meses si no se ha observado reducción en el tamaño del bazo o bien una mejoría en los síntomas respecto al inicio del tratamiento.1
Modificaciones de la dosis1
Las dosis se pueden ajustar en base a la seguridad y la eficacia:
Consideraciones especiales1
Consideraciones importantes para la administración1
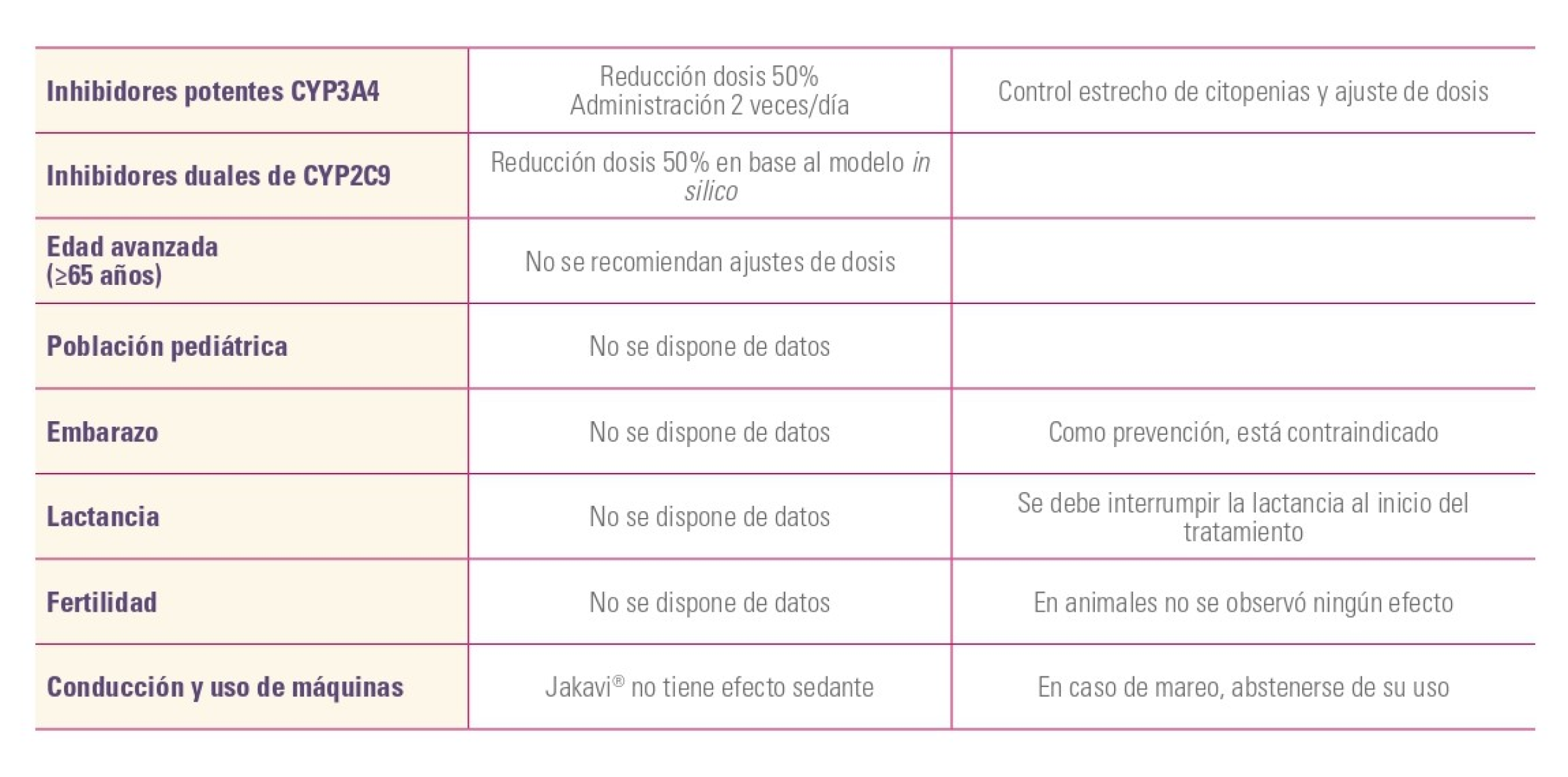
Poblaciones especiales
En poblaciones de pacientes especiales, los ajustes de dosis se pueden realizar en base a insuficiencia renal o hepática1
Referencia
Diseño del estudio
COMFORT-I: Estudio de fase III, doble ciego, aleatorizado, controlado con placebo1
Objetivo principal1
Proporción de pacientes que alcanzaron una reducción de ≥35% del volumen del bazo en la semana 24 respecto al inicio (medido por RM o TC).
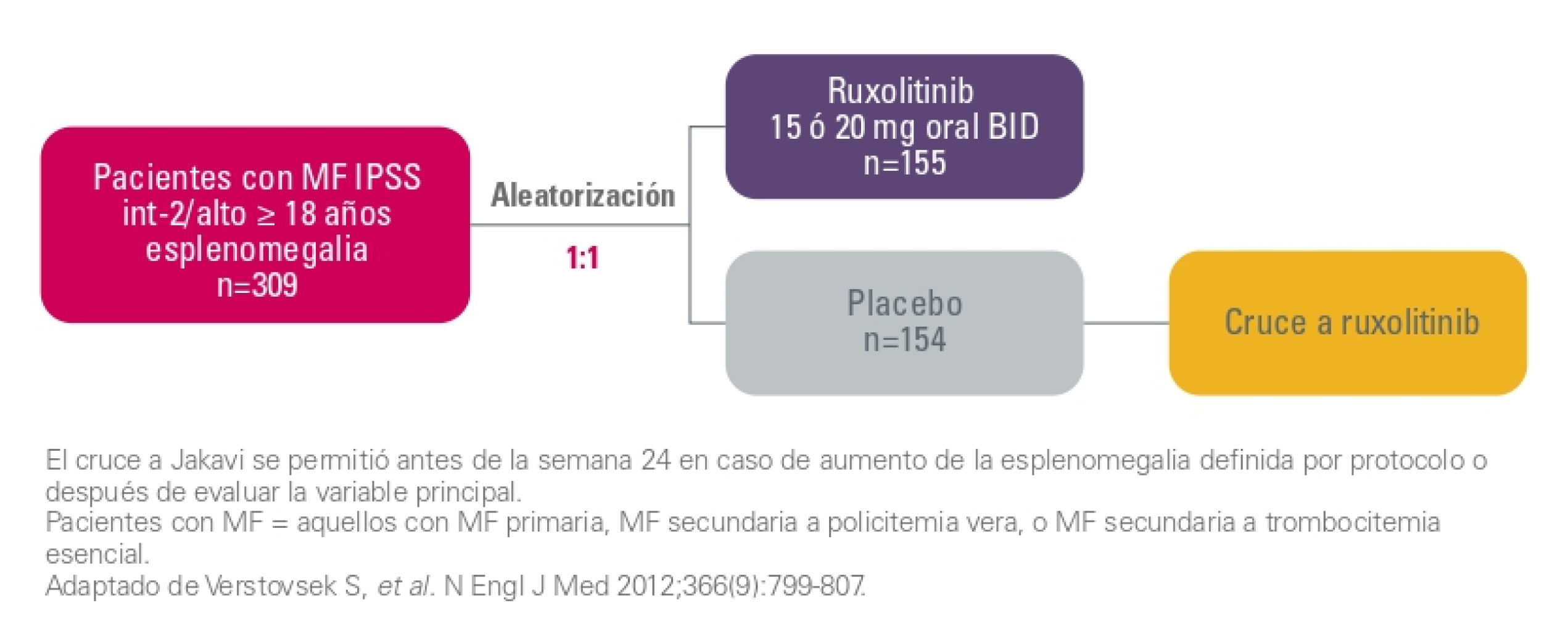
Objetivos secundarios1
COMFORT-II: Estudio de fase III, abierto, aleatorizado frente a la MTD2
Objetivo principal2
Proporción de pacientes que alcanzaron una reducción de ≥35% del volumen del bazo en la semana 24 respecto al inicio (medido por RM o TC).

Objetivos secundarios2
MFSAF: Myelofibrosis Symptom Assessment Form; RM: Resonancia Magnética; TC: Tomografía Computerizada.
Referencias:
1. Verstovsek S, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis. N Engl J Med. 2012;366(9):799-807.
2. Harrison C, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis. N Engl J Med. 2012;366(9):787-798.
Esplenomegalia
El tratamiento con Jakavi redujo el tamaño del bazo de forma duradera.1,4
IC: Intervalo de Confianza.
Referencias:
1. Verstovsek, et al. Efficacy, Safety, and Survival With Ruxolitinib In Patients With Myelofibrosis: Results Of A Median 3-Year Follow-Up Of COMFORT-I. Haematologica; 2015;100(4):479-488.
2. Harrison CN, et al. Long-term findings from COMFORT-II, a phase 3 study of ruxolitinib vs best available therapy for myelofibrosis. Leukemia 2016;30(8):1701-1707.
3. Harrison C, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis. N Engl J Med. 2012;366(9):787-798.
4. Cervantes F, et al. Three year efficacy, safety, and survival findings from COMFORT‐II, a phase 3 study comparing ruxolitinib with best available therapy for myelofibrosis. Blood, 2013; 122(25):4047‐53
Sintomatología
Referencias:
1. Verstovsek, et al. Efficacy, Safety, And Survival With Ruxolitinib In Patients With Myelofibrosis: Results Of A Median 3-Year Follow-Up Of COMFORT-I. Haematologica; 2015;100(4):479-488.
2. Harrison CN, et al. Long-term findings from COMFORT-II, a phase 3 study of ruxolitinib vs best available therapy for myelofibrosis. Leukemia 2016;30(8):1701-1707.
Supervivencia global
Análisis agrupado de COMFORT-I y COMFORT-II: supervivencia global (SG) a 5 años1
El riesgo de muerte se redujo un 30% entre los pacientes aleatorizados a Jakavi en comparación con los pacientes del grupo control (mediana de la SG: Jakavi, 5,3 años; grupo control, 3,8 años; HR (Jakavi frente a control), 0,70; IC del 95 %, 0,54-0,91; p = 0,0065).
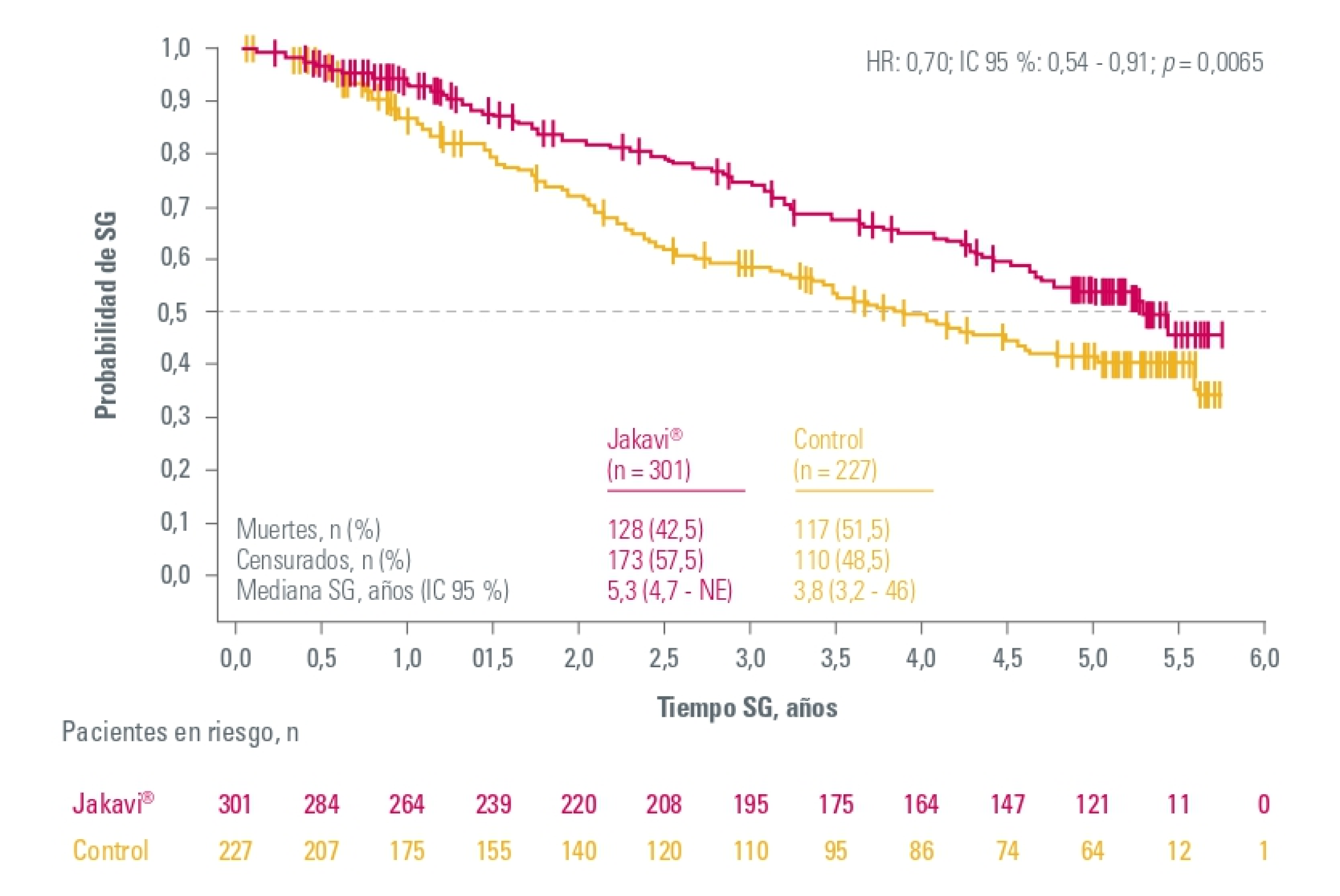
HR: Hazard Ratio; IC: Intervalo de Confianza.
Referencias:
1. Verstovsek S, et al. Long-term treatment with ruxolitinib for patients with myelofibrosis: 5-year update from the randomized, double-blind, placebo-controlled, phase 3 COMFORT-I trial. J Hematol Oncol. 2017 Feb 22;10(1):55.
Diseño del estudio
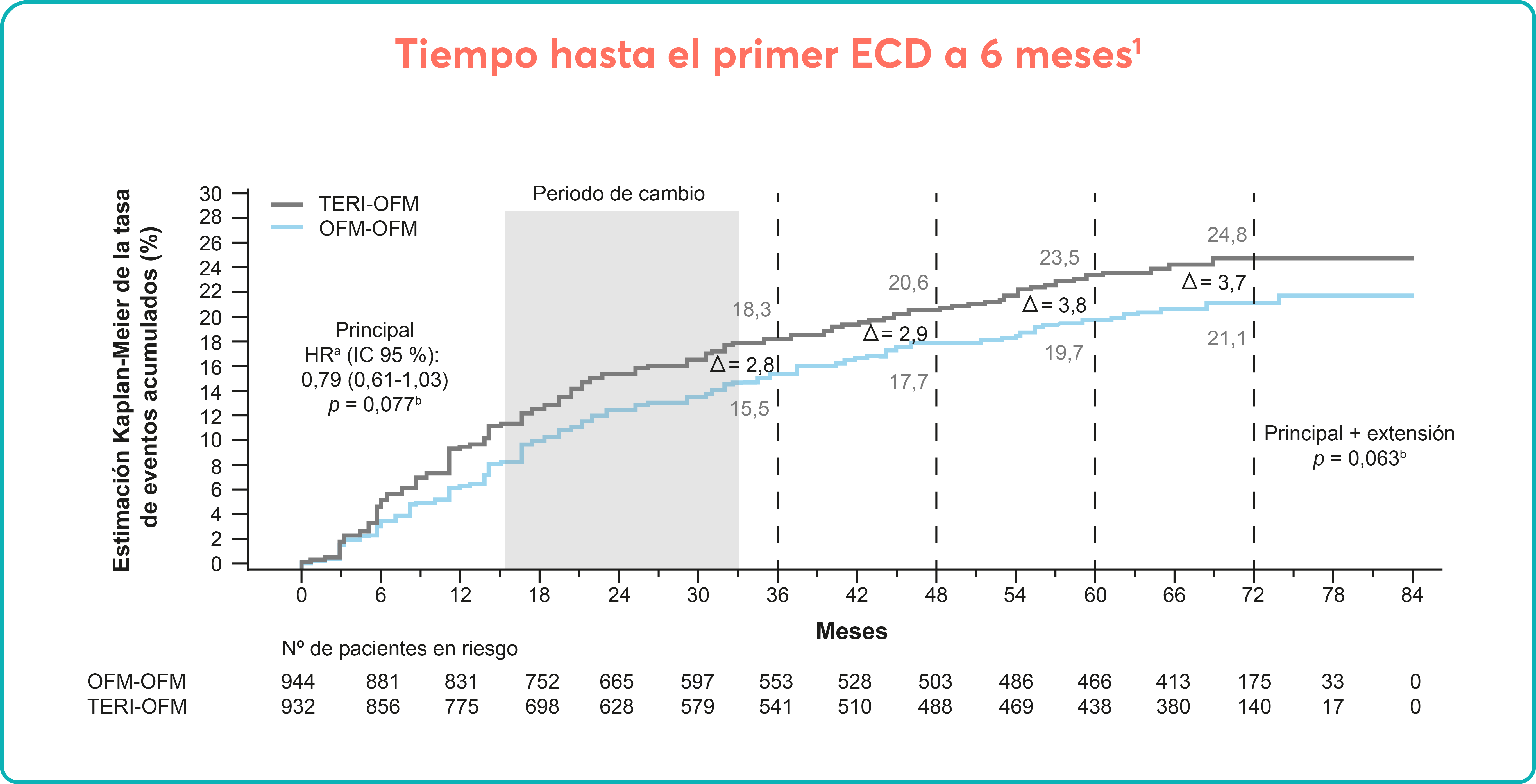
JUMP es un estudio de brazo único, de acceso global en fase 3b, en el que se incluyeron pacientes en riesgo alto o intermedio-2 así como pacientes en riesgo intermedio-1, un grupo de pacientes que el estudio COMFORT no incluía1,2.
Objetivo principal
Establecer la seguridad y tolerabilidad de Jakavi mediante el análisis de la frecuencia duración y severidad de los efectos adversos1,2.
Objetivos secundarios1,2
Referencias:
1. Al-Ali et al. Safety and efficacy of ruxolitinib in an open-label, multicenter, single-arm phase 3b expanded-access study in patients with myelofibrosis: a snapshot of 1144 patients in the JUMP trial. Haematologica, 2016, 101(9), 1065–1073.
2. Al-Ali et al. Primary analysis of JUMP, a phase 3b, expanded-access study evaluating the safety and efficacy of ruxolitinib in patients with myelofibrosis, including those with low platelet counts. Br J Haematol. 2020;189(5):888-903.
Esplenomegalia
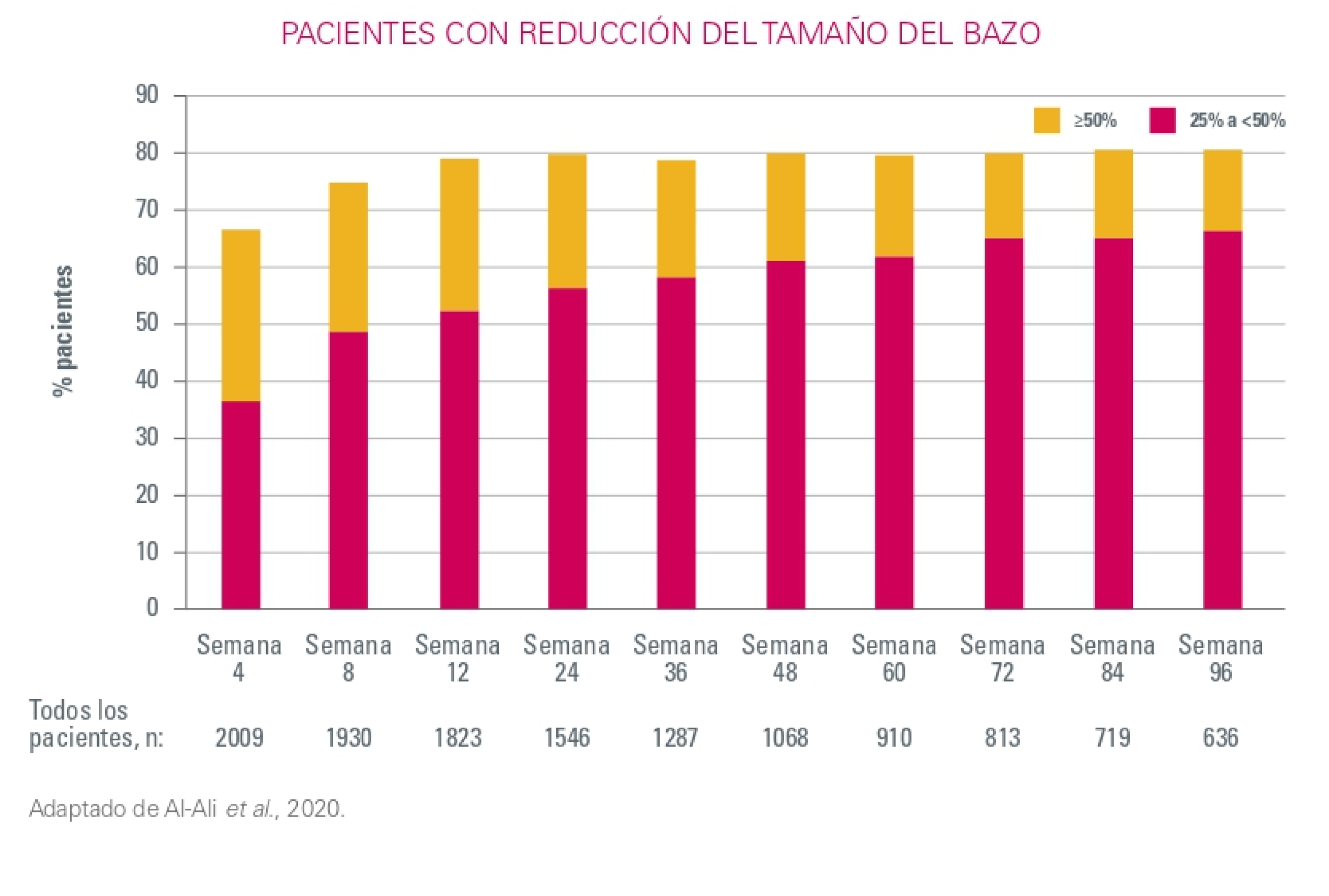
Referencias:
1. Al-Ali et al. Primary analysis of JUMP, a phase 3b, expanded-access study evaluating the safety and efficacy of ruxolitinib in patients with myelofibrosis, including those with low platelet counts. Br J Haematol. 2020;189(5):888-903.
Sintomatología
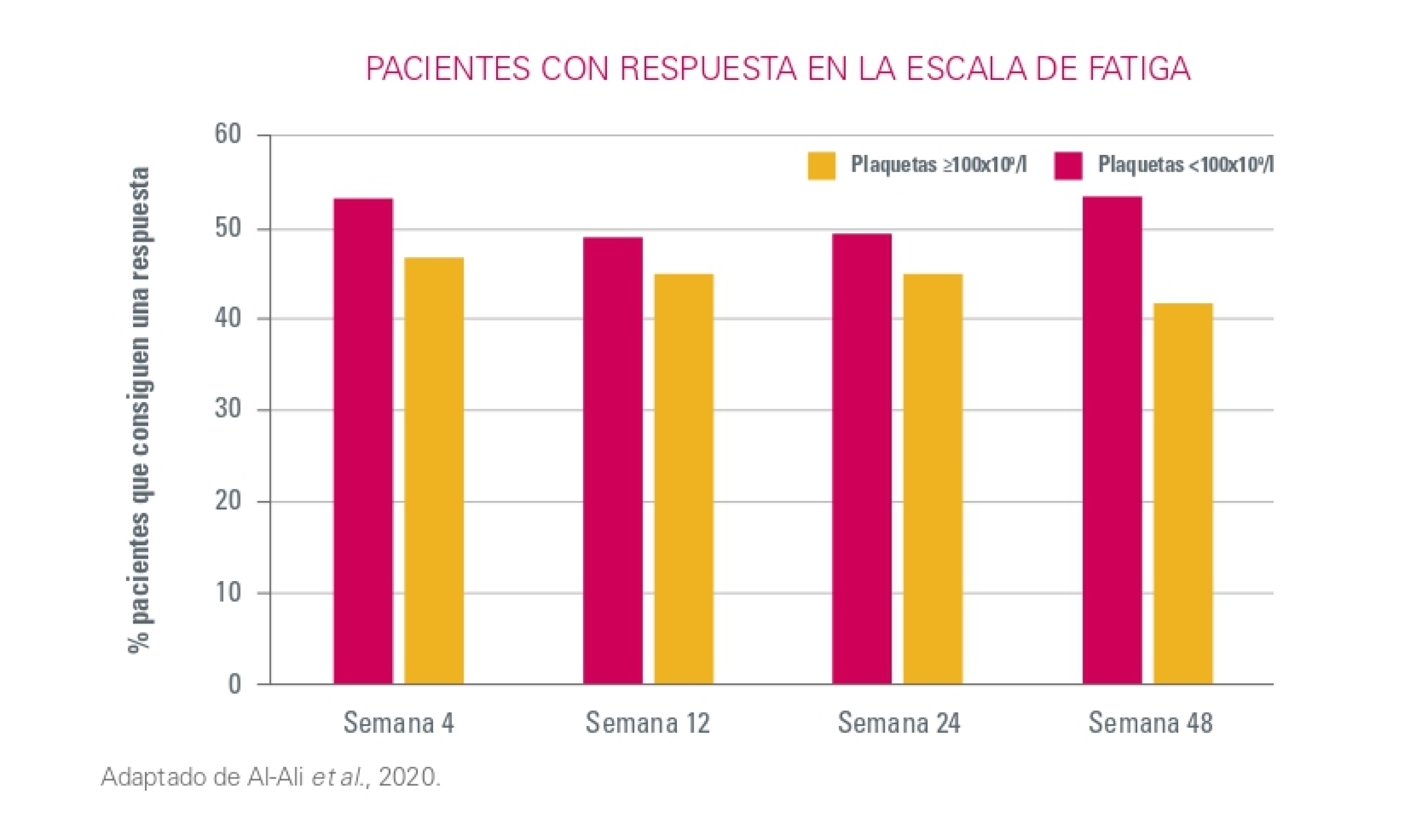
Clínicamente, 4 semanas tras el inicio del tratamiento ya se observaron mejoras en los síntomas y se mantuvieron a lo largo del tiempo, medido por la escala de fatiga en enfermedades crónicas1.
IC: Intervalo de Confianza.
Referencias:
1. Al-Ali et al. Primary analysis of JUMP, a phase 3b, expanded-access study evaluating the safety and efficacy of ruxolitinib in patients with myelofibrosis, including those with low platelet counts. Br J Haematol. 2020;189(5):888-903.
Supervivencia global
La supervivencia global estimada fue de 94% (IC 95%, 92-95) a la semana 48 y del 87% (IC 95%, 85-89) a la semana 96. Además, la supervivencia libre de LMA en la semana 96 fue del 85% (IC 95%, 83-87)1.
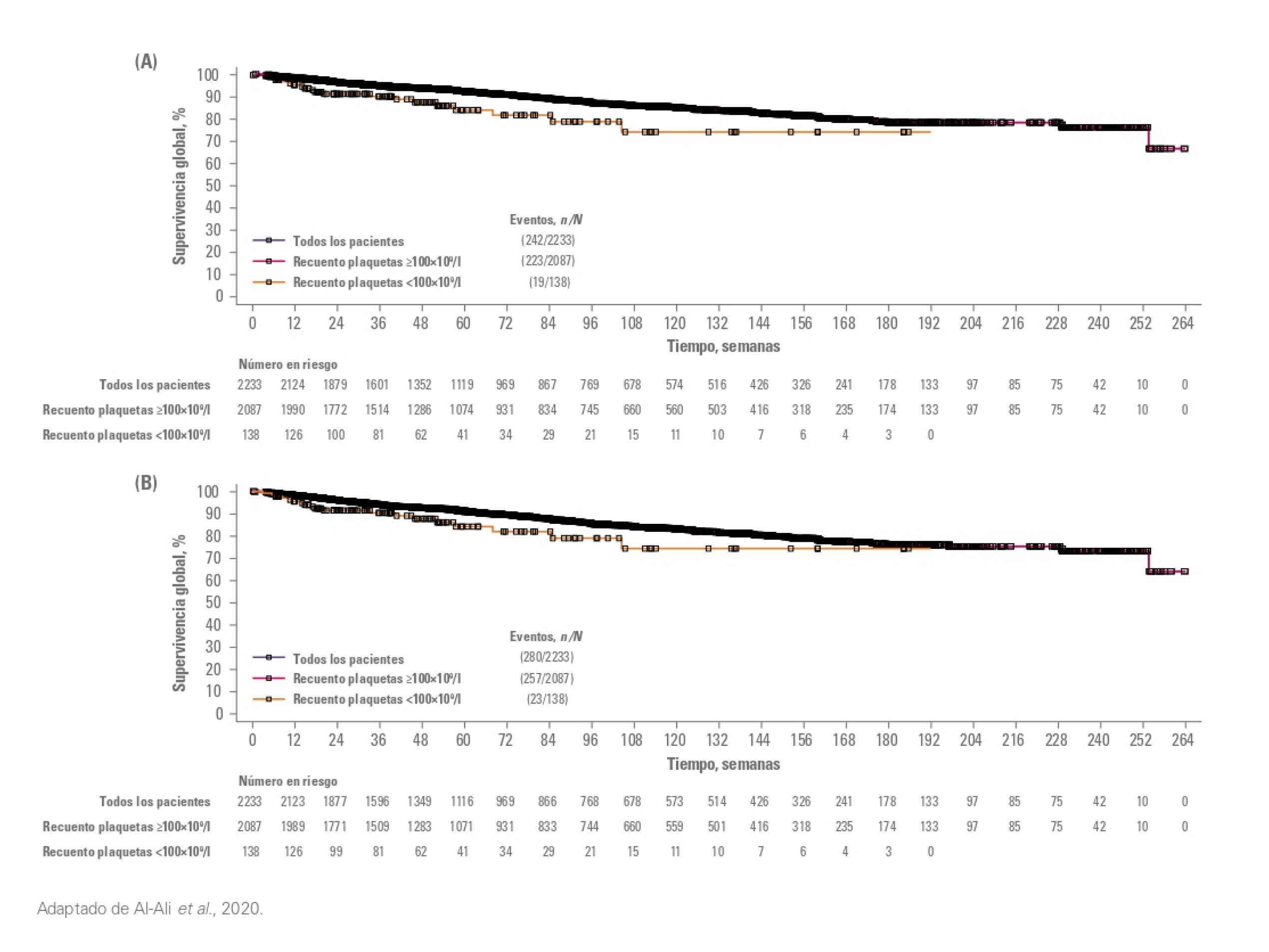
LMA: Leucemia Mieloide Aguda; IC: Intervalo de Confianza.
Referencias:
1. Al-Ali et al. Primary analysis of JUMP, a phase 3b, expanded-access study evaluating the safety and efficacy of ruxolitinib in patients with myelofibrosis, including those with low platelet counts. Br J Haematol. 2020;189(5):888-903.
Con receta Médica. Diagnóstico Hospitalario. Reembolsado por el SNS, se limita su dispensación, sin necesidad de visado, a los pacientes no hospitalizados, en los Servicios de Farmacia de los Hospitales; por lo tanto irá desprovisto de cupón precinto. PVLn Jakavi 10 mg 56 comprimidos 3.583,33 €. PVLn Jakavi 15 mg 56 comprimidos 3.583,33 €. PVLn Jakavi 20 mg 56 comprimidos 3.583,33 €. PVLn Jakavi 5 mg 56 comprimidos 1.791,66 €.