Rydapt® en Leucemia Mieloide Aguda
Rydapt (midostaurina) ya está disponible para las siguientes indicaciones:1
Pacientes adultos con leucemia mieloide aguda (LMA) de nuevo diagnóstico con mutación en FLT3, en combinación con quimioterapia estándar de inducción (daunorubicina y citarabina) y de consolidación (altas dosis de citarabina) seguido de Rydapt en monoterapia como tratamiento de mantenimiento** en pacientes que hayan alcanzado una respuesta completa.
En monoterapia para el tratamiento de pacientes adultos con mastocitosis sistémica agresiva (MSA), mastocitosis sistémica asociada a neoplasia hematológica (MS-ANH) o leucemia de mastocitos (LM).*
Puedes consultar más información sobre Rydapt en MS Avanzada aquí:
Con receta Médica. Diagnóstico Hospitalario. Reembolsado por el SNS, se limita su dispensación, sin necesidad de visado, a los pacientes no hospitalizados, en los Servicios de Farmacia de los Hospitales; por lo tanto irá desprovisto de cupón precinto. PVLn RYDAPT 25 mg 56 cápsulas 6.673,77 €. El tratamiento en monoterapia con Rydapt en pacientes que hayan alcanzado respuesta completa no está financiado.
Patnaik MM. The importance of FLT3 mutational analysis in acute myeloid leukemia. Leuk Lymphoma. 2017:1-14.
Stone RM, Manley PW, Larson RA, et al. Midostaurin: its odyssey from discovery to approval for treating acute myeloid leukemia and advanced systemic mastocytosis. Blood Adv. 2018;2(4):444-53.
Kayser S, Levis MJ. Advances in targeted therapy for acute myeloid leukaemia. Br J Haematol. 2018;180(4):484-500.
Dohner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017;129(4):424-47.
Visser O, Trama A, Maynadie M, et al. Incidence, survival and prevalence of myeloid malignancies in Europe. Eur J Cancer. 2012;48(17):3257-66.
Luskin MR, DeAngelo DJ. Midostaurin/PKC412 for the treatment of newly diagnosed FLT3 mutation-positive acute myeloid leukemia. Expert Rev Hematol. 2017;10(12):1033-45.
Stone RM, Mandrekar S, Sanford BL, et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med. 2017;377(5):454-64.
Ficha técnica Rydapt. Novartis Europharm Ltd.
Novartis. Novartis Media Release. Novartis drug Rydapt® (midostaurin) receives EU approval for newly diagnosed FLT3-mutated acute myeloid leukemia (AML) and three types of advanced systemic mastocytosis (SM). Disponible en: https://www.novartis.com/news/media-releases/novartis-drug-rydaptr-midos....
Stone RM, Mandrekar S, Sanford BL, et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. N Engl J Med. 2017;377(5):454-64.
Ficha técnica Rydapt. Novartis Europharm Ltd.
Foss B, Ulvestad E, Bruserud O. Platelet-derived growth factor (PDGF) in human acute myelogenous leukemia: PDGF receptor expression, endogenous PDGF release and responsiveness to exogenous PDGF isoforms by in vitro cultured acute myelogenous leukemia blasts. Eur J Haematol. 2001;67(4):267-78.
Trujillo A, McGee C, Cogle CR. Angiogenesis in acute myeloid leukemia and opportunities for novel therapies. J Oncol. 2012;2012:128608.
Krause DS, Van Etten RA. Tyrosine kinases as targets for cancer therapy. N Engl J Med. 2005;353(2):172-87.
Rattu M, Shah N, Iskhakova T, et al. The Utility of FLT3 Inhibitors in Acute Myeloid Leukemia. US Pharmacist. 2014;2014;39(11(Specialty&Oncology suppl)):8-11.
Altman A, Villalba M. Protein kinase C-theta (PKCtheta): it’s all about location, location, location. Immunol Rev. 2003;192:53-63.
Referencias
Referencia
Rydapt induce el arresto del ciclo celular y la apoptosis en células leucémicas que expresan FLT3 mutado (ITD o TKD), o que sobreexpresan el receptor no mutado.1
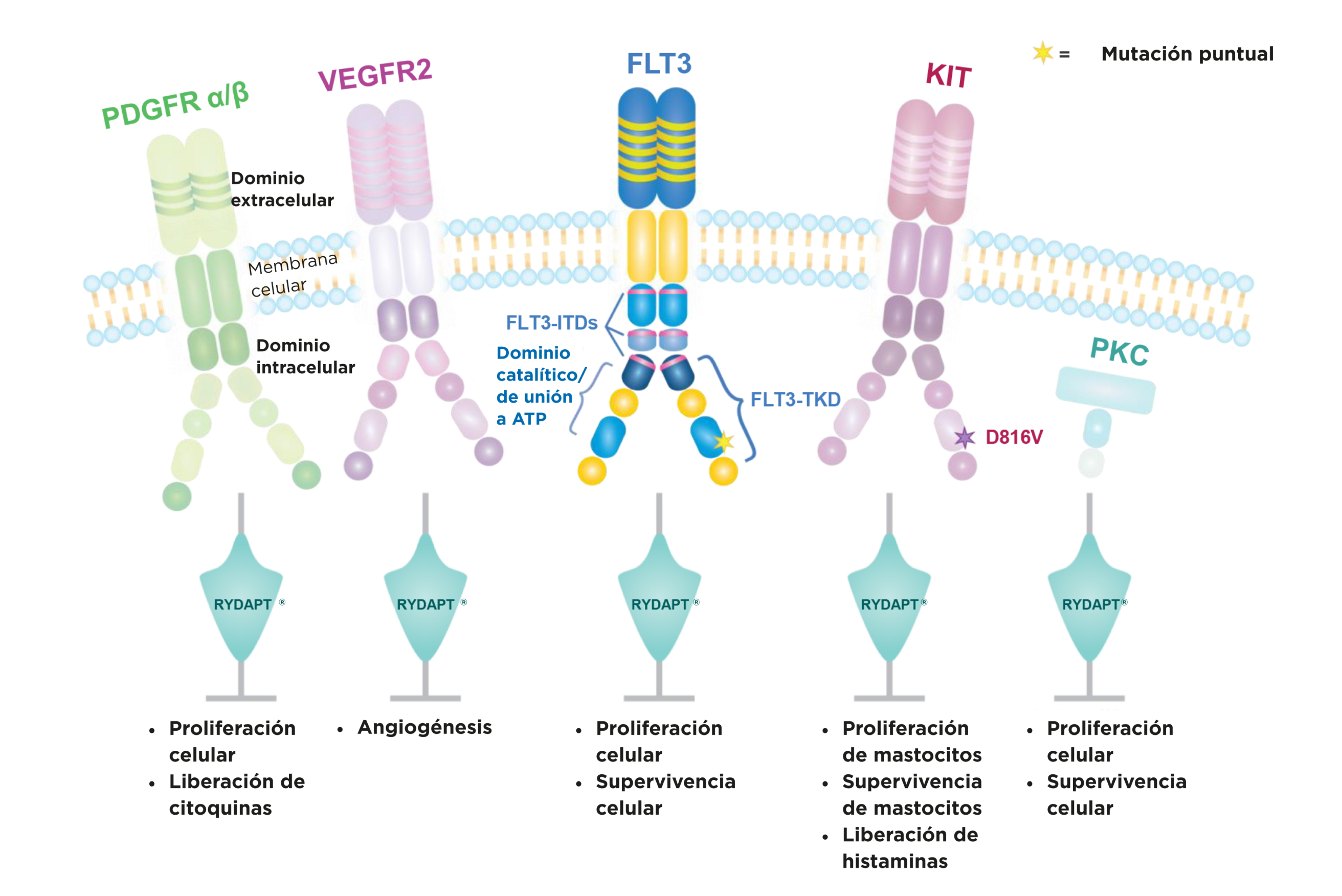
*Adaptado de la Ficha Técnica de Rydapt,1 Foss et al., 2011,2 Trujillo et al., 2012,3 Krause et al., 2005,4 Rattu et al., 2014,5 y Altman et al., 2003.6
 VIDEO
VIDEO