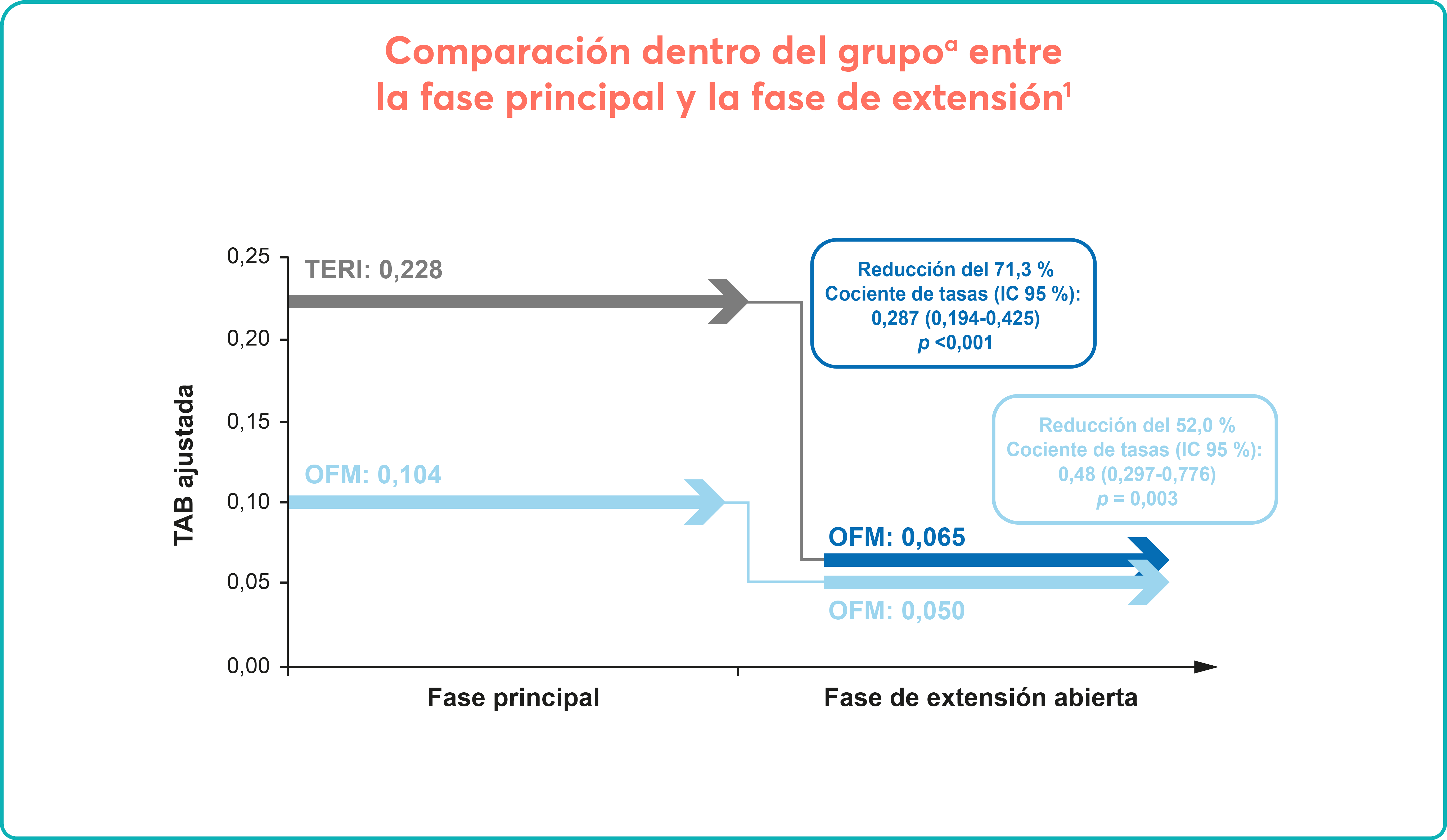
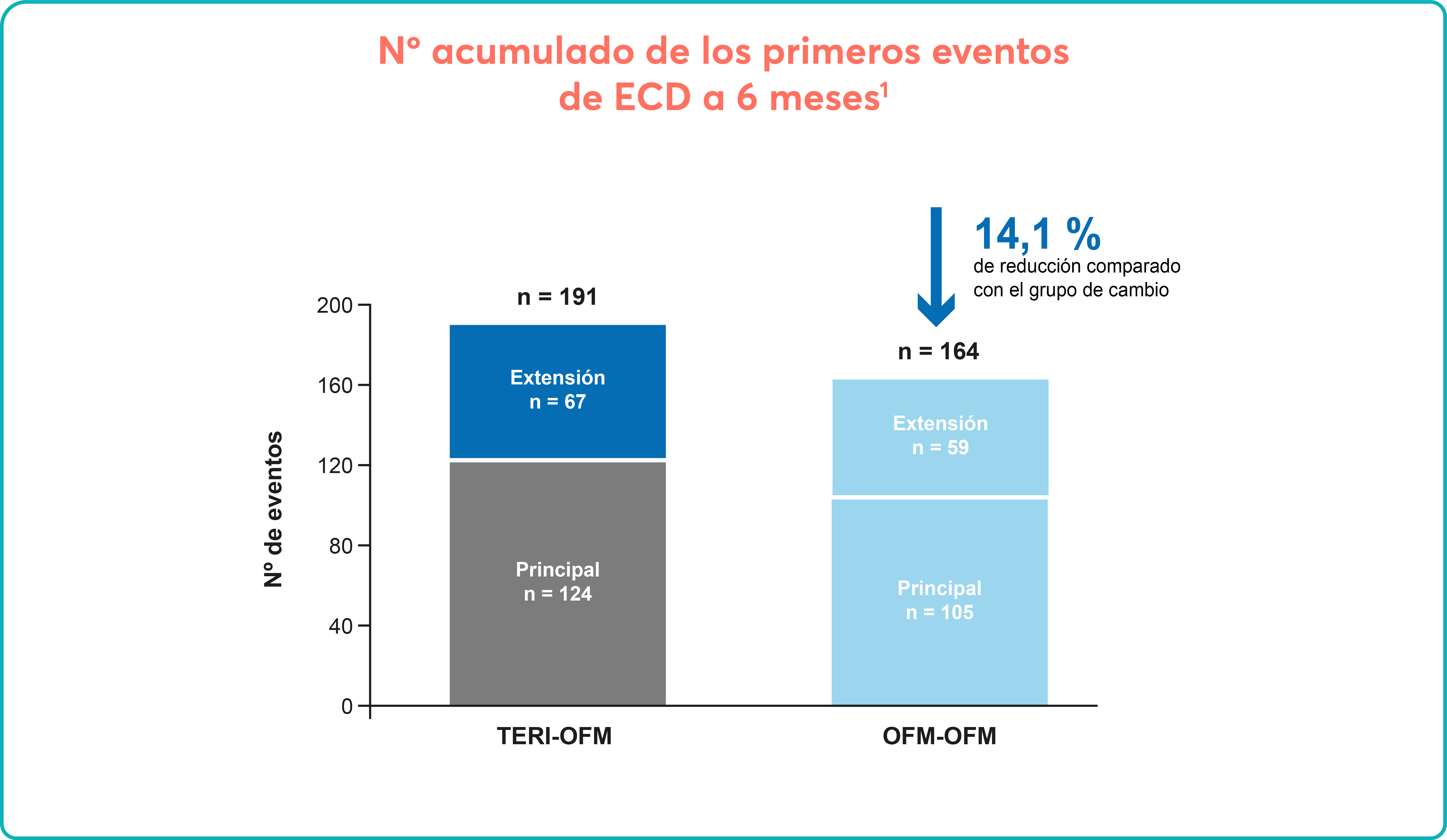
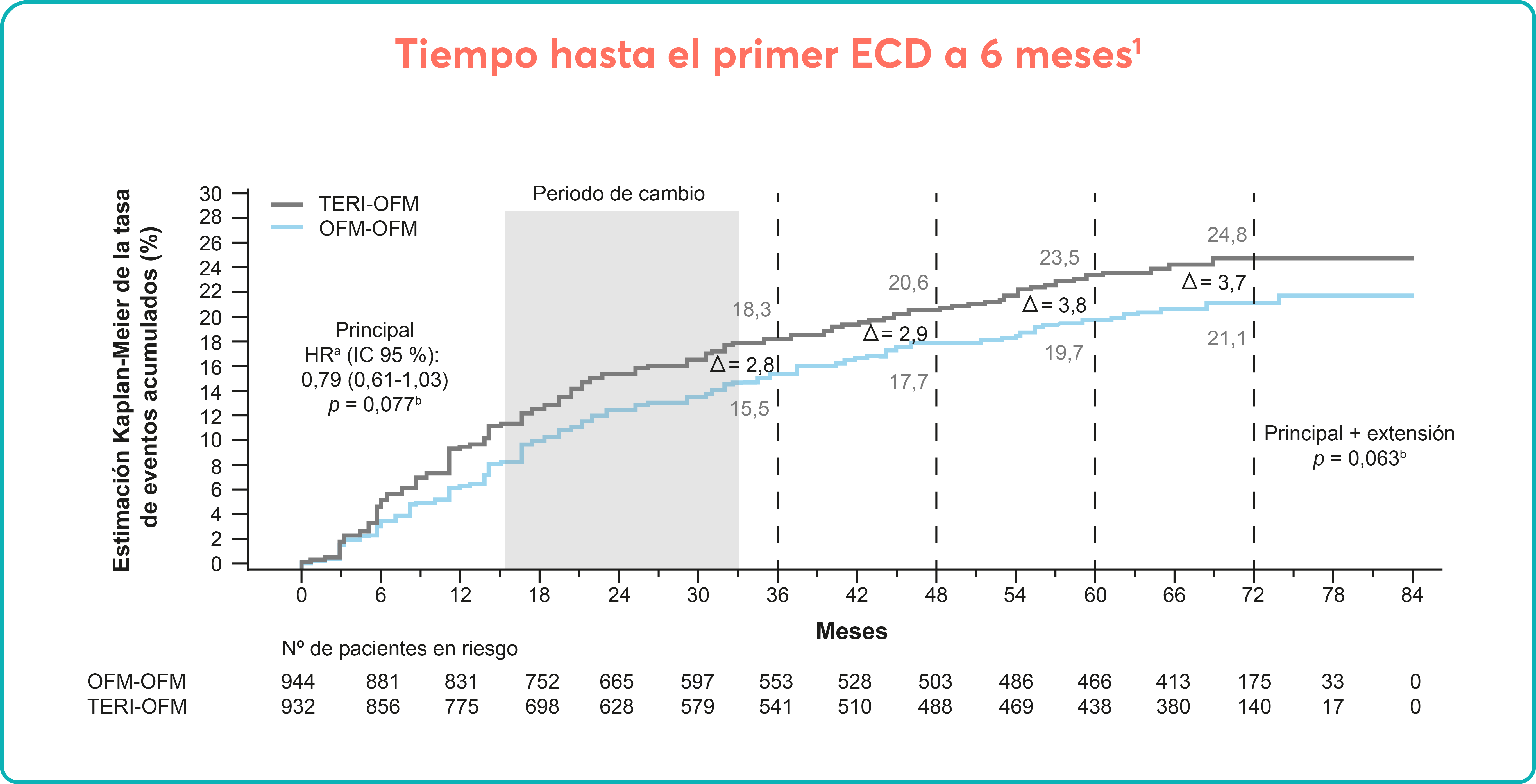
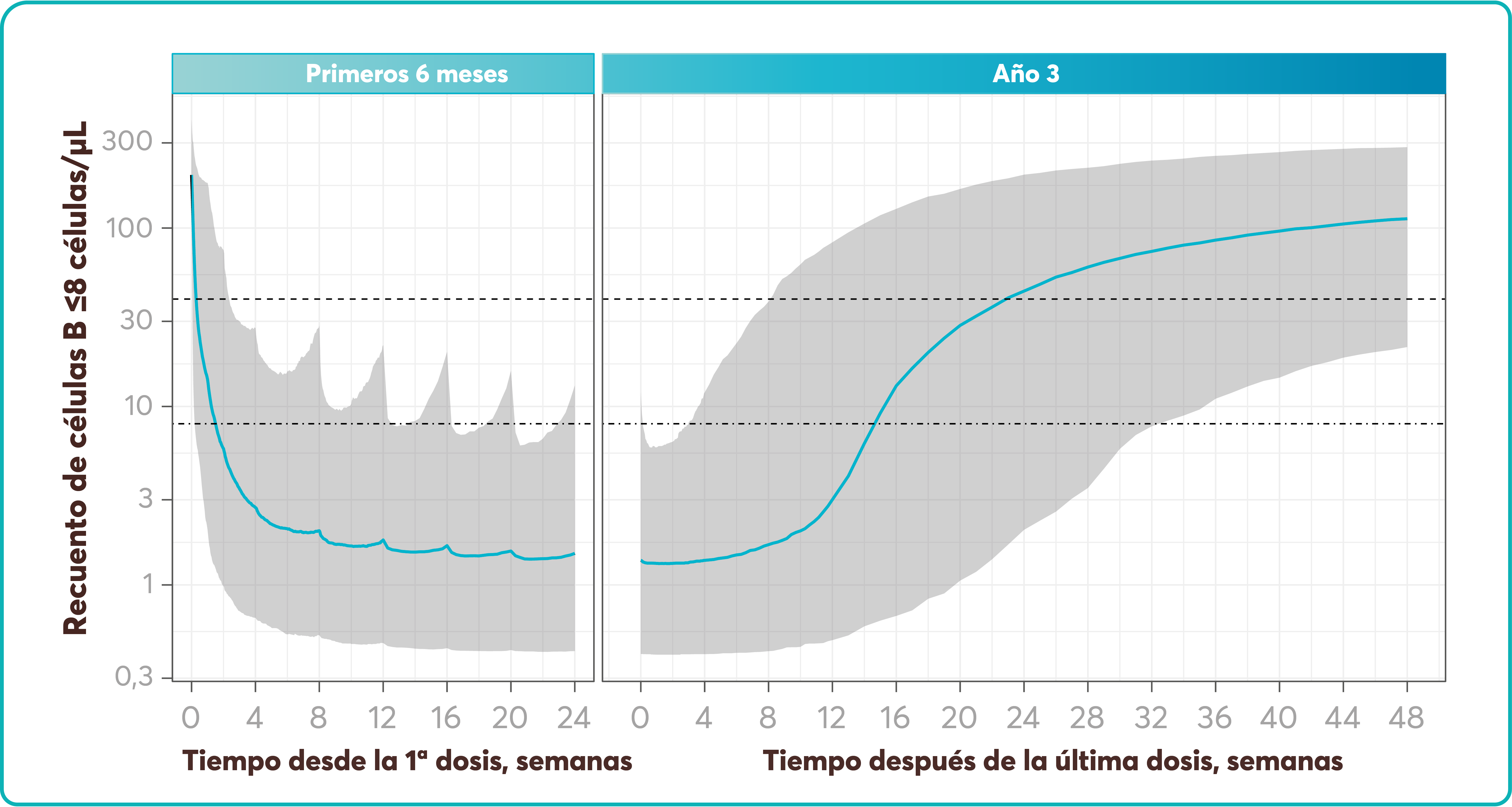
Sobre Aplasia medular grave
Carreras E, Dufour C, Mohty M, Kröger N, editors. The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies [Internet]. Capítulo 77: Severe Aplastic Anemia and PNH. 7th ed. Cham (CH): Springer; 2019.
Young NS, Kaufman DW. The epidemiology of acquired aplastic anemia. Haematologica. 2008;93:489–92.
Young NS, Calado RT, Scheinberg P. Current concepts in the pathophysiology and treatment of aplastic anemia. Blood. 2006 Oct 15;108(8):2509-19.
Carreras E, Dufour C, Mohty M, Kröger N, editors. The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies [Internet]. Capítulo 77: Severe Aplastic Anemia and PNH. 7th ed. Cham (CH): Springer; 2019.
Rovo A, et al. Current approach for the diagnosis of Aplastic Anemia. Curr Drug Targets. 2016;17:1.
Barone A, Lucarelli A, Onofrillo D, et al. Diagnosis and management of acquired aplastic anemia in childhood. Guidelines from the Marrow Failure Study Group of the Pediatric Haemato-Oncology Italian Association (AIEOP). Blood Cells Mol Dis. 2015;55:40–7.
Camitta BM, Thomas ED, Nathan DG, et al. Severe aplastic anemia: a prospective study of the effect of early marrow transplantation on acute mortality. Blood. 1976;48:63–70.
Carreras E, Dufour C, Mohty M, Kröger N, editors. The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies [Internet]. Capítulo 77: Severe Aplastic Anemia and PNH. 7th ed. Cham (CH): Springer; 2019.
Bacigalupo A, Boyd A, Slipper J, et al. Foscarnet in the management of cytomegalovirus infections in hematopoietic stem cell transplant patients. Expert Rev AntiInfect Ther. 2012;10:1249–64.
Peffault de Latour R. Transplantation for bone marrow failure: current issues. Hematology Am Soc Hematol Educ Program. 2016;2016(1):90–8.
Konopacki J, Porcher R, Robin M, et al. Long-term follow up after allogeneic stem cell transplantation in patients with severe aplastic anemia after cyclophosphamide plus antithymocyte globulin conditioning. Haematologica. 2012;97:710–6.
Marsh JC, Gupta V, Lim Z, et al. Alemtuzumab with fludarabine and cyclophosphamide reduces chronic graft-versus-host disease after allogeneic stem cell transplantation for acquired aplastic anemia. Blood. 2011;118:2351–7.
Scheinberg P, Nunez O, Weinstein B, et al. Horse versus rabbit antithymocyte globulin in acquired aplastic anemia. N Engl J Med. 2011;365:430–8.
Marsh JC, Bacigalupo A, Schrezenmeier H, et al. Prospective study of rabbit antithymocyte globulin and cyclosporine for aplastic anemia from the EBMT Severe Aplastic Anaemia Working Party. Blood. 2012;119:5391–6.
Peffault de Latour R, Tabrizi R, Marcais A, et al. Nationwide survey on the use of horse antithymocyte globulins (ATGAM) in patients with acquired aplastic anemia: A report on behalf of the French Reference Center for Aplastic Anemia. Am J Hematol. 2018;93:635–42.
Dufour C, Pillon M, Passweg J, et al. Outcome of aplastic anemia in adolescence: a survey of the Severe Aplastic Anemia Working Party ofthe European Group for Blood and Marrow Transplantation. Haematologica. 2014;99:1574–81.
Dufour C, Pillon M, Sociè G, et al. Outcome of aplastic anaemia in children. A study by the severe aplastic anaemia and paediatric disease working parties of the European group blood and bone marrow transplant. Br J Haematol. 2015a;169:565–73.
Scheinberg P, Young NS. How I treat acquired aplastic anemia. Blood. 2012;120:1185–96.
Carreras E, Dufour C, Mohty M, Kröger N, editors. The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies [Internet]. Capítulo 77: Severe Aplastic Anemia and PNH. 7th ed. Cham (CH): Springer; 2019.
Bacigalupo A, Boyd A, Slipper J, et al. Foscarnet in the management of cytomegalovirus infections in hematopoietic stem cell transplant patients. Expert Rev AntiInfect Ther. 2012;10:1249–64.
Peffault de Latour R. Transplantation for bone marrow failure: current issues. Hematology Am Soc Hematol Educ Program. 2016;2016(1):90–8.
Konopacki J, Porcher R, Robin M, et al. Long-term follow up after allogeneic stem cell transplantation in patients with severe aplastic anemia after cyclophosphamide plus antithymocyte globulin conditioning. Haematologica. 2012;97:710–6.
Marsh JC, Gupta V, Lim Z, et al. Alemtuzumab with fludarabine and cyclophosphamide reduces chronic graft-versus-host disease after allogeneic stem cell transplantation for acquired aplastic anemia. Blood. 2011;118:2351–7.
Scheinberg P, Nunez O, Weinstein B, et al. Horse versus rabbit antithymocyte globulin in acquired aplastic anemia. N Engl J Med. 2011;365:430–8.
Marsh JC, Bacigalupo A, Schrezenmeier H, et al. Prospective study of rabbit antithymocyte globulin and cyclosporine for aplastic anemia from the EBMT Severe Aplastic Anaemia Working Party. Blood. 2012;119:5391–6.
Peffault de Latour R, Tabrizi R, Marcais A, et al. Nationwide survey on the use of horse antithymocyte globulins (ATGAM) in patients with acquired aplastic anemia: A report on behalf of the French Reference Center for Aplastic Anemia. Am J Hematol. 2018;93:635–42.
Dufour C, Pillon M, Passweg J, et al. Outcome of aplastic anemia in adolescence: a survey of the Severe Aplastic Anemia Working Party ofthe European Group for Blood and Marrow Transplantation. Haematologica. 2014;99:1574–81.
Dufour C, Pillon M, Sociè G, et al. Outcome of aplastic anaemia in children. A study by the severe aplastic anaemia and paediatric disease working parties of the European group blood and bone marrow transplant. Br J Haematol. 2015a;169:565–73.
Scheinberg P, Young NS. How I treat acquired aplastic anemia. Blood. 2012;120:1185–96.
Referencias
Referencia
Referencias
Referencias