多発性硬化症の疾患機序
監修:東京女子医科大学 脳神経内科 特命担当教授 清水 優子 先生
- T細胞の関与: 末梢リンパ節において抗原提示細胞から自己抗原*の提示を受け活性化した自己反応性T細胞が中枢神経局所へ浸潤し、再度抗原提示を受け、炎症性サイトカインおよびケモカインを産生します。その結果、ミクログリア等の炎症細胞が動員され、髄鞘タンパクあるいはオリゴデンドロサイトを標的とした炎症性脱髄病巣が形成されます。(T細胞とMSのタブを参照)
(*)免疫応答の引き金となる自己抗原は同定されておらず、詳細な病態メカニズムは未だ明らかでない部分も多いです。 - B細胞の関与: B細胞は、T細胞へ自己抗原を提示するほか、中枢神経局所へ浸潤し自己抗体や炎症性サイトカイン等を産生することで病態を進展させると考えられています。(B細胞とMSのタブを参照)
オリゴデンドロサイトを標的とした自己免疫応答により脱髄病巣が形成され、さらに神経軸索の変性が生じます
1.脱髄病巣の形成
多発性硬化症(MS)の脱髄病巣の形成には、自己反応性T細胞やB細胞が中心的な役割を担っています1-4)。
2.神経軸索の変性
MSにおける神経軸索の変性は、末梢免疫系から独立している中枢に局在する炎症(ミクログリアの活性化等)により生じると考えられています。活性化ミクログリアにより炎症性サイトカインや酸化ストレスが惹起され神経細胞を破壊するほか、ミトコンドリア機能異常が軸索輸送の障害を引き起こし、ひいては神経細胞死を誘導すると考えられています。(中枢に局在する炎症のタブを参照)
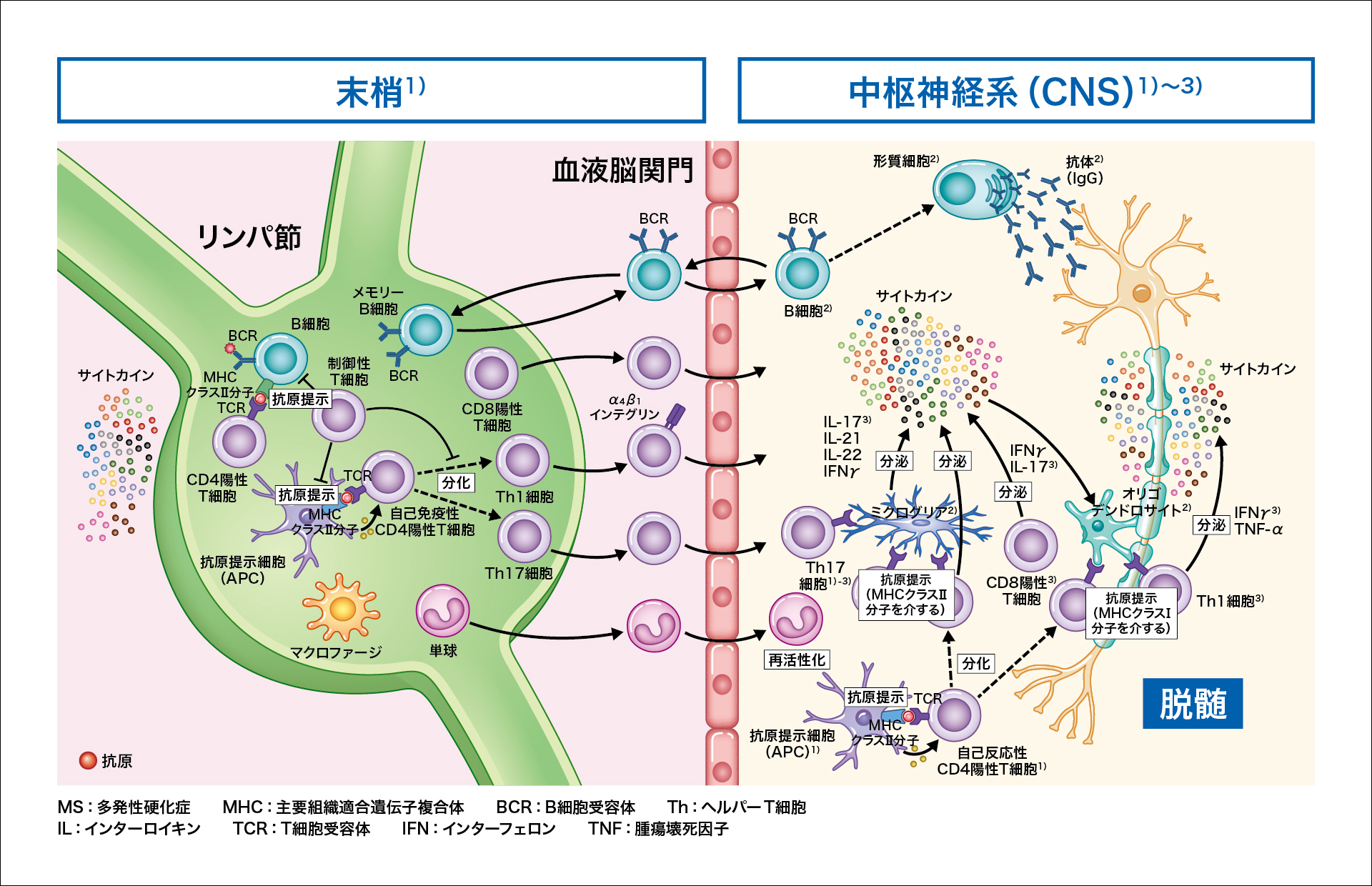
図1:MSの病態メカニズム1-3)
1)Dendrou C et al:Nat Rev Immunol 15(9): 545-558, 2015
2)Hemmer B et al:Nat Rev Neurosci 3(4): 291-301, 2002
3)Baecher-Allan C et al : Neuron 97(4): 742-768, 2018
【Reference】
1)Dendrou C et al:Nat Rev Immunol 15(9): 545-558, 2015
2)Hemmer B et al:Nat Rev Neurosci 3(4): 291-301, 2002
3)Baecher-Allan C et al : Neuron 97(4): 742-768, 2018
4)日本神経学会 監修 『多発性硬化症・視神経脊髄炎診療ガイドライン2017』 医学書院 p4-5、p26-27、2017年
T細胞が中枢神経系に侵入することで、サイトカインの分泌、炎症細胞の活性化が生じ、炎症性脱髄病巣が形成されます
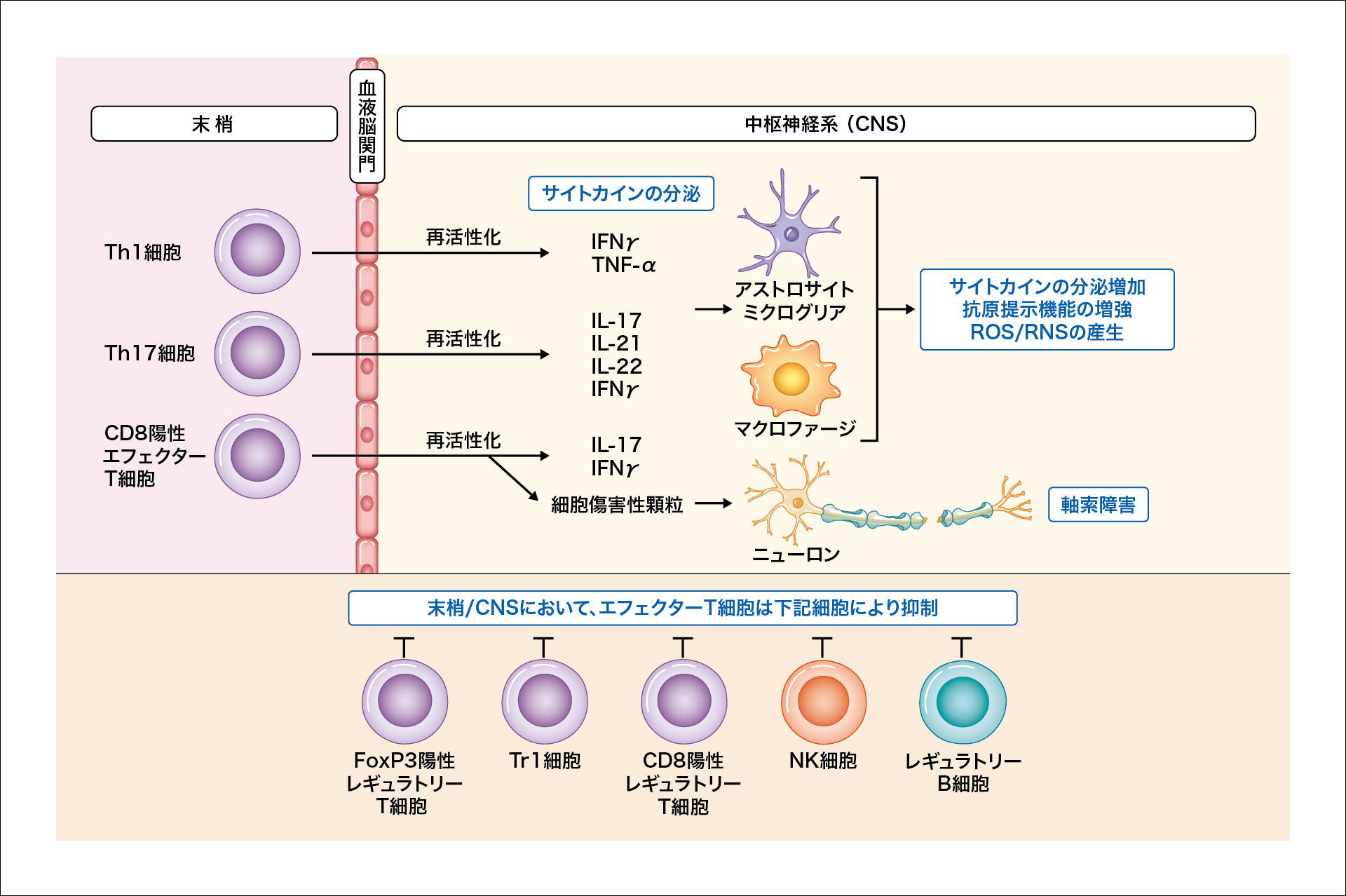
多発性硬化症(MS)病態において、T細胞(主にTh1細胞、Th17細胞、CD8陽性エフェクターT細胞)は、末梢で抗原提示を受けて活性化し、血液脳関門を通過して中枢神経系に侵入して再活性化し、インターフェロン(IFN)γやインターロイキン(IL)-17などの炎症性サイトカインを分泌します(図1)。その結果、ミクログリアやマクロファージ、アストロサイトが活性化し、炎症性サイトカインの分泌増加、抗原提示機能の増強、活性酸素種(ROS)や活性窒素種(RNS)が産生されます(図1)2)。炎症性サイトカインやケモカインの産生により、ミクログリアやマクロファージなどの炎症細胞が動員され、炎症性脱髄病巣が形成されます1)。
そのほか、CD8陽性エフェクターT細胞は、中枢神経CNS内で再活性化されると細胞傷害性顆粒を放出して、軸索障害を引き起こします(図1)2)。
また、レギュラトリーT細胞やレギュラトリーB細胞、Tr細胞、ナチュラルキラー(NK)細胞などの関与も報告されています(図1)2)。
図2:MS病態に対するT細胞の関与2)
2)Baecher-Allan C et al:Neuron 97(4): 742-768, 2018
【Reference】
1)日本神経学会 監修 『多発性硬化症・視神経脊髄炎診療ガイドライン2017』 医学書院 p26-27 2017年
2)Baecher-Allan C et al:Neuron 97(4): 742-768, 2018
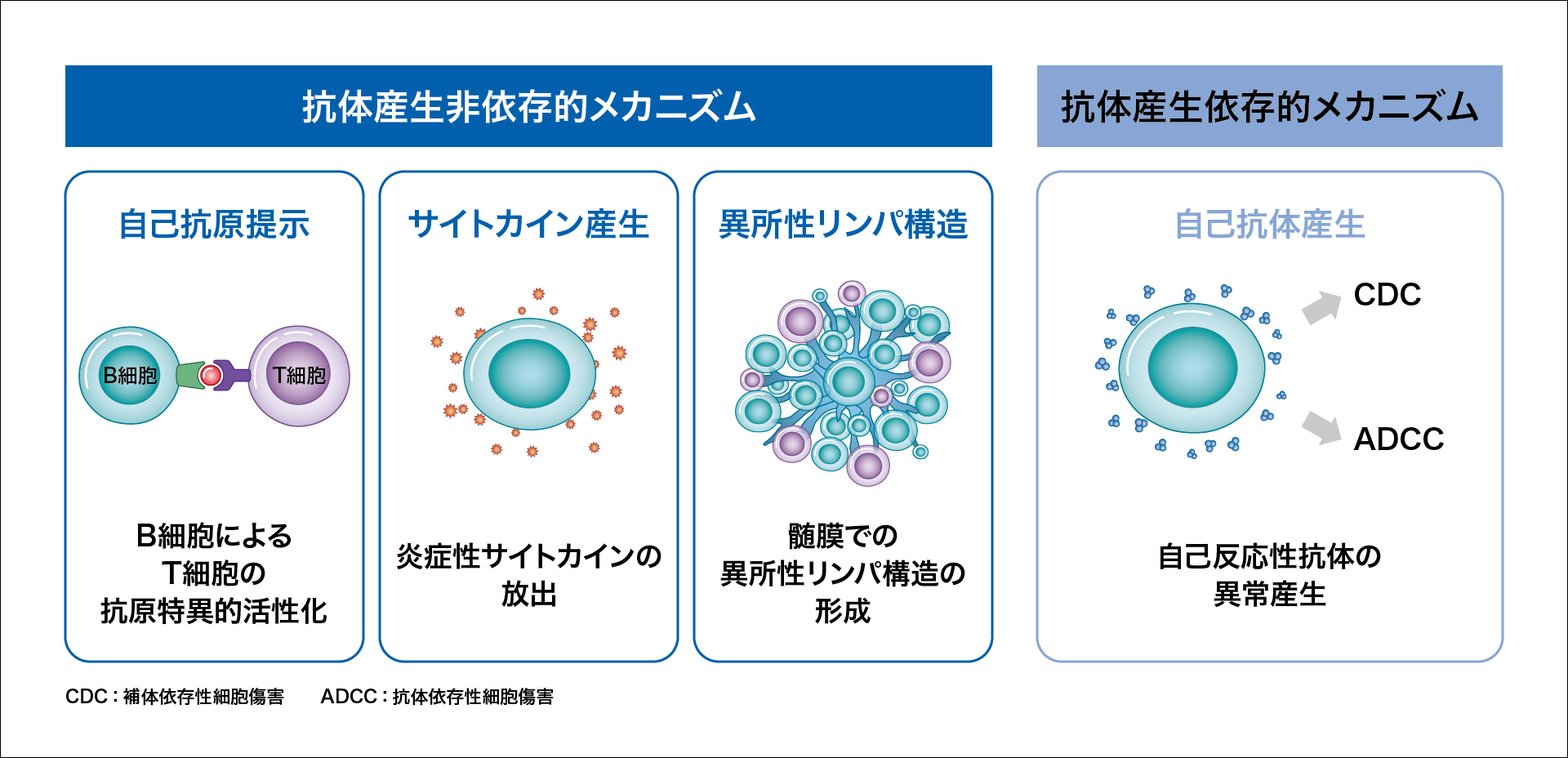
B細胞は、T細胞へ自己抗原を提示するほか、中枢神経局所へ浸潤し自己抗体や炎症性サイトカイン等を産生することで病態を進展させると考えられています
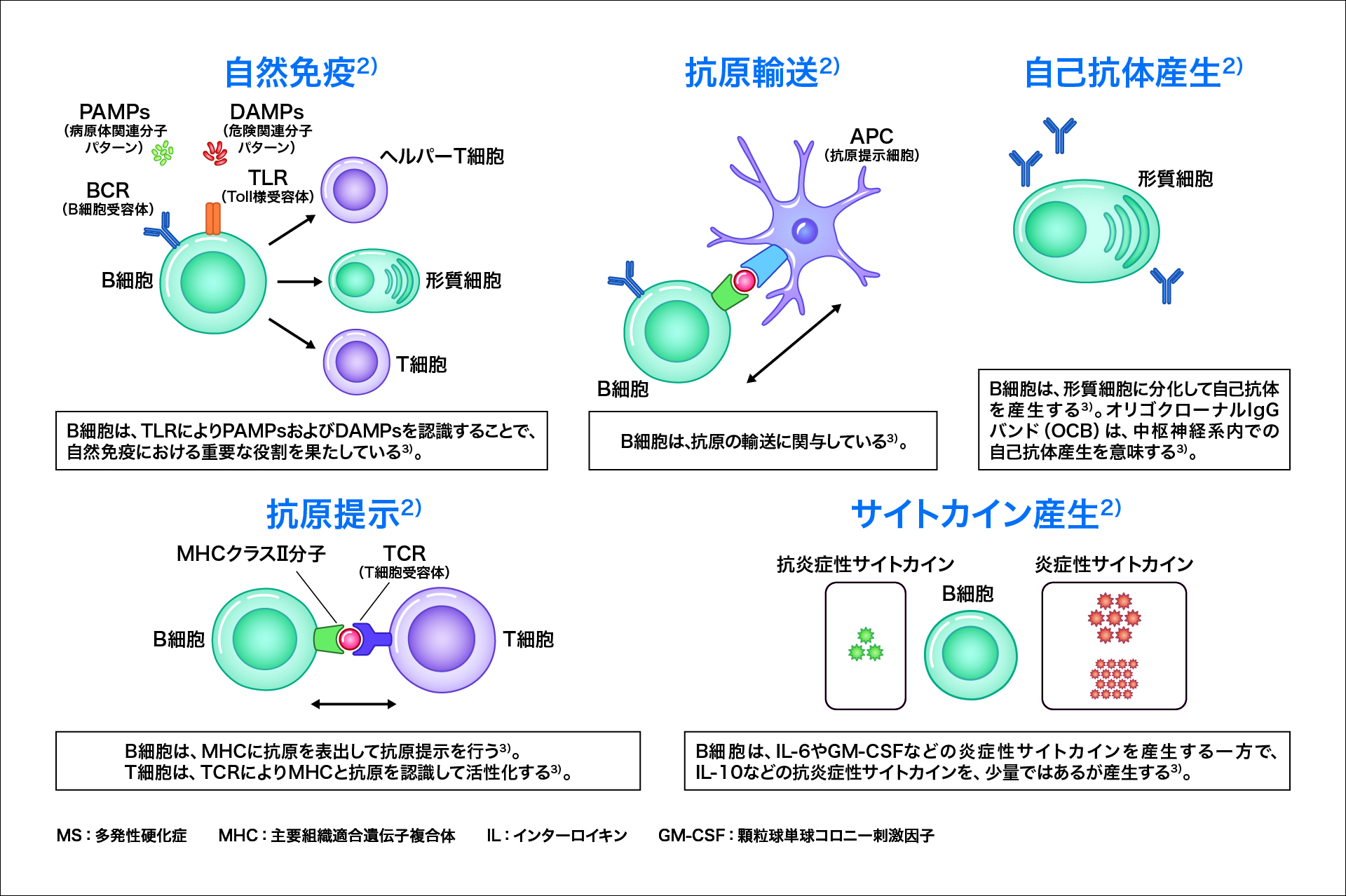
MS病態において、B細胞は、MHCクラスⅡ分子を介してT細胞に「抗原提示」を行い、CD4陽性T細胞を活性化します3)。また、形質細胞に分化して自己反応性の抗体を産生し、補体を活性化させて組織損傷を引き起こすことで「抗体産生」の働きを担っています(図2)3)。
さらに、「炎症性サイトカイン」〔腫瘍壊死因子(TNF)-α、IL-6、顆粒球マクロファージコロニー刺激因子(GM-CSF)など〕を分泌して中枢神経系の炎症を促進するほか、髄膜でリンパ濾胞様の「異所性胚中心」を形成してB細胞の抗原特異的な刺激・増殖・成熟を持続的にもたらす4)という作用も報告されています(図3)1)。
MS病態下では、IL-10などの抗炎症性サイトカインを介してエフェクターT細胞の作用を調節しているレギュラトリーB細胞が機能障害に陥っていると考えられています3)。
図3:MS病態に対するB細胞の関与2,3)
2)Comi G et al:Ann Neurol 89(1): 13-23, 2021
著者には、過去にノバルティスがコンサルタント料、講演料などを支払った者、
過去にアドバイザリーボードに参加した者などが含まれています。
3)Pröbstel AK et al:J Neuroophthalmol 38(2): 251-258, 2018
図4:MS病態に対するB細胞の関与4)
4)Dalakas MC:Nat Clin Pract Neurol 4(10): 557-567, 2008より作図
【Reference】
1)日本神経学会 監修 『多発性硬化症・視神経脊髄炎診療ガイドライン2017』 医学書院 p26-27 2017年
2)Comi G et al:Ann Neurol 89(1): 13-23, 2021
著者には、過去にノバルティスがコンサルタント料、講演料などを支払った者、過去にアドバイザリーボードに参加した者などが含まれています。
3)Pröbstel AK et al:J Neuroophthalmol 38(2): 251-258, 2018
4)Dalakas MC:Nat Clin Pract Neurol 4(10): 557-567, 2008
末梢免疫系から独立している中枢に局在する炎症(ミクログリアの活性化等)が、神経細胞死や軸索障害に関与しています
慢性進行期には、MRIで病巣として観察されない白質での変化や皮質病巣の進行が観察されます。これらの病巣ではリンパ球の浸潤は乏しく活性化ミクログリアが観察されることから、中枢神経内でのミクログリアの活性化が、神経細胞死や軸索障害に関与していると考えられます1,3,4)。活性化ミクログリアは、腫瘍壊死因子(TNF)-αなどの炎症性サイトカインのみならず、一酸化窒素や活性酸素種を産生し酸化ストレスを惹起します。惹起された酸化ストレスは直接的に神経細胞を破壊するほか、ミトコンドリア機能異常を引き起こす結果、軸索輸送の障害、ひいては神経細胞死を誘導すると考えられています5)。
図5:中枢に局在する炎症(Compartmentalized inflammation)
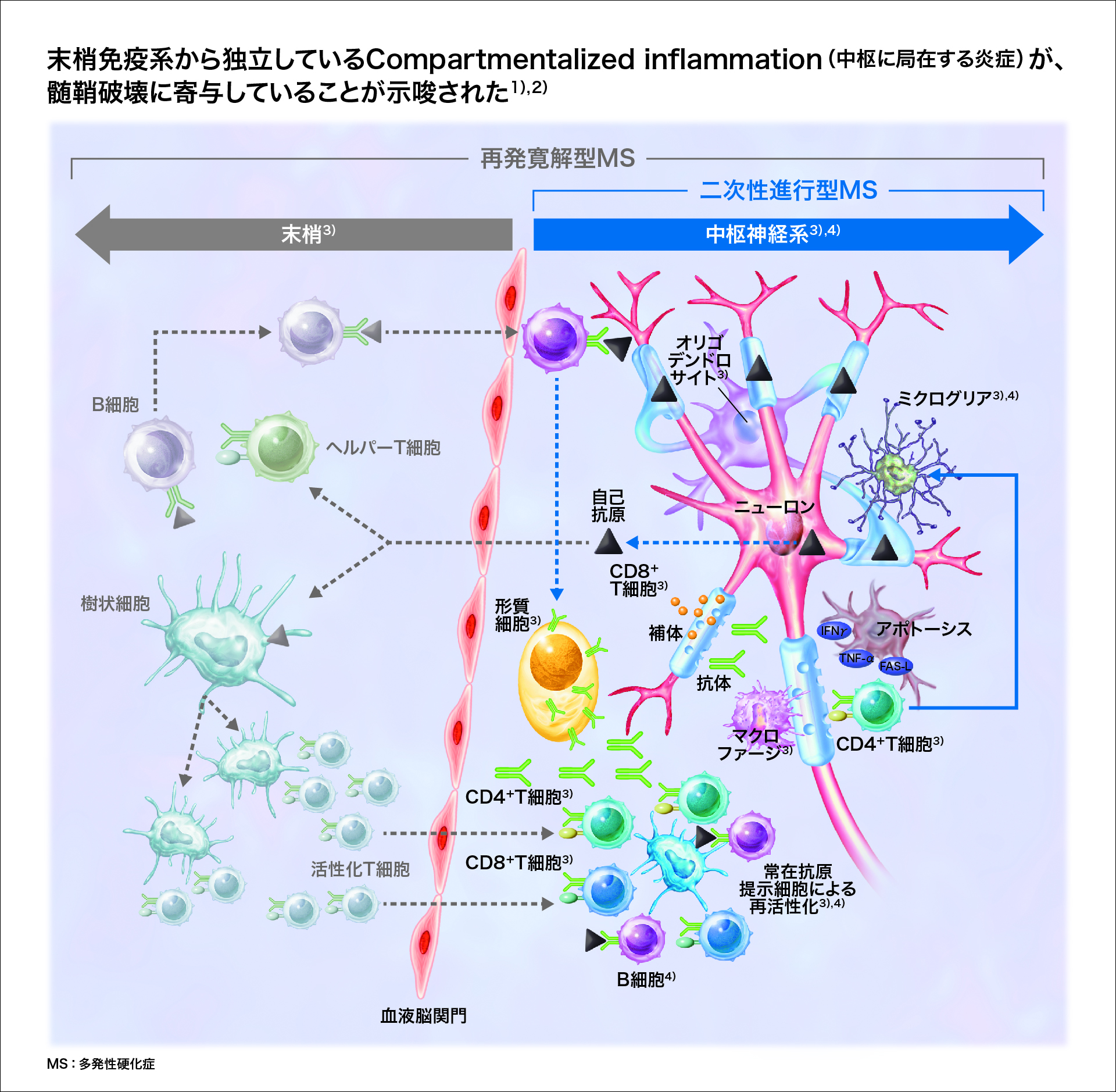
3)Bar-Or A:Semin Neurol 28(1): 29-45, 2008
4)El Behi M, et al:Immunol Lett 96(1): 11-26, 2005
【Reference】
1)日本神経学会 監修 『多発性硬化症・視神経脊髄炎診療ガイドライン2017』 医学書院 p26-27 2017年
2)Baecher-Allan C et al:Neuron 97(4): 742-768, 2018
3)Bar-Or A:Semin Neurol 28(1): 29-45, 2008
4)El Behi M, et al:Immunol Lett 96(1): 11-26, 2005
5)Nikic I, et al:Nat Med 17(4): 495-499, 2011