ルタテラ 臨床成績
「警告・禁忌を含む注意事項等情報」等は電子添文をご参照ください。
|
国内第Ⅰ相試験:P-1515-11試験1)
1)承認時評価資料:国内第Ⅰ相試験(P-1515-11試験)
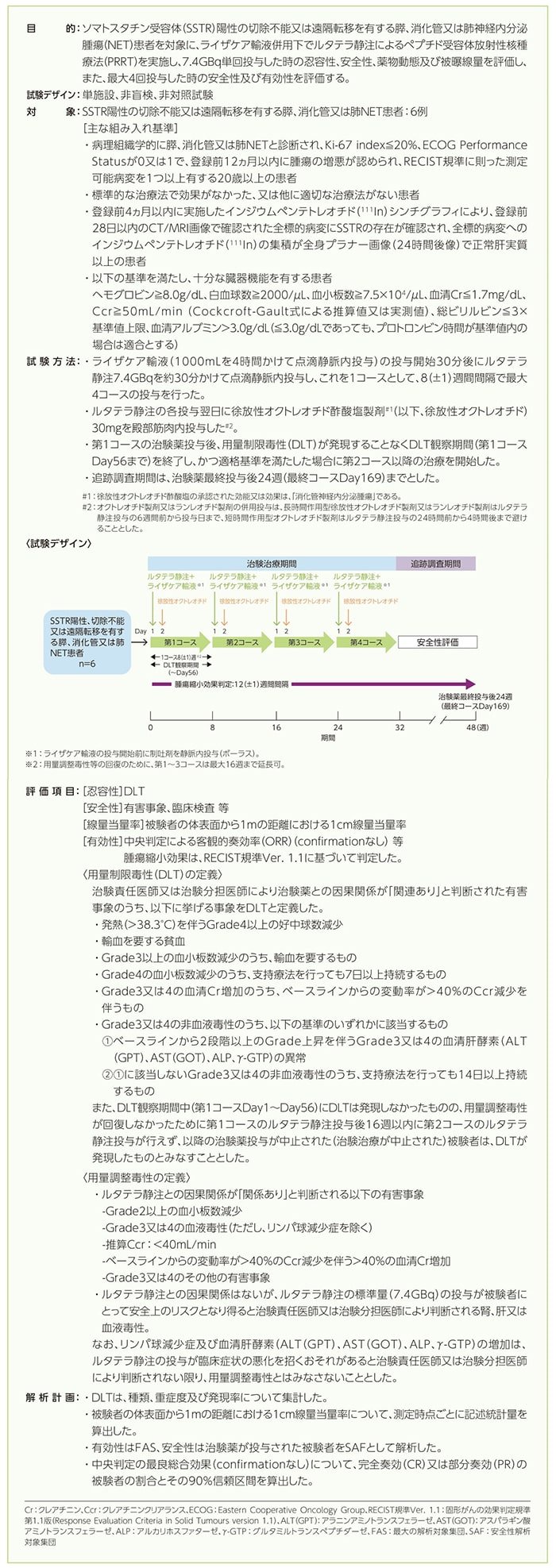
患者背景(FAS)
年齢(カテゴリー別を除く)及びBMIは平均値±標準偏差、初回のNET診断/転移診断から登録までの期間は中央値(最小値, 最大値)、その他は例数で示した。
a)複数回答
BMI:体格指数
忍容性:用量制限毒性
ライザケア輸液併用下でルタテラ静注を単回投与した時、いずれの被験者も用量制限毒性(DLT) 観察期間中にDLTの発現は認められず、「忍容性あり」と評価されました。
安全性
- 副作用
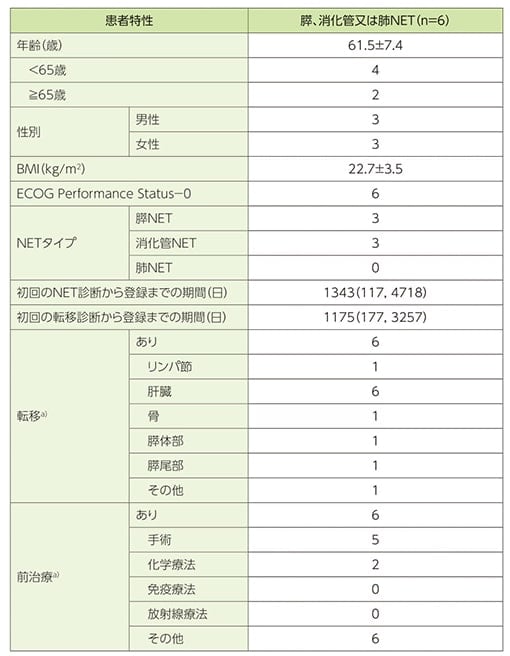
ルタテラ静注を最大4回投与した時、治験薬が関連すると判定された副作用(ルタテラ静注及び不明を含む)は6例中6例に認められました。ルタテラ静注によると判定された副作用は5例であり、主な副作用(2例以上)は、リンパ球減少症及び脱毛症各3例、白血球減少症、血小板減少症、悪心及び倦怠感各2例でした。
副作用一覧a)(SAF)
MedDRA/J ver.23.0
a)副作用は、有害事象の発生と治験薬との因果関係について、時間的関連性がある、治験薬投与中止による消失、治験薬投与再開による再発、正確な既往歴の裏づけから説明可能、他に説明できる原因がない、その他、治験責任医師又は治験分担医師による判断の根拠に基づいて判定した。
b)関連すると思われる治験薬(ルタテラ静注、ライザケア輸液)が判断できない場合、「不明」と判定した。
- 有害事象
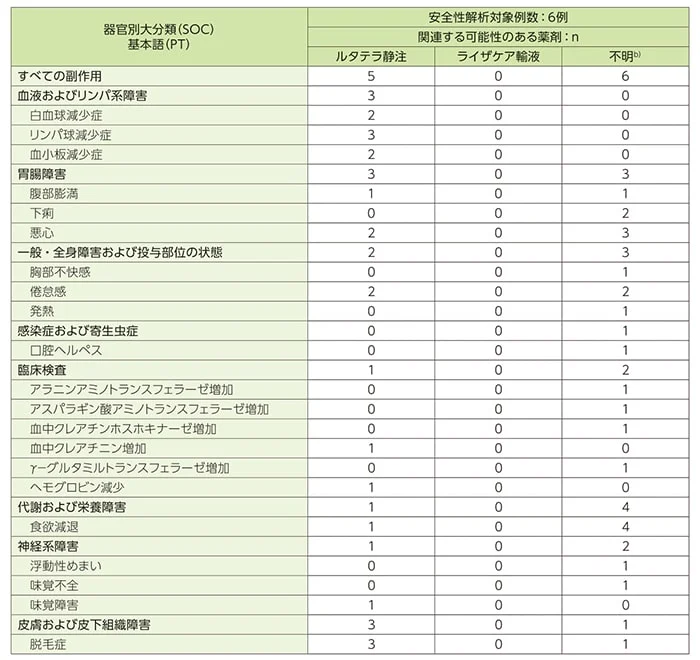
重症度がGrade3以上と判定された有害事象はGrade3のリンパ球減少症2例(ルタテラ静注との因果関係あり)であり、Grade4及び5の有害事象は認められませんでした。
本試験において、死亡、重篤及び治験の中止に至った有害事象は認められませんでした。
また、DLT及び用量調整毒性に該当する有害事象も認められませんでした。
有害事象一覧(重症度別)(SAF)
MedDRA/J ver.23.0
線量当量率:被験者の体表面から1mの距離における1cm線量当量率
ライザケア輸液併用下でルタテラ静注を単回投与した時、被験者の体表面から1mの距離における1cm線量当量率(平均値±標準偏差)は、投与後2時間で27.58±3.84μSv/hとなり、その後Day2(投与終了後24時間(±4時間))で6.53±1.12μSv/h(最大値8.40μSv/h)、Day7で2.11±1.11μSv/h(最大値4.00μSv/h)となりました。
1mの距離における1cm線量当量率
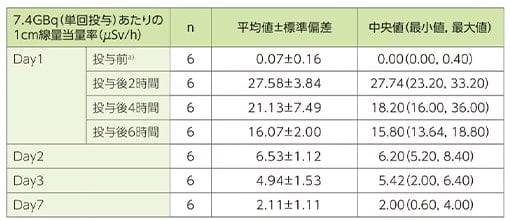
a)ライザケア輸液投与前
有効性評価項目:中央判定による客観的奏効率(ORR)(confirmationなし)
膵又は消化管NET患者6例の中央判定による最良総合効果は、PRが4例、SDが1例及びPDが1例であり、客観的奏効達成例は4例でした。
中央判定による最良総合効果及びORR(confirmationなし)(FAS)
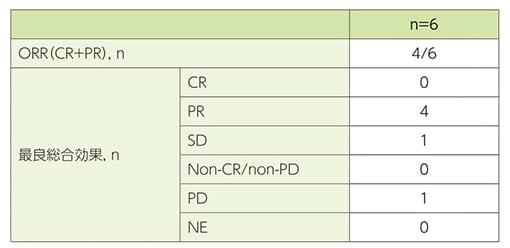
ORRはCR+PRの患者の割合とした。
CR:完全奏効、PR:部分奏効、SD:安定、PD:進行、NE:評価不能
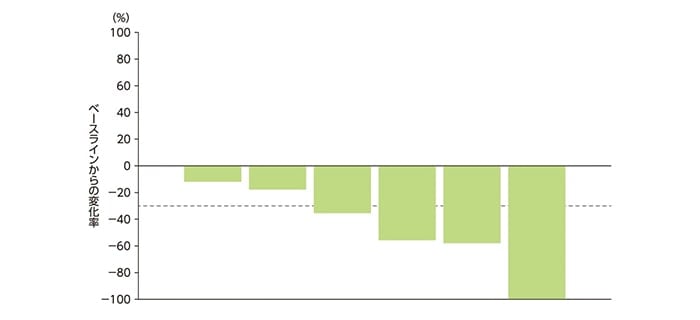
中央判定での標的病変の径和(最小値)のベースラインからの縮小率は下図の通りでした(新病変が出現したためPDと判定された1例を含む)。
中央判定での標的病変の径和の縮小率を示したWaterfall plot
〈参考〉標的病変の効果判定規準
CR:すべての標的病変の消失。リンパ節病変はすべて、短径で10mm未満に縮小している。PR:ベースライン径和と比べ、標的病変の径和が30%以上減少。SD:経過中の最小の径和と比べ、PRに相当する縮小がなく、PDに相当する増大がない。PD:経過中の最小の径和(ベースライン径和が経過中の最小値である場合、これを最小の径和とする)と比べ、標的病変の径和が20%以上増加、かつ、径和が絶対値でも5mm以上増加。1つ以上の新病変の出現もPDとなる。