ルセンティス 臨床成績に関して
本剤は日本人を含む国際共同第Ⅲ相臨床試験成績を基に評価され国内承認されました。 以下で紹介する臨床試験成績には、承認範囲外の試験成績が一部含まれています。
ルセンティス0.1mg群の試験成績は承認された用法・用量の範囲外のため、患者背景、有効性及び安全性に関する試験成績からは削除しました。
| 「禁忌を含む使用上の注意」はこちらをご参照ください。 |
レーザー光凝固療法を対照とした第Ⅲ相臨床試験
(RAINBOW試験)#
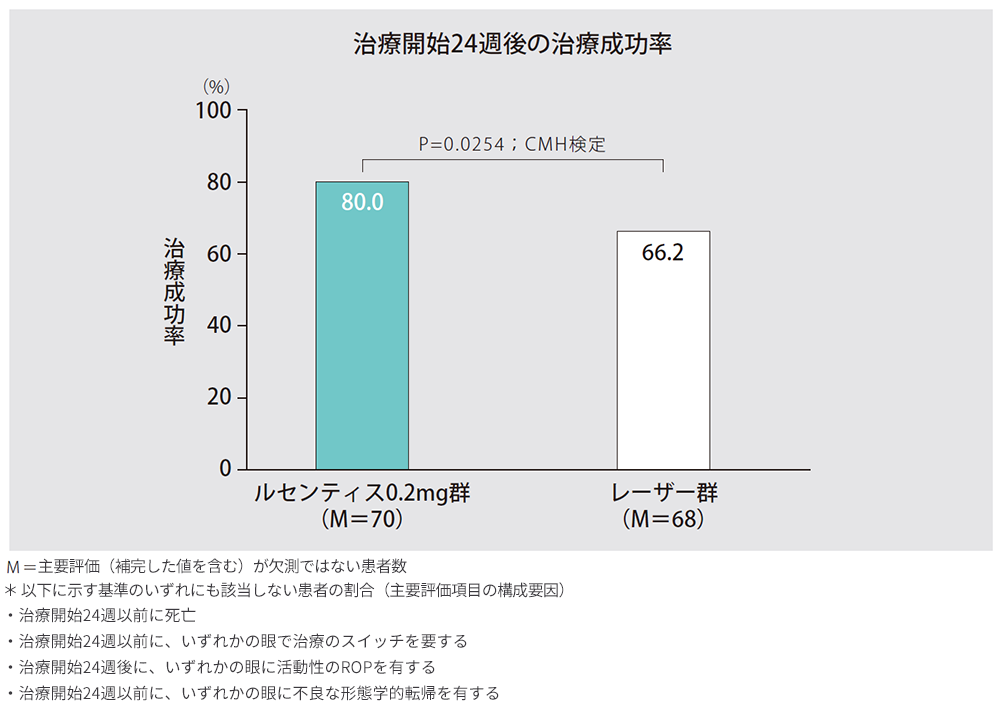
1. 治療開始24週後の治療成功率*
1)全患者(主要評価項目)
治療開始24週後の治療成功率は、ルセンティス0.2mg群で80.0%(56/70例)、レーザー群で66.2%(45/68例)でした。ルセンティス0.2mg群とレーザー群のオッズ比は2.19(95%信頼区間:0.9932、4.8235)でした。レーザー群に対するルセンティス0.2mg群の統計学的な有意差は認められず、優越性は検証されませんでした(片側p=0.0254、Cochran-Mantel-Haenszel検定)。
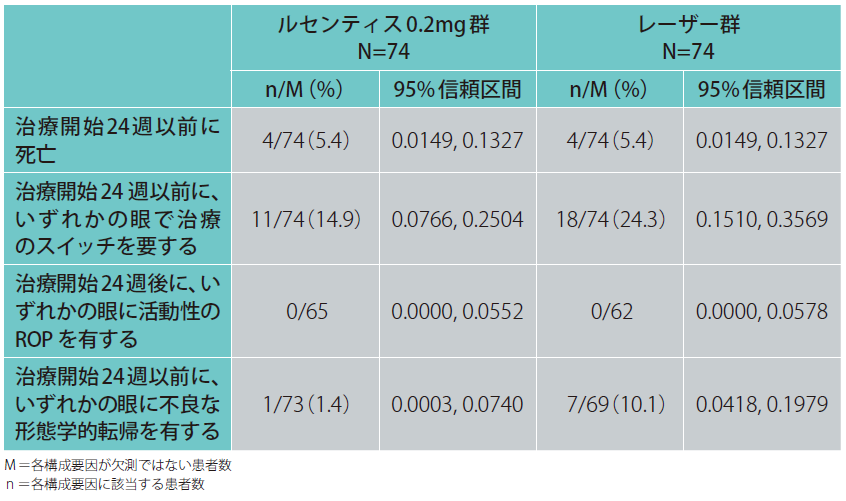
2. 主要評価項目の各構成要因に該当した患者の割合
1)全患者(副次評価項目)
ルセンティス0.2mg群では、治療開始24週以前に死亡した患者は5.4%(4/74例)、治療開始24週以前に、いずれかの眼で治療のスイッチを要すると判断された患者は14.9%(11/74 例)、治療開始24週後に、いずれかの眼に活動性のROPを有する患者は0%(0/65例)、治療開始24週以前に、いずれかの眼に不良な形態学的転帰が認められた患者は1.4%(1/73例)でした。
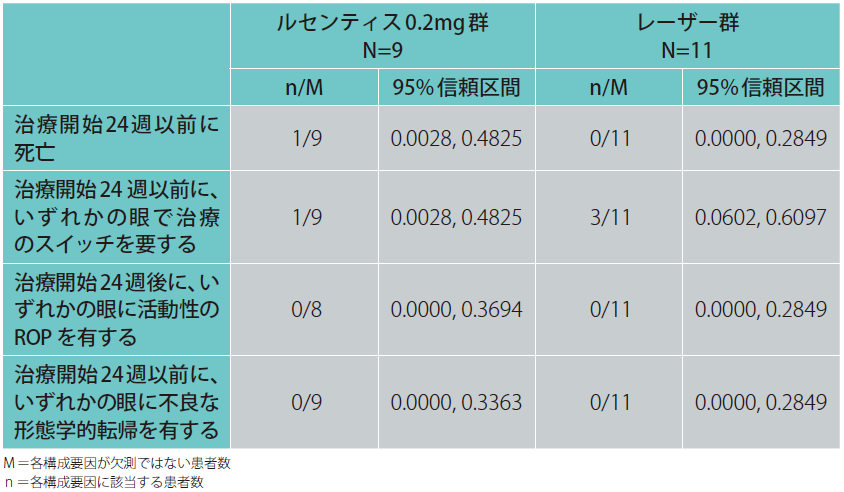
2)日本人患者(サブグループ解析結果)
日本人患者におけるルセンティス0.2mg群の治療開始24週以前に死亡した患者は9例中1例、治療開始24週以前に、いずれかの眼で治療のスイッチを要すると判断された患者は9例中1例でした。治療開始24週後に、いずれかの眼に活動性のROPを有する患者及び、治療開始24週以前に、いずれかの眼に不良な形態学的転帰が認められた患者はいませんでした。
3. ROPの再発率(副次評価項目)
ROPの再発率*は、ルセンティス0.2mg群では31.1%(23/74例)、レーザー群では、18.9%(14/74名)でした。
*初回治療以外の治療(ルセンティス0.2mg群及び0.1mg群ではルセンティスの再投与又はレーザー光凝固療法、レーザー群では、ルセンティス0.2mgを投与)を治療開始24週以前に実施した患者と定義した。
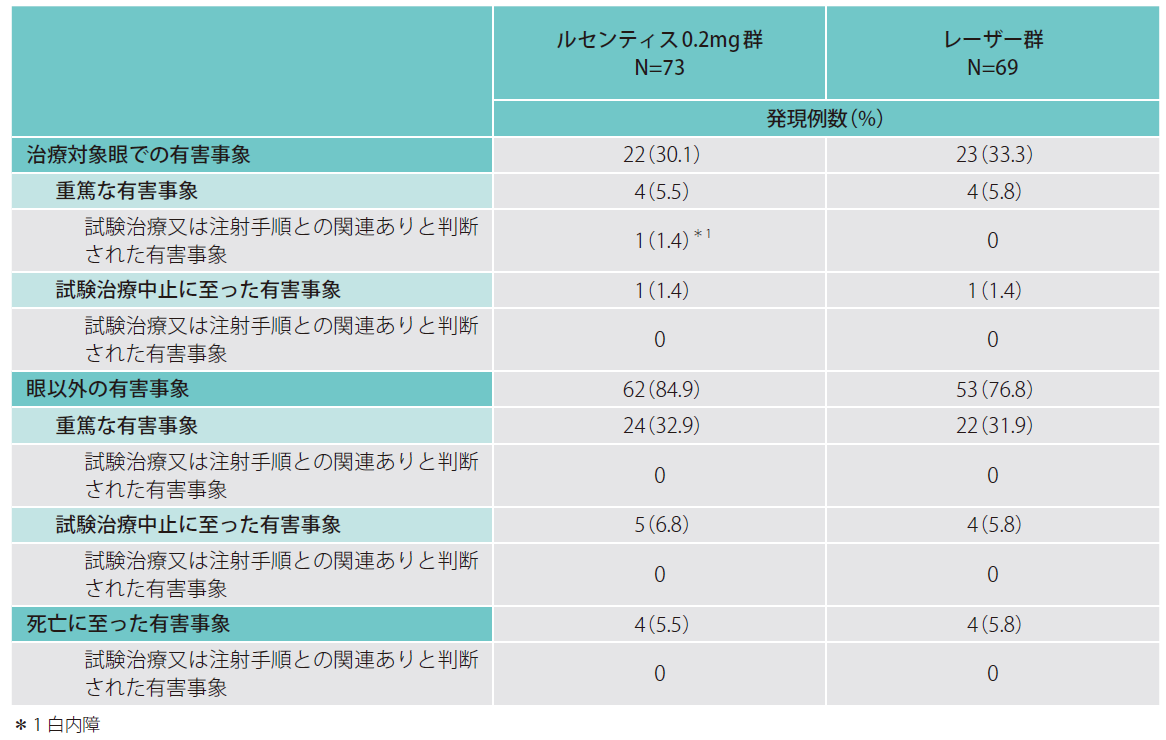
4. 安全性(副次評価項目)
- 副作用
本試験において、ルセンティス0.2㎎群では73例中11例(15.1%)、レーザー群では69例中6例(8.7%)に副作用が認められました。主な副作用はいずれの治療群も結膜出血で、ルセンティス0.2㎎群で6例(8.2%)、レーザー群で2例(2.9%)でした。死亡例は、ルセンティス0.1㎎群で呼吸不全が1例認められました。本試験において、ルセンティス0.2㎎群及びレーザー群で眼以外の副作用は認められませんでした。 - 有害事象発現率
試験方法
| 目 的 | 未熟児網膜症(ROP)患者(日本人を含む)を対象に、「治験担当医師の評価で、治療開始24週後に両眼ともに活動性のROPがなく、かつ不良な形態学的転帰もない患者の割合」を指標として、レーザー光凝固療法に対するルセンティス0.2mg硝子体内注射の優越性を検証した。 |
| 試験対象 | 両眼性のROPを有し、各眼に網膜所見を有する患者*1 225例(ルセンティス0.2mg群:74例、ルセンティス0.1mg群*2:77例、レーザー群:74例) |
| 試験デザイン | 第Ⅲ相、多施設共同、ランダム化、非遮蔽、レーザー光凝固療法対照、並行群間比較、優越性検証試験 |
| 投与方法 | 対象をルセンティス0.2mg群、ルセンティス0.1mg群*2、又はレーザー群のいずれかに1:1:1で層別ランダム化し、以下の治療を実施した。治療期(1日目)に治療を開始し、初回治療後から試験終了までをフォローアップ期(24週間)とした。 †治療スイッチの基準
|
| 主要評価項目 | 治験担当医師の評価で、治療開始24週後に両眼ともに活動性のROP*4がなく、かつ不良な形態学的転帰*5もない患者の割合(以下、治療成功率)*6*7 |
| 副次評価項目 |
|
| PK/PD評価項目 | 血清中ラニビズマブ濃度、血漿中VEGF濃度 |
| 解析計画 | 有効性の解析は、Full Analysis Ser(FAS)集団を対象に実施した。主要評価項目の主要解析は、主要目的(ルセンティス0.2mgとレーザー光凝固療法との比較)及び2つの主要な副次目的(ルセンティス0.1mgとレーザー光凝固療法、及びルセンティス0.2mgとルセンティス0.1mgとの比較)に対する比較を閉手順を用いて行った。特別な患者集団での有効性と安全性として、部分集団での検討(サブグループ解析)、日本人患者における治療開始24週後の治療成功率(サブグループ解析)、日本人患者における主要評価項目の各構成要因に該当した患者の割合(サブグループ解析)などの検討を行った。全体の有意水準は両側5%とし、主要解析の比較で有意差が認められた場合、次のステップへ進むこととした。 次のステップも同様に有意差が認められた場合、次の比較を検定した。有意差が認められなかった時点以降は、データの要約により比較した。各ステップの治療群間の比較は、治験担当医師が判定した結果を記録した症例報告書に基づくベースライン時のROPのZoneを層別因子としたCMH検定を用いた。Mantel-Haenszel法によるオッズ比の推定値及びその95%信頼区間も算出した。以下の各ステップにおいて、それぞれ検定を行った。 欠測データの補完は、主要評価項目の値が欠測している場合のみ実施した(*7)。主要解析は、以下の2つのステップからなる単一補完法を用いて主要評価項目の欠測値を補完した後に実施した。 最初のステップでは、治療開始24週後の活動性のROP及び不良な形態学的転帰の発現が欠測だった場合、以下のとおり欠測値を補完した。
次のステップでは、各構成要因の値を用いて主要評価項目を補完した。主要評価項目の補完は以下のとおり行うことした。
さらに、最初のステップの欠測値の補完方法として、治療開始24週後が欠測の場合、治療開始20週後の値を補完する解析も実施した副次評価項目では、治験担当医師の評価で主要評価項目の構成要因に該当するイベントが発現した患者の治療群別の割合及びClopper-Pearsonの95%信頼区間を算出した。治験治療開始後、イベントが最初に発現するまでの期間のKaplan-Meier曲線を示した。イベントが発現せず、完了又は中止した患者は、完了又は中止した時点で打ち切りとした。ROPの再発率は、治療群別にベースライン時の治療以降、治療開始24週後までに再治療を実施した患者の割合及びClopper-Pearsonの95%信頼区間を算出した。 有害事象は発現患者数とその割合を投与群別、器官別大分類(SOC)別、基本語(PT)別、重症度別、及び治験治療との関連別に要約した。 |
*1両眼ともに国際分類に基づく以下のいずれかの網膜所見を有する患者
- 病変の位置がZone I であり、かつ病期がStage 1+、2+若しくは3+又はStage 3であること
- 病変の位置がZone II であり、かつ病期がStage 3+であること
- 病変の位置、病期によらずAggressive Posterior - Retinopathy of Prematurityを有する病型であること
*2ルセンティス0.1mg群の試験成績は承認された用法・用量の範囲外のため、有効性及び安全性に関する試験成績からは削除しました。
*3効果不十分は、投与前と比べてROP病変の活動性(Stage、病変の範囲、plus diseaseの重症度及び範囲を考慮)が、以下のいずれかに該当する場合と定義した。
ルセンティス0.2mg(又は0.1mg)群
- 治療開始4日目で変化が無い又は悪化の場合
- 治療開始8日目で改善が軽微、変化が無い又は悪化の場合
- 治療開始8日目以降、前回の投与後27日までのいずれかの時点で悪化の場合
レーザー群
- 治療開始8日後でベースラインと比べて悪化しており、レーザー光凝固療法が完了している場合
- 治療開始15日後でROPが治療前と比べて軽微な改善、不変、又は悪化している場合
- 治療開始15日以降いずれかの時点で、ROPが前回の評価時に比べて悪化している場合
*4活動性のROPは以下のいずれかの所見がみられる場合と定義した。
- 眼の2象限以上にplus diseaseの血管拡張(持続的な蛇行を含む)がみられる
- 活動性のROP病変の徴候と考えられる網膜から硝子体に伸びる網膜外血管
*5不良な形態学的転帰は以下のいずれかの所見がみられる場合と定義した。
- 眼底後極部の透見を不明瞭にする水晶体後部線維増殖
- 耳側網膜血管の顕著な牽引に伴う網膜の構造異常又は黄斑偏位
- 黄斑部に及ぶ眼底後方の網膜ひだ
- 黄斑部に及ぶ網膜剥離
*6以下に示す基準のいずれにも該当しない患者の割合(主要評価項目の構成要因)
- 治療開始24週以前に死亡
- 治療開始24週以前に、いずれかの眼で治療のスイッチを要する
- 治療開始24週後に、いずれかの眼に活動性のROPを有する
- 治療開始24週以前に、いずれかの眼に不良な形態学的転帰を有する
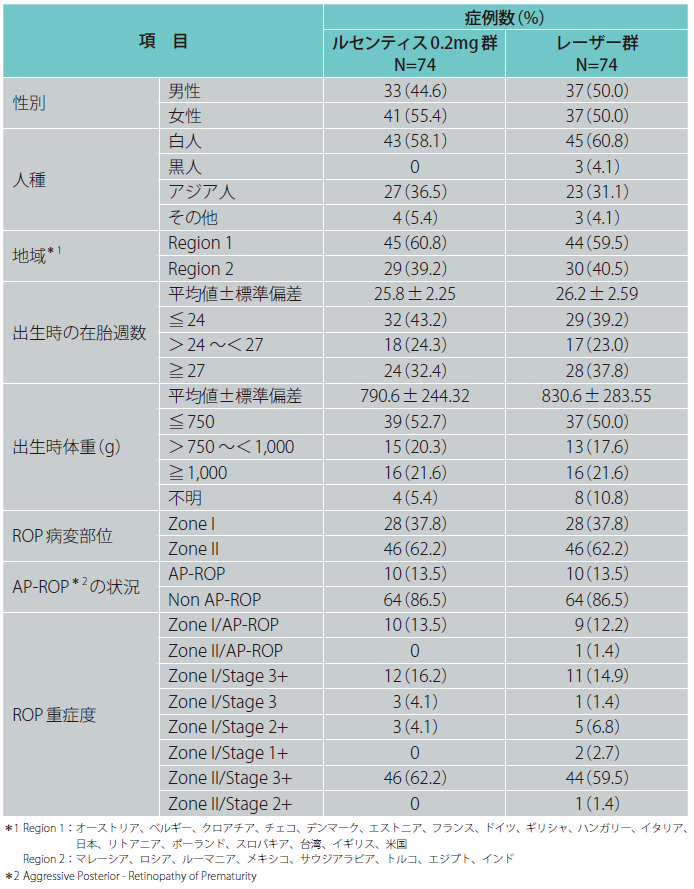
患者背景及びROPの主なベースライン特性
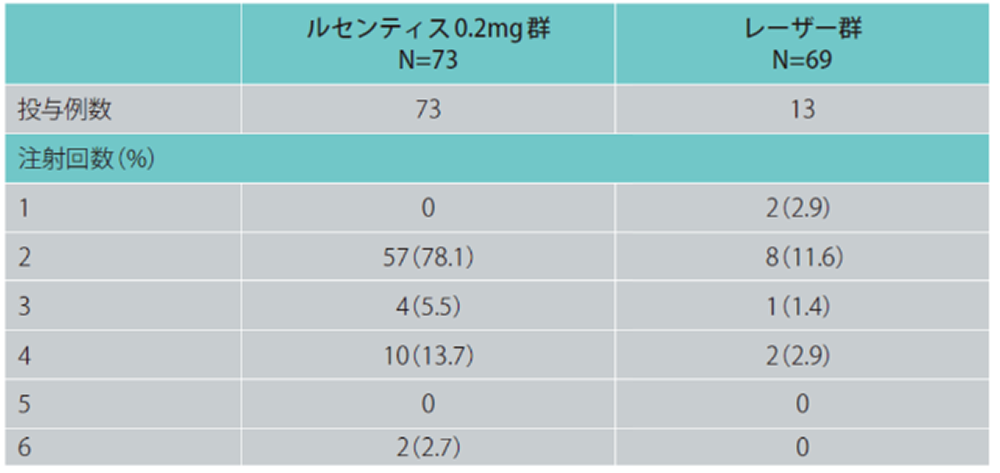
各群におけるルセンティスの注射回数*
*初回治療(片眼に1 回ずつ)は合計2 回投与とし、各眼へのルセンティスの注射回数の累積値を示しました。
各群におけるレーザー光凝固療法の実施状況
日本において承認されたルセンティスの用法及び用量
【未熟児網膜症】
ラニビズマブ(遺伝子組換え)として1回、0.2mg(0.02mL)を硝子体内投与する。なお、必要な場合は再投与できるが、1ヵ月以上の間隔をあけること。
〈用法及び用量に関連する使用上の注意〉
1. 自然治癒が期待できる軽症例及び外科的手術の適応となる重症例における本剤の投与意義が明確ではないことから、本剤による治療を開始するに際し、患者の状態や病変の位置、病期、病型による重症度等を考慮し、本剤投与の要否を判断すること。
2. 本剤投与により治療反応が得られた後に、疾患活動性の増加を示唆する所見が認められた場合は、本剤の再投与を検討すること。
3. 本剤投与後早期に治療反応が得られない場合は、他の治療への切替えを考慮すること。
# 社内資料:国際共同第III相比較試験(H2301)[200190539] 承認時評価資料