ルセンティス 臨床成績に関して
本剤は国内患者及び海外患者を対象とした臨床試験成績を基に評価され承認されました。以下で紹介する臨床試験成績には、承認範囲外の試験成績が一部含まれています。
| 「禁忌を含む使用上の注意」はこちらをご参照ください。 |
ビスダインによる光線力学的療法(vPDT)を対照とした国際共同第Ⅲ相比較検証試験(RADIANCE試験:F2301試験)1, 2)
最高矯正視力スコアのベースラインからの期間平均変化量(主要評価項目:3ヵ月成績)
投与開始1~3ヵ月後における最高矯正視力スコアのベースラインからの期間平均変化量は、ルセンティスⅠ群(視力安定化の基準)で10.5文字の増加、ルセンティスⅡ群(疾患の活動性の基準)で10.6文字の増加、vPDT群で2.2文字の増加でした。
ルセンティス各治療群とvPDT群を比較した結果、投与開始後1~3ヵ月における最高矯正視力スコアのベースラインからの期間平均変化量はいずれのルセンティス群でもvPDT群と比較して有意に増加し、vPDT群に対する優越性が検証されました(いずれもp<0.00001、両側Cochran-Mantel-Haenszel検定)。
投与開始1~3ヵ月後における最高矯正視力スコア*のベースラインからの期間平均変化量
* modified-last observation carried forward(mLOCF)法(欠測値を直前と直後の実測値の平均値)で補填
安全性
●副作用(12ヵ月)
ルセンティスⅠ群及びⅡ群で投与開始12ヵ月後までに、それぞれ106例中26例(24.5%)及び118例中26例(22.0%)に副作用が認められました。治療対象眼の副作用はルセンティスⅠ群及びⅡ群でそれぞれ106例中26例(24.5%)及び118例中24例(20.3%)に認められました。主な副作用は結膜出血で、ルセンティスⅠ群及びⅡ群でそれぞれ10例(9.4%)及び10例(8.5%)に認められましたが、その他の副作用はいずれも5%未満でした。眼以外の副作用はルセンティスⅡ群の118例中3例(2.5%)のみに認められ、共通の副作用ではありませんでした。vPDT群の53例中10例(18.9%)に副作用が認められ、いずれも治療対象眼の副作用でした(ただし、53例中38例は投与開始3ヵ月後以降にルセンティス0.5mgに切り替えられました)。主な副作用は結膜出血、点状角膜炎、眼圧上昇、注射部位出血、視力障害が各2例(3.8%)でした。
日本人患者のルセンティスⅠ群及びⅡ群で投与開始12ヵ月後までに、それぞれ21例中12例(57.1%)及び20例中7例(35.0%)に副作用が認められました。治療対象眼の副作用はルセンティスⅠ群及びⅡ群でそれぞれ21例中12例(57.1%)及び20例中6例(30.0%)に認められました。主な副作用は、ルセンティスⅠ群及びⅡ群でそれぞれ結膜出血が6例(28.6%)、2例(10.0%)、点状角膜炎が5例(23.8%)、2例(10.0%)などでした。眼以外の副作用はルセンティスⅡ群の20例中1例(5.0%)に認められました。vPDT群の9例中5例(55.6%)に副作用が認められ、いずれも治療対象眼の副作用で、うち2例(22.2%)に点状角膜炎が認められました(ただし、9例中6例は投与開始3ヵ月以降にルセンティス0.5mgに切り替えられました)。
●有害事象発現率(12ヵ月)
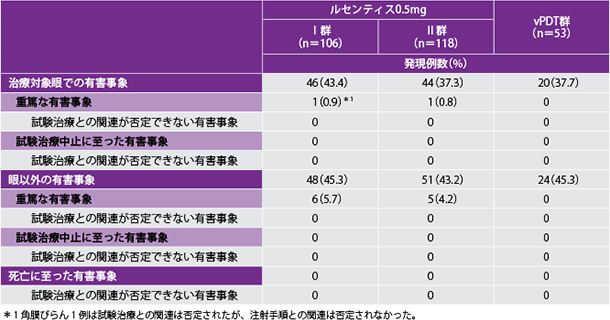
日本人患者のルセンティスⅠ群及びⅡ群で投与開始12ヵ月後までに、重篤な有害事象はそれぞれ21例中2例(9.5%)及び20例中1例(5%)に認められましたが、いずれも試験治療との関連はないと判断されました。本試験において日本人患者では試験治療中止に至った有害事象及び死亡に至った有害事象は認められませんでした。
試験方法
| 目 的 | 病的近視(PM)に伴うCNVによる視力障害を有する患者を対象に、各被験者の投与開始1~3ヵ月後までの3回の来院時における最高矯正視力スコア平均値のベースラインからの変化量に基づく被験者集団での平均変化量(以下、投与開始1~3ヵ月後における最高矯正視力スコアのベースラインからの期間平均変化量)を有効性の主要評価変数として、「視力安定化の基準」又は「疾患の活動性の基準」に基づいて硝子体内注射するラニビズマブ0.5mgの有効性についてvPDTに対する優越性を検証する。 |
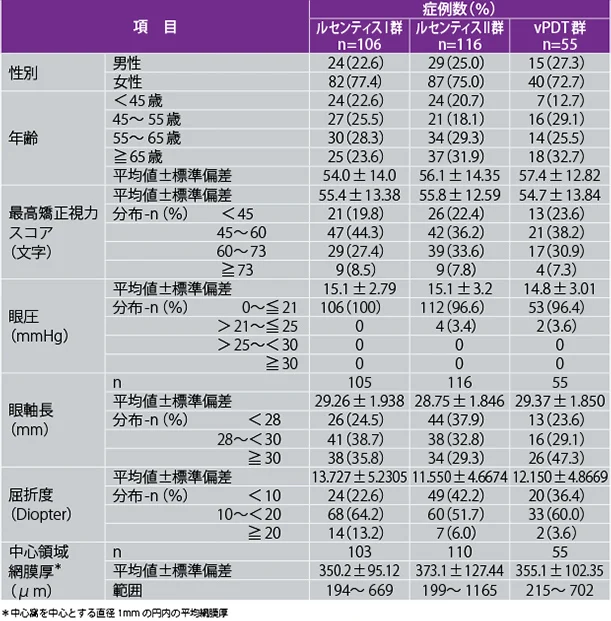
| 試験対象 | 病的近視(PM)におけるCNVによる視力障害を有する患者277例[うち、日本人50例(以下、カッコ内日本人患者数);ルセンティスⅠ群106(21)例、ルセンティスⅡ群116(20)例、vPDT群55(9)例] |
| 試験デザイン | 多施設共同ランダム化二重遮蔽vPDT対照比較検証試験 |
| 投与方法 |
Image
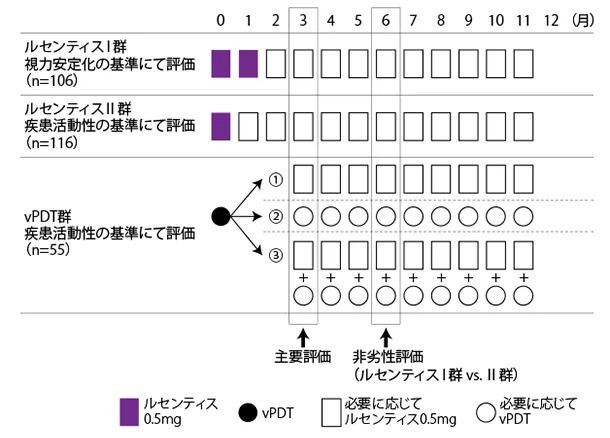
|
| 主要評価項目 | 投与開始1~3ヵ月後における最高矯正視力スコア(ETDRS視力検査表を用い、測定開始距離4mで測定)のベースラインからの期間平均変化量 |
| 副次評価項目 |
|
| 安全性評価項目 | 有害事象、重篤な有害事象 など |
| 解析計画 | 主要評価項目の主要解析は、ルセンティスⅠ群及びⅡ群のvPDT群に対する優越性を以下の2つの帰無仮説及び対立仮説に対して検証することである。 H01:μルセンティスⅠ−μvPDT≦0 vs HA1:μルセンティスⅠ−μvPDT>0 H02:μルセンティスⅡ−μvPDT≦0 vs HA2:μルセンティスⅡ−μvPDT>0 ここで、μルセンティスⅠはルセンティスⅠ群の主要評価項目の平均値を表し、μルセンティスⅡはルセンティスⅡ群の平均値を表し、μvPDTはvPDT群の平均値を表す。仮説検定は、Hochberg法を用いた。全体のα水準を0.001とした。対応する片側p値が0.001⁄2=0.0005以下の場合、又は両方の片側p値が0.001以下の場合に優越性が検証できる。群間比較は、観察値をスコアとして使用するCochran-Mantel-Haenszel検定により実施した。治療群及びベースラインの最高矯正視力スコアのカテゴリー(60文字以下、60文字超)を要因とするANOVAモデルの最小二乗平均を用いて、最高矯正視力スコアの平均変化量及びその各治療群間の差に関する両側95%信頼区間を算出した。 最高矯正視力スコアの欠測データはmodified-last obser vation carried forward(mLOCF)法で補填した。 本試験では、有効性の主要評価項目である投与開始1~3ヵ月後における最高矯正視力スコアのベースラインからの期間平均変化量、及び副次評価項目である投与開始1~6ヵ月後における最高矯正視力スコアのベースラインからの平均変化量について、ベースライン特性(民族、年齢、性別、人種、CNV発現部位、最高矯正視力、眼軸長、屈折度)による部分集団別の解析を実施した。 |
*1 視力安定化の基準:連続する過去2回の月1回の来院時と比べて最高矯正視力スコアに変化がない。
*2 疾患の活動性の基準:光干渉断層計(OCT)またはフルオレセイン蛍光眼底造影(FA)による評価で、病的近視に伴う網膜内または網膜下液、あるいは活動性漏出に起因する視力障害がある。
*3 中心窩を中心とする直径1mmの円内の平均網膜厚
(承認時評価資料)
患者背景及び治療対象眼の主なベースライン特性
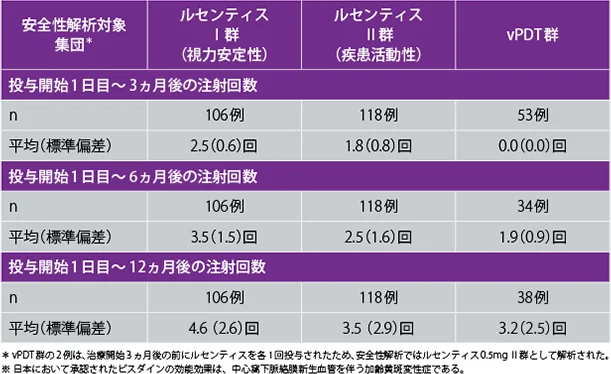
各群におけるルセンティスの注射回数
1)社内資料:国際共同第Ⅲ相比較試験(F2301)[LUCU00018]承認時評価資料
2)Wolf S., et al.:Ophthalmology, 121(3),682(2014)[LUCU00072]承認時評価資料
COI:本研究は、ノバルティスの資金により行われた。本論文の著者のうち2名は、ノバルティスの社員である。著者にノバルティスより講演料、コンサルタント料などを受領しているものが含まれる。
日本において承認されたビスダインの効能効果は、中心窩下脈絡膜新生血管を伴う加齢黄斑変性症です。
日本において承認されたルセンティスの用法及び用量
【病的近視における脈絡膜新生血管】
ラニビズマブ(遺伝子組換え)として1回あたり0.5mg(0.05mL)を硝子体内投与する。投与間隔は、1ヵ月以上あけること。
〈用法及び用量に関連する使用上の注意〉
1. 定期的に視力等を測定し、その結果及び患者の状態を考慮し、本剤投与の要否を判断すること。
2. 疾患の活動性を示唆する所見(脈絡膜新生血管、視力低下等)が認められた場合に投与することが望ましい。
3. 本剤による治療を開始するに際し、疾患・病態による視力等の予後を考慮し、本剤投与の要否を判断すること。
4. 定期的に有効性を評価し、有効性が認められない場合には漫然と投与しないこと。
5. 臨床試験においては、両眼治療は行われていない。両眼に治療対象となる病変がある場合は、両眼同時治療の有益性と危険性を慎重に評価した上で本剤を投与すること。なお、初回治療における両眼同日投与は避け、片眼での安全性を十分に評価した上で対側眼の治療を行うこと。