ベオビュ 糖尿病黄斑浮腫(DME)
海外第Ⅲ相試験(KITE:B2302試験)
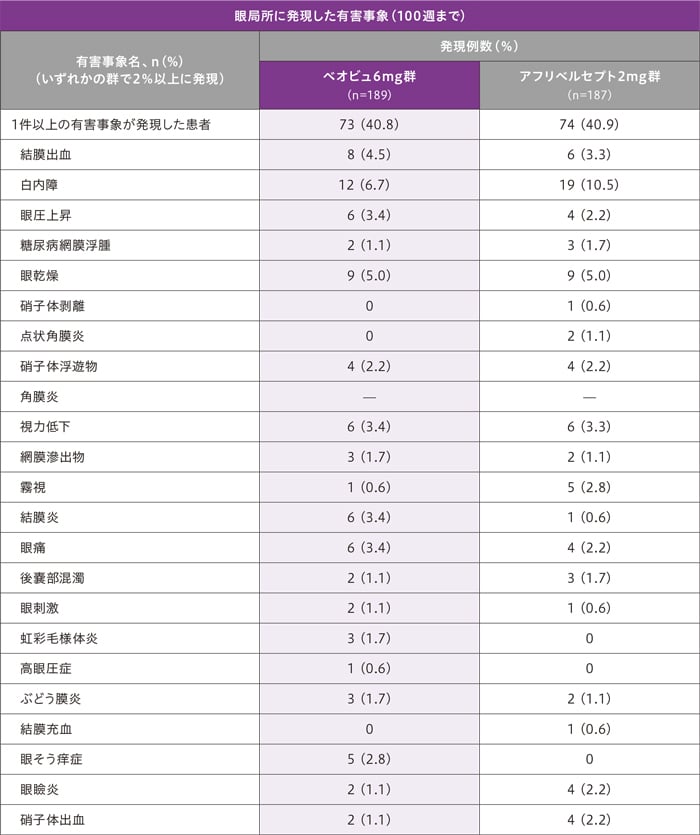
安全性
(12)安全性
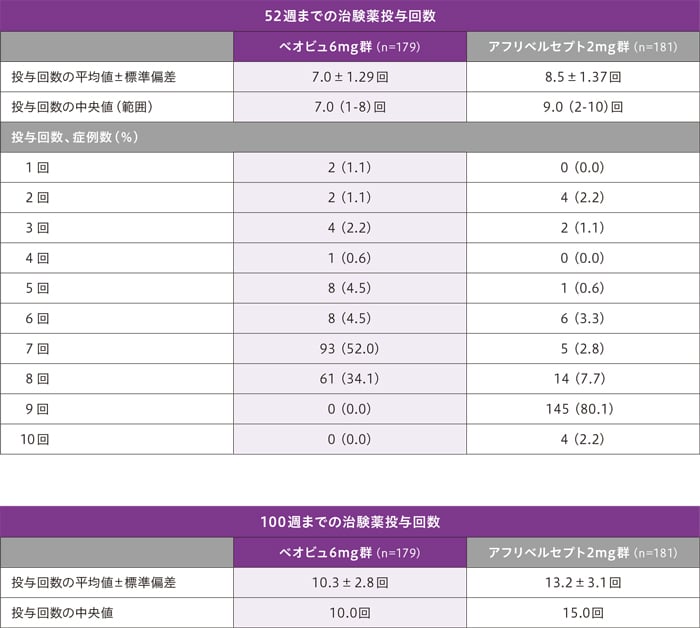
治験薬の曝露状況
52週及び100週までの治験薬投与患者の割合は以下のとおりです。
1症例で複数の事象を発現したケースを含むため、総和が一致しないことがある
※1 ぶどう膜炎、緑内障各1例
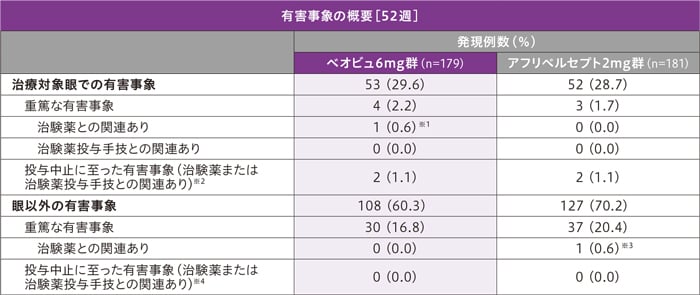
※2 治験薬または治験薬手技との関連があった有害事象は、ベオビュ6mg群2例(ぶどう膜炎2例)、アフリベルセプト2mg群2例(網膜動脈閉塞、ぶどう膜炎各1例)に認められました。
※3 一過性脳虚血発作1例
※4 治験薬との関連があった有害事象は、認められませんでした。
100週までの治療対象眼における重篤な有害事象は、ベオビュ6mg群で5例、アフリベルセプト2mg群で3例に認められました。主な重篤な有害事象(いずれかの投与群において2例以上に発現した有害事象)は、眼内炎(ベオビュ6mg群2例、アフリベルセプト2mg群1例)でした。
治療対象眼における投与中止に至った有害事象は、ベオビュ6mg群で5例(ぶどう膜炎2例、網膜動脈閉塞症、虹彩毛様体炎、眼内炎各1例)、アフリベルセプト2mg群で4例(眼内炎、網膜動脈閉塞症、ぶどう膜炎、眼異物感各1例)に認められました。
死亡は22例(ベオビュ6mg群13例、アフリベルセプト2mg群9例)で、いずれも治験薬との関連なしと判断されました。
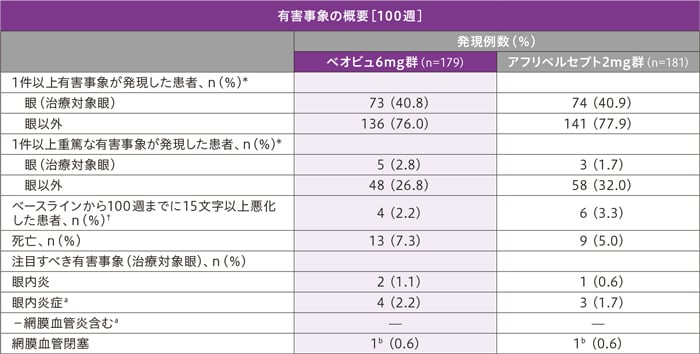
MedDRA Version 24.1(KESTREL)及び24.0(KITE)に従い有害事象を報告した。
治験薬の投与開始日または投与開始後に発生した有害事象を計測した。
*基本語や器官別大分類にある有害事象を複数発生した患者は、各分類に1回のみカウントした。
a:眼内炎症を発症した患者の割合と網膜血管炎を発症した患者の割合は合計できなかった。
b:KITE試験において、網膜血管閉塞と眼内炎症を併発した患者はいなかった。
†欠測値はLOCF法を用いて補完した。 +眼内炎症を併発した2例を含む。 #眼内炎症を併発した1例を含む。