ベオビュ 糖尿病黄斑浮腫(DME)
海外第Ⅲ相試験(KITE:B2302試験)
試験方法と患者背景および治療対象眼の主なベースライン特性
2.海外第Ⅲ相試験(KITE:B2302試験)10、11、14~16)
(海外データ)
| 10)Brown DM, et al. Am J Ophthalmol 2022;238:157-172[20220091] COI:本研究は、ノバルティスの資金により行われた。本論文の著者のうち5名はノバルティスの社員、7名はノバルティスの顧問、3名はノバルティスのアドバイザーである。 著者にはノバルティスより講演料/研究費/助成金を受領している者、ノバルティスの資金により行われた他の試験にも参加した医師が含まれる。 11)Wykoff CC, et al. Am J Ophthalmol2023;in press DOI:https://doi.org/10.1016/j.ajo.2023.07.012※ COI:本研究は、ノバルティスの資金により行われた。本論文の著者のうち4名はノバルティスの社員、7名はノバルティスの顧問、1名はノバルティスのアドバイザーである。 著者にはノバルティスより講演料/研究費/助成金を受領している者、ノバルティスの資金により行われた他の試験にも参加した医師が含まれる。 ※100週時のデータは承認審査過程において当局に提出しており、社内では評価されたものと見なしている。 14)社内資料:海外第Ⅲ相試験(B2302試験)[20220095]承認時評価資料 15)社内資料:国際共同第Ⅲ相試験[CSR CRTH258B2302(資料12.2.2)] 16)社内資料:国際共同第Ⅲ相試験[CSR CRTH258B2302(資料12.2.3)] |
試験方法
目的
52週の最高矯正視力のベースラインからの変化量に関して、ベオビュ6mgのアフリベルセプト2mgに対する非劣性を検証する。
試験対象
18歳以上で治療対象眼※1が糖尿病黄斑浮腫による視力障害を有する患者360例
※1
・最高矯正視力がETDRS(early treatment diabetic retinopathy study)可読文字数78~23文字、かつ糖尿病黄斑浮腫が黄斑中心部にまで及んでおり、中心窩網膜厚が320μm以上
・HbA1c値が10%以下の1型または2型糖尿病を合併
試験デザイン
多施設共同二重遮蔽無作為化並行群間比較試験(検証試験)
投与方法
患者をベオビュ6mg群、アフリベルセプト2mg群のいずれかに1:1の比で無作為化し、ベオビュまたはアフリベルセプトを硝子体内に投与した。ベオビュ6mgは6週ごと、アフリベルセプト2mgは4週ごとに5回導入投与した後、維持投与としてベオビュ6mgは12週ごと、アフリベルセプト2mgは8週ごとに投与した。ベオビュ6mgの投与は、規定来院日に遮蔽医師による疾患活動性評価を行い、疾患活動性が認められた場合は試験終了時まで8週間隔とし、72週目に疾患安定性が認められた場合は、12週から16週または8週から12週間隔投与に調整した。
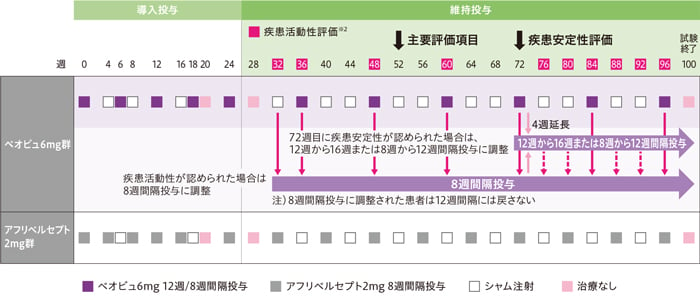
※2 疾患活動性の評価基準
投与1年目の32週、36週及び48週に遮蔽医師が28週の疾患の状態を参考とし、「投与間隔を8週にする必要あり」または「投与間隔を8週にする必要なし」のいずれに該当するかを判断した
| 投与間隔を8週にする必要あり |
| VEGF阻害剤をより頻回に投与する必要があると遮蔽医師が判断する疾患活動性が特定された場合。例えば、糖尿病黄斑浮腫の疾患活動性に起因すると考えられる最高矯正視力スコアの(28週から)5文字以上の減少が認められた場合、解剖学的所見に基づく判断等。 |
| 投与間隔を8週にする必要なし |
| 上記以外。 |
主要評価項目
最高矯正視力スコア※3のベースラインからの変化量(52週)
最も重要な副次評価項目
最高矯正視力スコア※3のベースラインからの平均変化量(40~52週)
重要な副次評価項目(ベオビュ群のみ)
- 試験開始から12週間隔投与を維持した患者の割合(52週)
- 導入期直後から12週間隔投与を維持した患者の割合(52週)
その他の副次評価項目
- 最高矯正視力スコア※3のベースラインからの変化量(52週までの各評価時点、100週)
- 最高矯正視力スコア※3のベースラインからの平均変化量(4~52週、20~52週、28~52週及び88~100週)
- ベースラインからの最高矯正視力スコア※3の増加が15文字以上、または84文字以上の患者の割合(52週及び100週)
- ベースラインからの最高矯正視力スコア※3の増加が15文字以上、または84文字以上の初回達成までの期間(52週まで)
- ベースラインからの最高矯正視力スコア※3の減少が15文字以上の患者の割合(52週及び100週)
- 32週で疾患活動性を示した患者の割合(32週)
- 試験開始から12週間隔投与を維持した患者の割合(100週)
- 導入期直後から12週間隔投与を維持した患者の割合(100週)
- 中心窩網膜厚のベースラインからの変化量(各評価時点)
- 中心窩網膜厚のベースラインからの平均変化量(40~52週)
- 中心窩網膜厚が280μm未満の患者の割合(52週及び100週)
- 網膜内滲出液(intraretinal fluid:IRF)または網膜下滲出液(subretinal fluid:SRF)が認められた患者の割合(52週、52週までの各評価時点、100週)
- 血管漏出が認められた患者の割合(52週)
- ETDRS糖尿病網膜症重症度がベースラインから2段階以上低下した患者の割合(28週、52週及び100週)
- ETDRS糖尿病網膜症重症度がベースラインから3段階以上低下した患者の割合(28週、52週及び100週)
- ETDRS糖尿病網膜症重症度がベースラインから2段階以上上昇した患者の割合(28週及び52週)
- ETDRS糖尿病網膜症重症度がベースラインから3段階以上上昇した患者の割合(28週及び52週)
- ETDRS糖尿病網膜症重症度スコア61以上の増殖糖尿病網膜症に進行した患者の割合(52週)
- VFQ-25(Visual Function Questionnaire-25)の合計スコアのベースラインからの変化量(28週及び52週) など
※3 ETDRS文字スコア(ETDRS視力検査表を用いて測定開始距離4mで評価)
安全性評価項目
- 治験薬の曝露状況
- 有害事象(治療対象眼及び眼以外)
- ベースライン時及び100週までの抗薬物抗体の状態 など
解析計画
KITE試験の100週での解析計画は、すべて記述的であり、52週時に既出の通りでした。
| 主要評価項目・最も重要な副次評価項目 |
解析対象集団:FAS(無作為化された患者のうち、治験薬が1回以上投与されたすべての患者) 解析方法: ベースラインの最高矯正視力区分(≦65文字、>65文字)、年齢区分(<65歳、≧65歳)、投与群を固定効果とした分散分析(ANOVA)を行い、投与群間差(ベオビュ6mg群-アフリベルセプト2mg群)の両側95%信頼区間の下限値が非劣性マージンの-4文字より大きい場合に、アフリベルセプト2mg群に対するベオビュ6mg群の非劣性が検証されることとした(有意水準は片側0.025)。 多重性の調整: 事前に規定した階層的手法を適用し、主要評価項目、最も重要な副次評価項目の順に、先行する評価項目について非劣性が検証された場合に次の評価項目の非劣性を検証できることとした。
|
| 重要な副次評価項目 |
解析対象集団:FAS及びFASのうち導入期直後から12週間隔投与を維持したベオビュ群の患者 解析方法: 52週に12週間隔で投与継続可能な患者の割合を、疾患活動性の評価に基づき8週間隔投与に移行するまでの期間を指標として、Kaplan-Meier法で推定した。 |
| その他の副次評価項目 |
解析対象集団:FAS 解析方法: 欠測値はLOCF法を適用し、欠測直前の実測値で補完した。治験薬以外の糖尿病黄斑浮腫治療へ切替え後のデータは打切りとみなし、他治療への切替え直前の実測値で補完した。 多重性の調整: 主要評価項目及び最も重要な副次評価項目で2つの非劣性が検証された場合には、副次評価項目3項目(40~52週の中心窩網膜厚のベースラインからの平均変化量、40~52週の最高矯正視力スコアのベースラインからの平均変化量、52週のIRFまたはSRFが認められた患者の割合の順)について、アフリベルセプト2mg群に対するベオビュ6mg群の優越性検定を実施することとした(有意水準は片側0.025)。 |
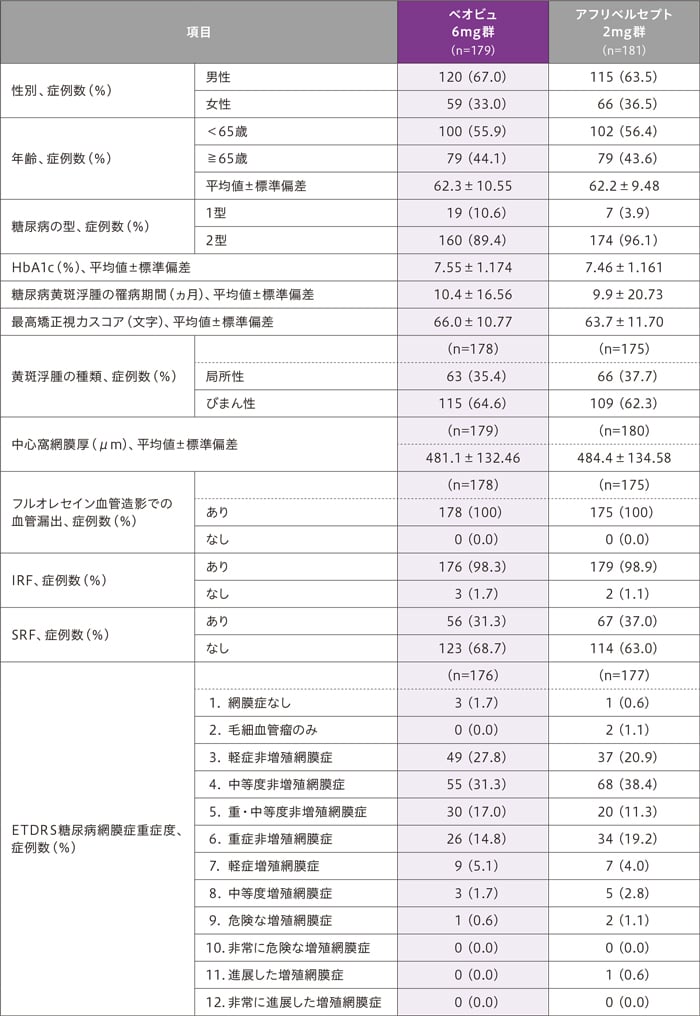
患者背景及び治療対象眼の主なベースライン特性