ベオビュ 糖尿病黄斑浮腫(DME)
日本人を含む国際共同第Ⅲ相試験(KESTREL:B2301試験)安全性
(12)安全性
治験薬の曝露状況
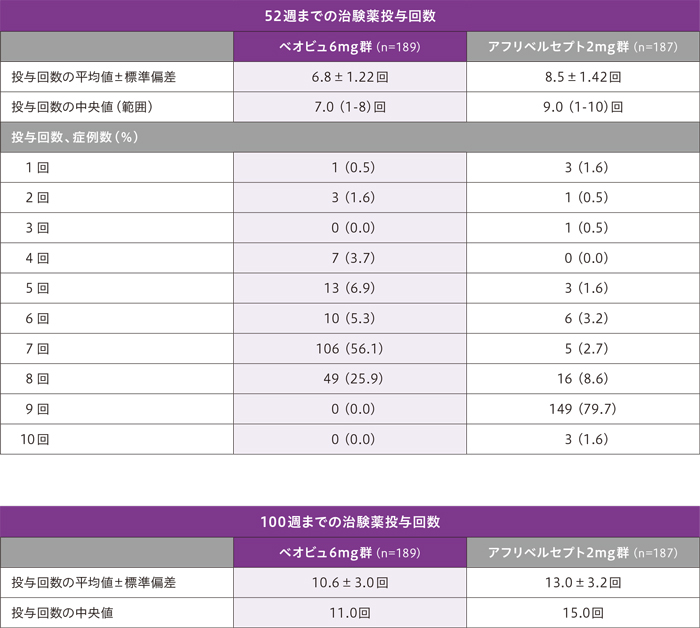
52週及び100週までの治験薬投与患者の割合は以下のとおりです。
※ベオビュ3mg群は承認された用法及び用量の範囲外のため、治験薬の曝露状況は削除しました。
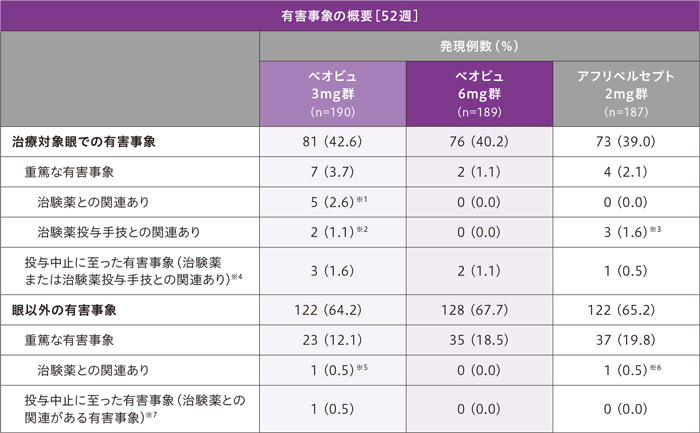
1症例で複数の事象を発現したケースを含むため、総和が一致しないことがある
※1 網膜血管炎3例、緑内障、網膜静脈血栓症、ぶどう膜炎、黄斑浮腫、視神経障害、眼内炎、硝子体炎各1例
※2 ぶどう膜炎、網膜血管炎、黄斑浮腫、視神経障害、眼内炎各1例
※3 白内障2例、眼内炎1例
※4 治験薬または治験薬手技との関連があった有害事象は、ベオビュ3mg群3例(眼圧上昇/網膜血管炎、虹彩毛様
体炎、網膜動脈閉塞各1例)、ベオビュ6mg群2例(眼の炎症、ぶどう膜炎各1例)、アフリベルセプト2mg群1例(眼内炎)に認められました。
※5 狭心症、心筋梗塞各1例
※6 ラクナ脳卒中1例
※7 治験薬との関連があった有害事象は、ベオビュ3mg群1例(狭心症/心筋梗塞)に認められました。
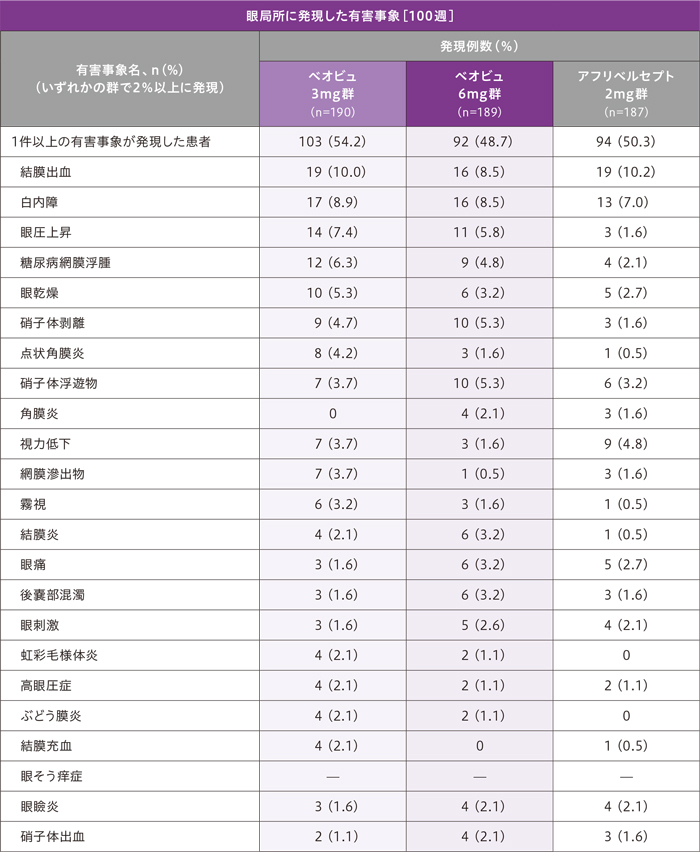
副作用[100週]
治療対象眼
100週までの治療対象眼における副作用(治験薬との関連がある有害事象)の発現率は、ベオビュ3mg群6.3%(12/190例)、ベオビュ6mg群4.2%(8/189例)、アフリベルセプト2mg群1.6%(3/187例)でした。
治療対象眼における治験薬と関連のある有害事象は、ベオビュ3mg群で12例(6.3%)、ベオビュ6mg群で8例(4.2%)、アフリベルセプト2mg群で3例(1.6%)に認められました。
100週までの治療対象眼における重篤な有害事象は、ベオビュ3mg群で8例、ベオビュ6mg群で7例、アフリベルセプト2mg群で5例に認められました。主な重篤な有害事象(いずれかの投与群において2例以上に発現した有害事象)は、白内障(ベオビュ3mg群1例、ベオビュ6mg群5例、アフリベルセプト2mg群3例)、網膜血管炎(ベオビュ3mg群2例)、眼内炎(ベオビュ3mg群2例、アフリベルセプト2mg群1例)でした。
治療対象眼における投与中止に至った有害事象は、ベオビュ3mg群で7例(眼圧上昇および網膜血管炎1例2件、黄斑上膜、網膜剥離、虹彩毛様体炎、網膜動脈閉塞症、開放隅角緑内障、ぶどう膜炎各1例)、ベオビュ6mg群で3例(眼の炎症、ぶどう膜炎、糖尿病性網膜水腫各1例、アフリベルセプト2mg群で2例(眼内炎、虹彩炎各1例)に認められました。
死亡は19例(ベオビュ3mg群4例、ベオビュ6mg群8例、アフリベルセプト2mg群7例)で、いずれも治験薬との関連なしと判断されました。
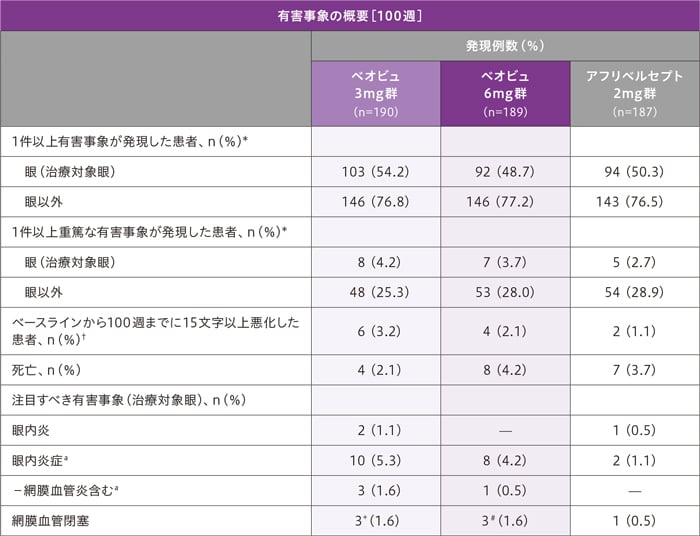
MedDRA Version 24.1(KESTREL)及び24.0(KITE)に従い有害事象を報告した。
治験薬の投与開始日または投与開始後に発生した有害事象を計測した。
*基本語や器官別大分類にある有害事象を複数発生した患者は、各分類に1回のみカウントした。
a:眼内炎症を発症した患者の割合と網膜血管炎を発症した患者の割合は合計できなかった。
b:KITE試験において、網膜血管閉塞と眼内炎症を併発した患者はいなかった。
†欠測値はLOCF法を用いて補完した。
+眼内炎症を併発した2例を含む。
#眼内炎症を併発した1例を含む。
日本において承認されたベオビュの用法及び用量(抜粋) 〈効能共通〉 〈糖尿病黄斑浮腫〉 |