ベオビュ 加齢黄斑変性(AMD)
海外第Ⅲ相試験(HARRIER:C002試験)4、5、7、8)(海外データ)
試験方法と患者背景および治療対象眼の主なベースライン特性
4)社内資料:有効性に関する概括評価[20200027]承認時評価資料 |
試験方法
目的
48週の最高矯正視力のベースラインからの変化量に関して、ベオビュ6mgのアフリベルセプト2mgに対する非劣性を検証する。
試験対象
50歳以上で治療対象眼※1が未治療の活動性脈絡膜新生血管(choroidal neovascularization:CNV)を伴う滲出型加齢黄斑変性患者739例
試験デザイン
多施設共同二重遮蔽無作為化並行群間比較試験
投与方法
患者をベオビュ6mg群またはアフリベルセプト2mg群のいずれかに1:1の比で無作為化し、各薬剤を4週ごとに3回導入投与した後、維持投与としてベオビュ6mg群は12週ごと、アフリベルセプト2mg群は8週ごとに硝子体内投与した(16週まではベオビュ6mg群とアフリベルセプト2mg群で投与時期が同一)。ベオビュ6mg群の投与は、規定来院日に遮蔽医師による疾患活動性評価を行い、疾患活動性が認められた場合は試験終了時まで8週間隔とした。

※2 疾患活動性の評価基準
| 評価時点 | 評価基準 |
|---|---|
| 16週 |
|
| 20、28、32、40、44週※3 |
|
| 52、56、64、68、 76、80、88、92週※3 |
|
※3 疾患活動性評価の最終的な判断は遮蔽医師にあり、これらガイダンスと臨床的な判断をもとに遮蔽医師の裁量により決定された
a)患者が12週に来院しなかった場合、44週を含む来院日まで8週の値を疾患活動性評価の基準値として適用
b)患者が48週に来院しなかった場合、44週の値を2年目の疾患活動性評価の基準値として適用
主要評価項目
最高矯正視力スコア※4のベースラインからの変化量(48週)
最も重要な副次評価項目
最高矯正視力スコア※4のベースラインからの平均変化量(36~48週)
その他の重要な副次評価項目(ベオビュ群のみ)
- 試験開始から12週間隔投与を維持した患者の割合(48週)
- 導入期直後から12週間隔投与を維持した患者の割合(48週)
その他の副次評価項目
- 最高矯正視力スコア※4のベースラインからの変化量(96週、各評価時点)
- ベースラインからの最高矯正視力スコア※4の増加が15文字以上、または84文字以上の患者の割合(48週及び96週)
- ベースラインからの最高矯正視力スコア※4の減少が15文字以上の患者の割合(48週及び96週)
- 試験開始から12週間隔投与を維持した患者の割合(96週)
- 導入期直後から12週間隔投与を維持した患者の割合(96週)
- 16週で疾患活動性を示した患者の割合(16週)
- 中心窩網膜厚のベースラインからの変化量(各評価時点)
- 中心窩網膜厚のベースラインからの平均変化量(36~48週)
- CNV病変サイズのベースラインからの変化量(12週、48週及び96週)
- CNV病変を有する患者の割合(12週、48週及び96週)
- IRFまたはSRFが認められた患者の割合(16週、48週及び96週)
- 網膜色素上皮下の滲出液〔sub-retinal pigment epithelium(sub-RPE)fluid〕が認められた患者の割合(16週、48週及び96週)など
※4 ETDRS文字スコア(ETDRS視力検査表を用いて測定開始距離4mで評価)
安全性評価項目
有害事象(治療対象眼及び眼以外)など
解析計画
| 主要評価項目・最も重要な副次評価項目 |
|---|
| その他の重要な副次評価項目 |
|---|
| その他の副次評価項目 |
|---|
患者背景及び治療対象眼の主なベースライン特性
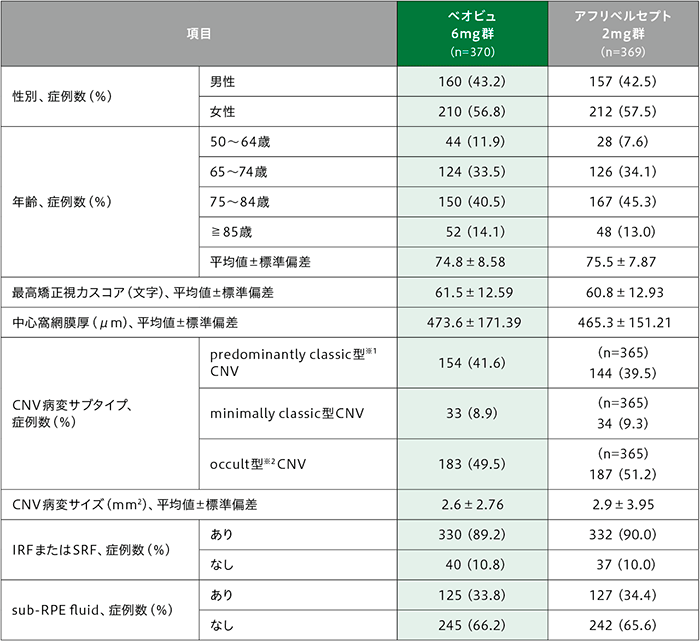
※1 predominantly classic型とpure classic型が含まれる
※2 3つのサブタイプ〔線維血管系網膜色素上皮剥離(pigment epithelial detachment:PED)、漿液性PED及び後期漏出〕のうち少なくとも1つが存在する場合
日本において承認されたベオビュの用法及び用量に関連する注意(抜粋) 〈効能共通〉 〈中心窩下脈絡膜新生血管を伴う加齢黄斑変性〉 |