ベオビュ 加齢黄斑変性(AMD)
日本人を含む国際共同第Ⅲ相試験(HAWK:C001試験)安全性
副作用[48週]
治療対象眼
48週までの治療対象眼における副作用発現率は、ベオビュ3mg群22.3%(80/358例)、ベオビュ6mg群22.2%(80/360例)、アフリベルセプト2mg群17.8%(64/360例)でした。主な副作用は結膜出血〔ベオビュ3mg群7.5%(27/358例)、ベオビュ6mg群5.6%(20/360例)、アフリベルセプト2mg群4.4%(16/360例)、以下同順〕、ぶどう膜炎〔1.1%(4/358例)、1.7%(6/360例)、0%(0/360例)〕、網膜色素上皮裂孔〔0.8%(3/358例)、1.4%(5/360例)、0.8%(3/360例)〕でした。
重篤な副作用は、「治験薬との関連あり」としてぶどう膜炎(ベオビュ3mg群1例、ベオビュ6mg群2例)、網膜動脈血栓症(ベオビュ6mg群1例)、増殖性網膜症(ベオビュ6mg群1例)、硝子体炎(ベオビュ6mg群1例)、網膜動脈閉塞(ベオビュ3mg群1例)、黄斑円孔(アフリベルセプト2mg群1例)、眼内炎(ベオビュ3mg群2例)が、「治験薬投与手技との関連あり」として網膜剥離(ベオビュ3mg群1例)、黄斑円孔(アフリベルセプト2mg群1例)、眼内炎(ベオビュ3mg群2例、ベオビュ6mg群2例)が認められました。
投与中止に至った副作用(治験薬または治験薬投与手技との関連がある有害事象)は、ベオビュ3mg群8例(眼内炎3例、角膜後面沈着、網膜下滲出液、網膜動脈閉塞 、前房出血、眼の炎症各1例)、ベオビュ6mg群8例(ぶどう膜炎3例、網膜動脈血栓症、網膜血管周囲鞘形成 、虹彩炎、増殖性網膜症、硝子体炎各1例)、アフリベルセプト2mg群2例(網膜色素上皮裂孔、視力障害各1例)に認められました。
眼以外
48週までの眼以外の副作用発現率は、ベオビュ3mg群0.6%(2/358例、心室性期外収縮及び虚血性大腸炎)、ベオビュ6mg群0.3%(1/360例、高血圧)、アフリベルセプト2mg群1.1%(4/360例、不安定狭心症、高血圧、虚血性脳卒中及び頭痛)でした。
死亡はベオビュ3mg群4例、ベオビュ6mg群4例、アフリベルセプト2mg群6例に認められましたが、いずれも治験薬との関連なしと判断されました。
重篤な副作用として、虚血性大腸炎(ベオビュ3mg群1例)、不安定狭心症及び虚血性脳卒中(アフリベルセプト2mg群各1例)が認められました。
投与中止に至った副作用(治験薬との関連がある有害事象)は、アフリベルセプト2mg群2例(虚血性脳卒中、不安定狭心症各1例)に認められました。
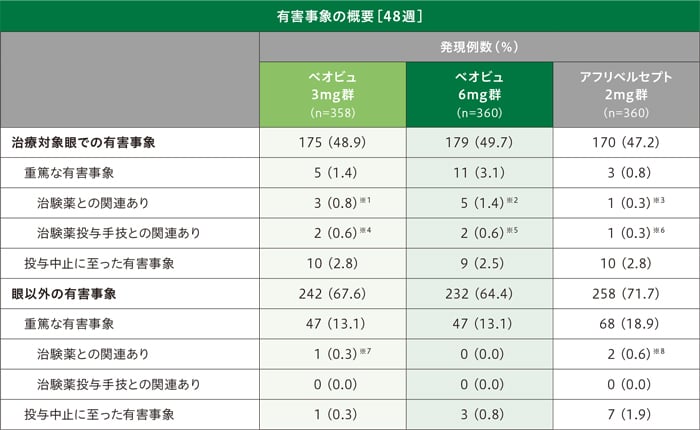
1症例で複数の事象を発現したケースを含むため、総和が一致しないことがある
※1 ぶどう膜炎1例、網膜動脈閉塞1例、眼内炎2例
※2 ぶどう膜炎2例、網膜動脈血栓症、増殖性網膜症、硝子体炎各1例
※3 黄斑円孔1例
※4 網膜剥離1例、眼内炎2例
※5 眼内炎2例
※6 黄斑円孔1例
※7 虚血性大腸炎1例
※8 不安定狭心症、虚血性脳卒中各1例
副作用[96週]
治療対象眼
96週までの治療対象眼における副作用発現率は、ベオビュ3mg群27.1%(97/358例)、ベオビュ6mg群26.9%(97/360例)、アフリベルセプト2mg群21.4%(77/360例)でした。主な副作用は結膜出血〔ベオビュ3mg群10.1%(36/358例)、ベオビュ6mg群7.2%(26/360例)、アフリベルセプト2mg群6.7%(24/360例)、以下同順〕、ぶどう膜炎〔1.4%(5/358例)、1.7%(6/360例)、0.3%(1/360例)〕、網膜色素上皮裂孔〔0.8%(3/358例)、1.4%(5/ 360例)、0.8%(3/360例)〕でした。
重篤な副作用は、「治験薬との関連あり」としてぶどう膜炎(ベオビュ3mg群1例、ベオビュ6mg群2例)、網膜動脈血栓症(ベオビュ6mg群1例)、増殖性網膜症(ベオビュ6mg群1例)、硝子体炎(ベオビュ6mg群1例)、網膜動脈閉塞(ベオビュ3mg群1例)、黄斑円孔(アフリベルセプト2mg群1例)、眼内炎(ベオビュ3mg群2例)が、「治験薬投与手技との関連あり」として網膜剥離(ベオビュ3mg群1例、アフリベルセプト2mg群1例)、黄斑円孔(アフリベルセプト2mg群1例)、眼内炎(ベオビュ3mg群2例、ベオビュ6mg群3例)が認められました。
投与中止に至った副作用(治験薬または治験薬投与手技との関連がある有害事象)は、ベオビュ3mg群8例(眼内炎2例、眼内炎/緑内障 、網膜下滲出液、網膜動脈閉塞 、前房出血、眼の炎症、ぶどう膜炎各1例)、ベオビュ6mg群8例(ぶどう膜炎3例、網膜動脈血栓症、網膜血管周囲鞘形成 、虹彩炎、増殖性網膜症、硝子体炎各1例)、アフリベルセプト2mg群2例(網膜色素上皮裂孔、視力障害各1例)に認められました。
眼以外
96週までの眼以外の副作用発現率は、ベオビュ3mg群1.7%(6/358例、心室性期外収縮、虚血性大腸炎、冠動脈疾患、脳梗塞 、脳血管発作、血中尿素増加及び血中尿素窒素/クレアチニン比増加各1例)、ベオビュ6mg群 0.8%(3/360例、高血圧2例、蕁麻疹1例)、アフリベルセプト2mg群2.5%(9/360例、頭痛2例、虚血性脳卒中、心筋梗塞 、心室血栓症、不安定狭心症、悪心 、アナフィラキシー反応、心拍数不整、錯乱状態各1例)でした。
死亡はベオビュ3mg群9例、ベオビュ6mg群8例、アフリベルセプト2mg群12例に認められ、このうちベオビュ3mg群の脳血管発作(1例)は治験薬との関連ありと判断されました。
重篤な副作用は、冠動脈疾患、虚血性大腸炎、脳梗塞及び脳血管発作(ベオビュ3mg群各1例)、不安定狭心症、心室血栓症、虚血性脳卒中、心筋梗塞及びアナフィラキシー反応(アフリベルセプト2mg群各1例)が認められました。
投与中止に至った副作用(治験薬との関連がある有害事象)は、ベオビュ3mg群1例(脳梗塞)、アフリベルセプト2mg群3例(虚血性脳卒中、不安定狭心症/心室血栓症、心筋梗塞各1例)に認められました。

1症例で複数の事象を発現したケースを含むため、総和が一致しないことがある
※1 ぶどう膜炎1例、網膜動脈閉塞1例、眼内炎2例
※2 ぶどう膜炎2例、網膜動脈血栓症、増殖性網膜症、硝子体炎各1例
※3 黄斑円孔1例
※4 網膜剥離1例、眼内炎2例
※5 眼内炎3例
※6 網膜剥離、黄斑円孔各1例
※7 冠動脈疾患、虚血性大腸炎、脳梗塞、脳血管発作各1例
※8 不安定狭心症、心室血栓症、虚血性脳卒中、心筋梗塞各1例
※9 アナフィラキシー反応1例
日本において承認されたベオビュの用法及び用量(抜粋) 〈中心窩下脈絡膜新生血管を伴う加齢黄斑変性〉 |