ジレニア 【効能又は効果】、【用法及び用量】の確認
4.効能又は効果
|
下記に示す患者背景では、ジレニアの有効性および安全性が確立されていません。ジレニアの治療効果を十分に発揮するためにも、下記の患者背景を確認してからジレニアの投与を検討してください。
ジレニアの有効性および安全性が確立されていない患者背景
- ジレニアの国内外の臨床試験では、ほとんどが再発寛解型多発性硬化症の患者を対象としているため、「進行型多発性硬化症」に対する本剤の有効性および安全性は確立されていません。
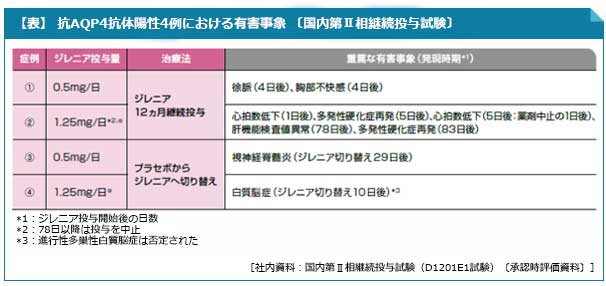
- 国内臨床試験では、「抗アクアポリン(AQP)4抗体陽性例」に対する有効性および安全性は確立されていません。国内臨床試験に組み入れられた抗AQP4抗体陽性例4例では、いずれも原疾患との関連が疑われる重篤な有害事象(胸部不快感、多発性硬化症再発、視神経脊髄炎、白質脳症)が報告されています(表)。
- 国内臨床試験では、「脊髄長大病変」を有する例が除外されていたため、「脊髄長大病変」を有する患者に対する本剤の有効性および安全性は確立されていません。
※【ジレニアの用法及び用量】通常、成人にはフィンゴリモドとして1日1回0.5mgを経口投与する。
《国内第Ⅱ相継続投与試験 試験概要》
- 目的
日本人再発性多発性硬化症患者に対するジレニア長期投与の有効性・安全性を検討する。 - 対象
国内第Ⅱ相試験(6ヵ月)に登録した日本人再発性多発性硬化症患者171例
(うち継続投与試験にも登録したのが143例) - 方法
国内第Ⅱ相試験において、ジレニア0.5mg群および1.25mg※群であった患者については、ジレニアの投与をそのまま6ヵ月間継続投与し、プラセボ群であった患者についてはさらに無作為に2群に割り付けた後、ジレニア0.5mgまたは1.25mg※の1日1回経口投与に切り替えられ、それぞれ6ヵ月間投与した(試験期間は12ヵ月)。 - 評価項目
◎有効性評価項目: Gd造影T1強調病巣 など
◎安全性評価項目: 有害事象、臨床検査値(血液学的検査値、肝機能検査値 など) など - 解析計画
安全性の解析は、継続投与試験において試験薬を1回以上投与された患者集団にて行った。 安全性
国内第Ⅱ相継続投与試験における6ヵ月間の副作用発現率は、ジレニア0.5mg群で57.4%(27例/47例)、ジレニア1.25mg※群で56.5%(26例/46例)、プラセボ-ジレニア0.5mg群で74.1%(20例/27例)、プラセボ-ジレニア1.25mg※群で100%(23例/23例)であった。なお、主な副作用(いずれかの群で発現率10%以上)は、肝機能検査値異常〔ジレニア0.5mg群6.4%(3例)、ジレニア1.25mg※群8.7%(4例)、プラセボ-ジレニア0.5mg群14.8%(4例)、プラセボ-ジレニア1.25mg※群39.1%(9例)〕、鼻咽頭炎〔各々21.3%(10例)、19.6%(9例)、22.2%(6例)、21.7%(5例)〕、白血球減少症〔各々0%(0例)、6.5%(3例)、14.8%(4例)、4.3%(1例)〕、第二度房室ブロック〔各々0%(0例)、0%(0例)、0%(0例)、13.0%(3例)〕、徐脈〔各々0%(0例)、0%(0例)、0%(0例)、13.0%(3例)〕であった。
国内第Ⅱ相継続投与試験における6ヵ月間の重篤な有害事象の発現率は、ジレニア0.5mg群で2.1%(1例)、ジレニア1.25mg※群で0%(0例)、プラセボ-ジレニア0.5mg群で3.7%(1例)、プラセボ-ジレニア1.25mg※群で17.4%(4例)であり、主な重篤な有害事象(いずれかの群で発現率5%以上)は、徐脈〔ジレニア0.5mg群0例、ジレニア1.25mg※群0例、プラセボ-ジレニア0.5mg群0例、プラセボ-ジレニア1.25mg※群8.7%(2例)〕であった。投与中止に至った有害事象の発現率は、ジレニア0.5mg群で4.3%(2例)、ジレニア1.25mg※群で0%(0例)、プラセボ-ジレニア0.5mg群で18.5%(5例)、プラセボ-ジレニア1.25mg※群で13.0%(3例)であり、主な投与中止に至った有害事象(いずれかの群で発現率4%以上)は、血中アルカリホスファターゼ増加〔ジレニア0.5mg群0例、ジレニア1.25mg※群0例、プラセボ-ジレニア0.5mg群0例、プラセボ-ジレニア1.25mg※群4.3%(1例)〕、γ-グルタミルトランスフェラーゼ増加〔各々0例、0例、0例、4.3%(1例)〕、肝機能検査値異常〔各々2.1%(1例)、0例、3.7%(1例)、4.3%(1例)〕、白質脳症〔各々0例、0例、0例、4.3%(1例)〕であった。死亡は、投与12ヵ月後または投与中止3ヵ月後の追加調査時まで認められなかったが、投与中止後から約1年後にジレニア0.5mg群で1例(脳びまん性大細胞型B細胞性リンパ腫、肺、腎および甲状腺のリンパ増殖性障害、皮膚T細胞性リンパ腫)認められた。[社内資料:国内第Ⅱ相継続投与試験(D1201E1試験)〔承認時評価資料〕]
※【ジレニアの用法及び用量】通常、成人にはフィンゴリモドとして1日1回0.5mgを経口投与する。