| 「禁忌を含む注意事項等情報」等はこちらをご参照ください。 |
PANORAMA-HF(国際共同第Ⅱ/Ⅲ相試験)の有効性と安全性
一部承認外の用法及び用量が含まれるデータですが、承認時の評価資料であり、効能又は効果の根拠、用法及び用量の根拠として重要であるためご紹介します。
小児慢性心不全患者におけるエンレストの用量探索試験及び52週投与時のエナラプリルに対する優越性検証試験(国際共同第Ⅱ/Ⅲ相試験:B2319試験)
副次評価項目 Global rank endpointのCategory 1又は2のイベントの初回発現までの時間※1、2(FAS)

調整ハザード比及びp値は、固定効果因子として治療(投与群[エンレスト群、エナラプリル群])を含めた修正年齢グループ及びNYHA/Ross機能分類で層別化したCox比例ハザードモデルに基づく。USMの影響を受けた被験者については治療中の評価を解析に用いた。投与中止はイベントとして扱わなかった。
*:多重性調整なし
a)両側有意水準5%
b)少なくとも1つの事象を有する被験者の数及び%
c)曝露期間で調整した発現率=少なくとも1つのイベントを有する被験者の数/イベント発現又は打ち切りまでの時間の合計
※1:イベントの重症度にかかわらず最初に発現したイベントまでの時間 ※2:独立判定によるイベントに基づく。
FAS:最大の解析対象集団、NYHA:ニューヨーク心臓協会、EAIR:曝露期間で調整した発現率、CI:信頼区間、USM:緊急安全対策
社内資料:小児慢性心不全患者におけるエンレストの用量探索試験及び52週投与時のエナラプリルに対する優越性検証試験
(国際共同第Ⅱ/Ⅲ相試験、B2319試験、CTD2.7.3.3.2.2)[承認時評価資料]
| Global rank endpointについてはこちらをご参照ください |
副次評価項目 52週時のNYHA/Ross機能分類のベースラインからの変化(FAS)
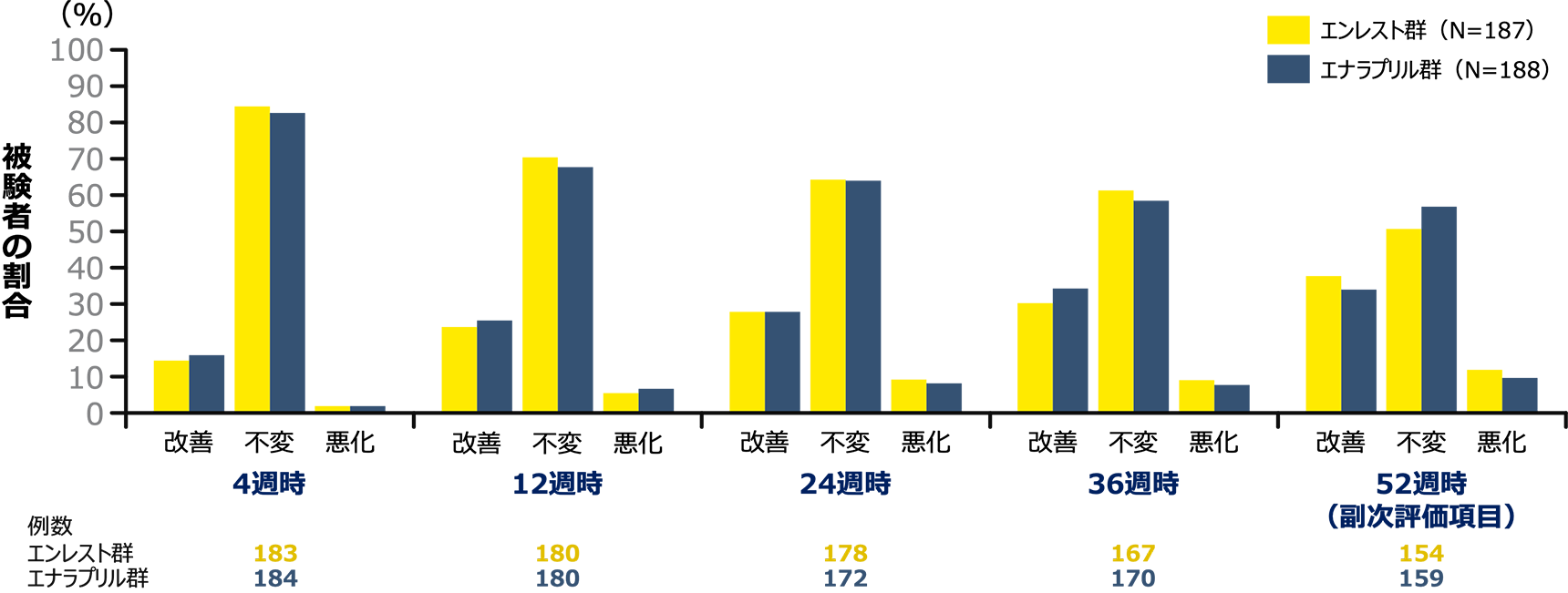
FAS:最大の解析対象集団、 CI:信頼区間、NYHA:ニューヨーク心臓協会、USM:緊急安全対策
社内資料:小児慢性心不全患者におけるエンレストの用量探索試験及び52週投与時のエナラプリルに対する優越性検証試験
(国際共同第Ⅱ/Ⅲ相試験、B2319試験、CTD2.7.3.3.2.2)[承認時評価資料]
| NYHA/Ross機能分類についてはこちらをご参照ください |
副次評価項目 52週時のPGISのベースラインからの変化(FAS)
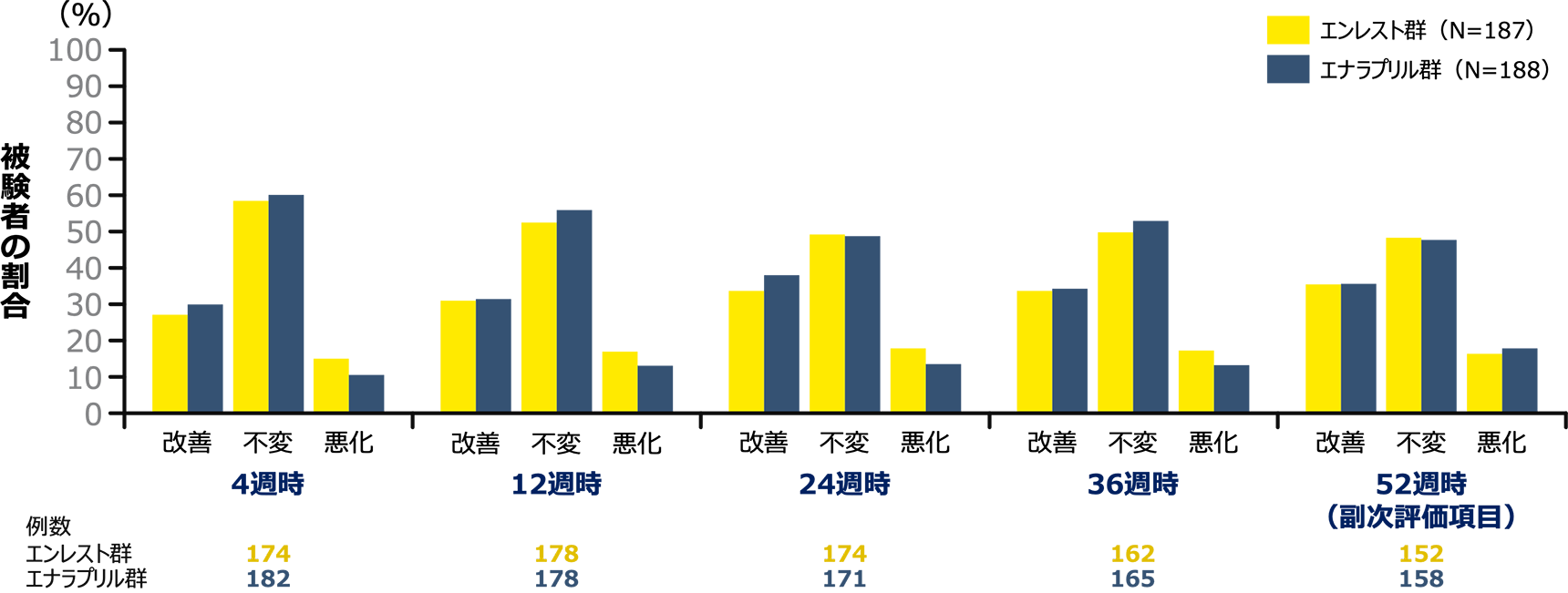
FAS:最大の解析対象集団、PGIS:Patient Global Impression of Severity、CI:信頼区間、USM:緊急安全対策
社内資料:小児慢性心不全患者におけるエンレストの用量探索試験及び52週投与時のエナラプリルに対する優越性検証試験
(国際共同第Ⅱ/Ⅲ相試験、B2319試験、CTD2.7.3.3.2.2)[承認時評価資料]
| PGISについてはこちらをご参照ください |
安全性(SAF)
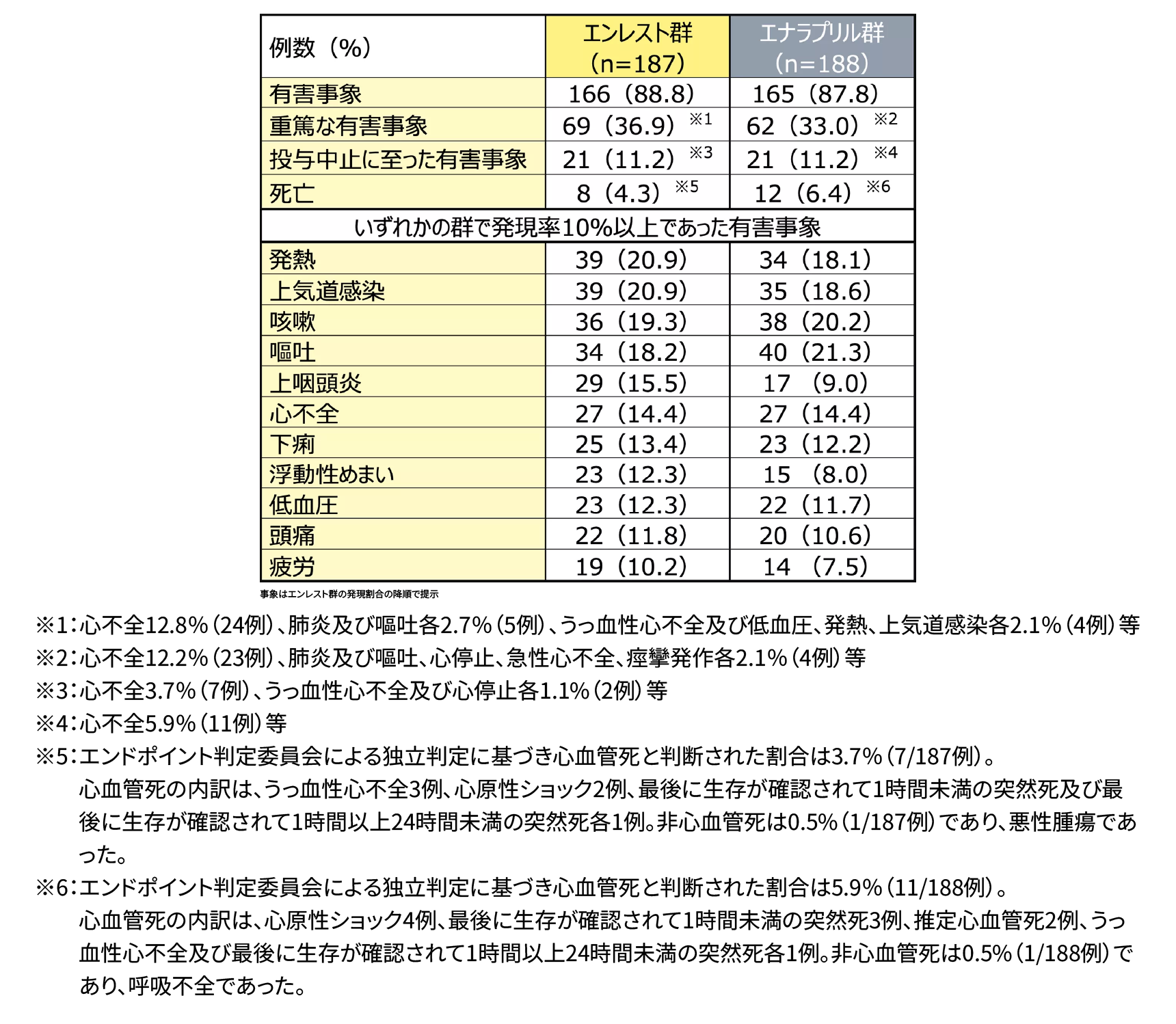
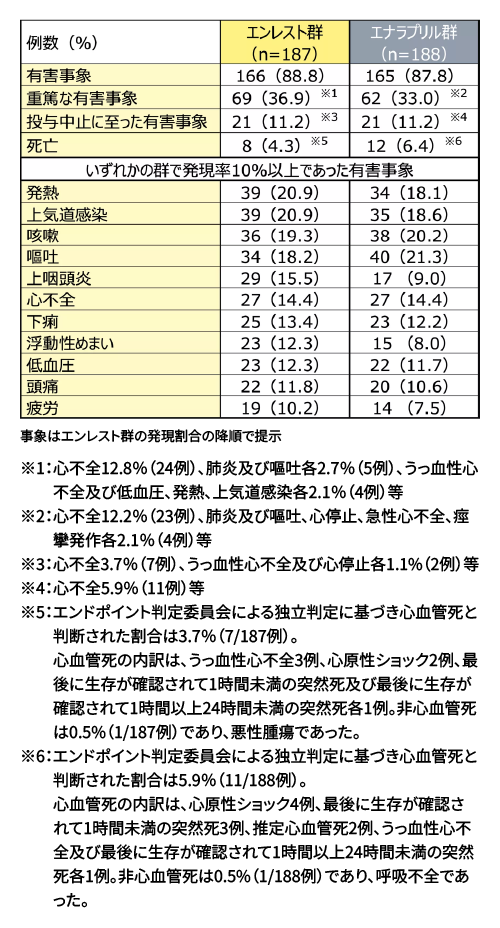
社内資料:小児慢性心不全患者におけるエンレストの用量探索試験及び52週投与時のエナラプリルに対する優越性検証試験
(国際共同第Ⅱ/Ⅲ相試験、B2319試験、CTD2.7.4.2.1)[承認時評価資料]
試験概要
目的
第1期:小児慢性心不全患者におけるエンレストの薬物動態(PK)及び薬力学(PD)を明らかにする。
第2期:小児慢性心不全患者を対象にGlobal rank endpointを指標として、心不全の治療薬としてのエンレストのエナラプリルに対する優越性を検討する。
対象
生後1ヵ月~18歳未満のLVSDによる小児慢性心不全患者(RAN※1377例、FAS※2及びSAF※2ともに375例[日本人12例])
※1:ランダム化番号が割り当てられたすべての被験者(治験薬投与の有無は問わない)
※2:ランダム化されたすべての被験者(誤ってランダム化され治験薬が投与されなかった2名を除く)
<主な選択基準>
- LVSDによる慢性心不全を有し、慢性心不全の治療を受けている(新規診断ではない場合)患者
- スクリーニング前いずれかの時点でNYHA心機能分類がⅡ~Ⅳ度(6歳~18歳未満)又はRoss機能分類がⅡ~Ⅳ度(6歳未満)の患者
- スクリーニング前1ヵ月以内のLVEF≦45%又は左室内径短縮率≦22.5%(LVEF≦40%又は左室内径短縮率≦20%の患者が約80%になるように登録)
- 体心室左室を有する二心室の患者
- 第1期のPK/PD評価について、スクリーニング前にACE阻害薬又はARBの投与を受けている患者。また第1期のPK/PD評価について、Group1(6歳~18歳未満)及びGroup2(1歳~6歳未満)の患者は、サクビトリルバルサルタン3.1mg/kg単回投与の評価前にエナラプリル0.2mg/kg以上又はそれに相当する薬剤を連日投与中であること。さらに第1期のPK/PD評価について、Group3(生後1ヵ月~1歳未満)の患者は、サクビトリルバルサルタン1.6mg/kg単回投与の評価前にエナラプリル0.1mg/kg以上又はそれに相当する薬剤を連日投与中であること
- 心不全の原因として、左室収縮機能障害を伴う先天性心奇形、特発性心筋症、家族性/遺伝性心筋症、心筋炎の既往、神経筋疾患、先天性代謝異常症、ミトコンドリア病、後天性(化学療法、医原性、感染、リウマチ性、栄養障害)、虚血性(例:川崎病、手術後)、左室心筋緻密化障害を含む
<主な除外基準>
- 単心室又は体心室右室の患者
- 本治験への組入れ時点でUNOS心移植待機リストのステータス1Aに登録されている、又は強心薬又は補助人工心臓を使用して移植待機入院中の患者
- 第2期では、スクリーニング来院前3ヵ月以内に先天性心血管奇形を緩和又は修復するための心血管手術又は経皮的インターベンションを受けた患者。第2期への組入れ後の12ヵ月間に心臓の修復手術を受けることが予想される患者
- 未手術の閉塞性又は重度の逆流性弁(大動脈弁、肺動脈弁又は三尖弁)疾患、もしくは重大な左室流出路閉塞又は大動脈弓閉塞を有する患者
- 拘束型又は肥大型心筋症を有する患者
- 症候性低血圧を有するか、スクリーニング時の収縮期血圧が年齢別に算出した収縮期血圧の下位5%分位点未満(例:1歳未満−70mmHg、5歳−80mmHg、10歳以上−90mmHg)の患者
- 血清カリウム高値(>5.3mmol/L)、重大な腎疾患、肝疾患、ADMEに影響を及ぼす可能性のある消化管又は胆道疾患を有する患者
RAN:Randomized set、FAS:最大の解析対象集団、SAF:安全性解析対象集団、NYHA:ニューヨーク心臓協会、 LVEF:左室駆出率、ACE:アンジオテンシン変換酵素、ARB:アンジオテンシンⅡ受容体拮抗薬、PK:薬物動態、PD:薬力学、UNOS:全米臓器配分ネットワーク、ADME:Absorption, Distribution, Metabolism, Excretion
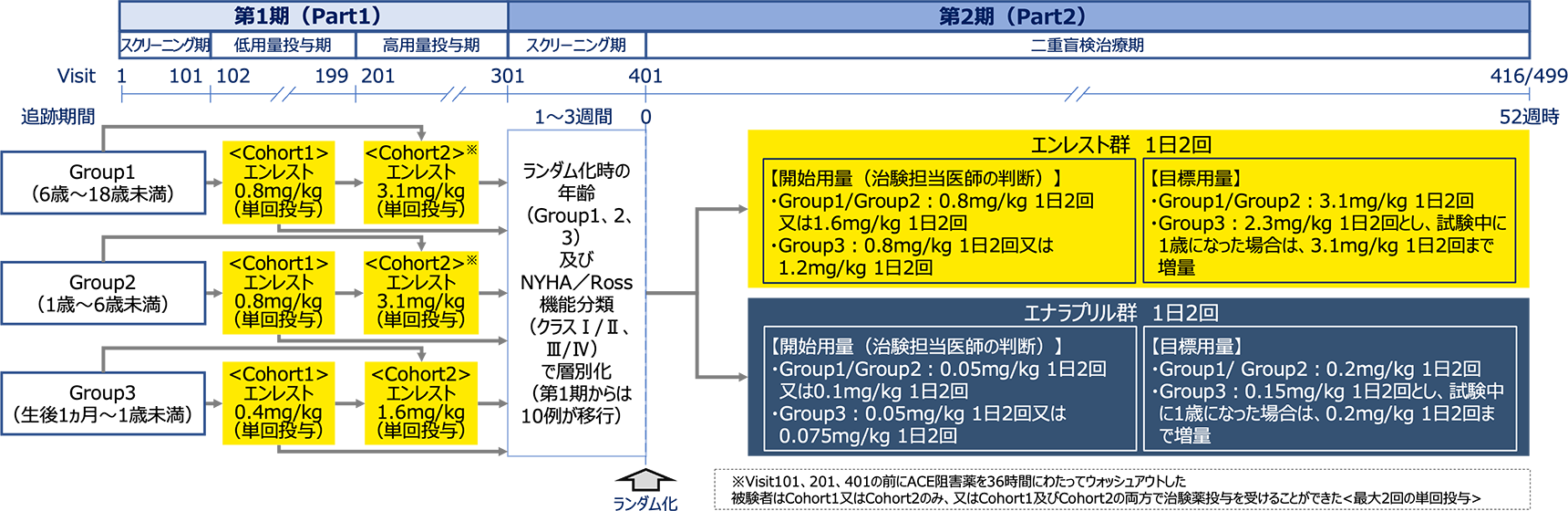
試験デザイン
多施設共同、ランダム化、二重盲検、並行群間、実薬対照比較試験
方法
本試験は第1期(最大2回の単回投与)及び第2期(52週間)の2期で構成された。
被験者の年齢、体重及び服薬能力に基づき、以下の剤形が利用可能であった。
第1期:エンレストの粒状錠(1粒あたりサクビトリルバルサルタン3.125mgを含有する小型フィルムコーティング錠)又は粒状錠の用時懸濁液
第2期:エンレストの錠剤、粒状錠、錠剤を粉砕懸濁した液剤、エナラプリルの錠剤又は錠剤を粉砕懸濁した液剤
第1期(Part1):小児慢性心不全患者26例にエンレストを単回経口投与したときの薬物動態及び薬力学を検討し、第2期(Part2)の用量を選択した。最長3週間のスクリーニング期の後、被験者の組み入れは安全性を考慮して最年長のGroup1(6歳~18歳未満)から開始し、完了後にGroup2(1歳~6歳未満)、Group3(生後1ヵ月~1歳未満)の順に行った。Group1(9例)及び2(9例)では0.8mg/kg(Cohort1)及び3.1mg/kg(Cohort2)、Group3(8例)では0.4mg/kg(Cohort1)及び1.6mg/kg(Cohort2)の各Groupで2用量を単回投与した(被験者はCohort1又はCohort2のみ、又はCohort1及びCohort2の両方で治験薬投与を受けることができた)。
第2期(Part2、二重盲検治療期) :375例をGroup1(6歳~18歳未満)、Group2(1歳~6歳未満)、Group3(生後1ヵ月~1歳未満)に分け、さらにNYHA/Ross機能分類(Ⅰ/Ⅱ度、Ⅲ/Ⅳ度)により層別化し、エンレスト群又はエナラプリル群のいずれかに1:1の比でランダム化し、52週間それぞれを投与した。エンレスト又はエナラプリルを、安全性モニタリング基準に基づき忍容性(症候性低血圧、腎機能悪化、又は高カリウム血症等の有害事象がみられない場合)に応じて目標用量まで盲検下で漸増した。エンレストの開始用量は、治験担当医師の判断に基づき、1歳以上(Group1及び2)で0.8mg/kg 1日2回又は1.6mg/kg 1日2回、1歳未満(Group3)で0.8mg/kg 1日2回又は1.2mg/kg 1日2回とした。目標用量は、1歳以上(Group1及び2)で3.1mg/kg 1日2回とし、1歳未満(Group3)では2.3mg/kg 1日2回としたが、試験中に1歳になった場合は、3.1mg/kg 1日2回まで増量できることとした。エナラプリルの開始用量は、治験担当医師の判断に基づき、1歳以上(Group1及び2)では0.05mg/kg 1日2回又は0.1mg/kg 1日2回、1歳未満(Group3)では0.05mg/kg 1日2回又は0.075mg/kg 1日2回とした。目標用量は、1歳以上(Group1及び2)で0.2mg/kg 1日2回とし、1歳未満(Group3)では0.15mg/kg 1日2回としたが、試験中に1歳になった場合は、0.2mg/kg 1日2回まで増量できることとした。
NYHA:ニューヨーク心臓協会
副次評価項目
- Global rank endpointのCategory 1又は2のイベントの初回発現までの時間
- 52週時のNYHA/Ross機能分類のベースラインからの変化
- 52週時のPGISのベースラインからの変化
NYHA:ニューヨーク心臓協会、PGIS:Patient Global Impression of Severity
解析計画
有効性評価項目はFASを主要な解析対象集団とした。なお、副次評価項目の統計学的検定は両側有意水準5%で行い、多重性の調整は行わなかった。各評価項目について、日本人集団のみを対象としたサブグループ解析も実施した(事前規定)。
副次評価項目(Global rank endpointのCategory 1又は2のイベントの初回発現までの時間):Category 1又は2のイベントの初回発現までの時間は、初回発現日-ランダム化日+1日と定義した。ランダム化時の修正年齢グループ及びNYHA/Ross機能分類で層別化し、投与群(エンレスト群、エナラプリル群)を固定効果因子としたCox比例ハザードモデルを用いて解析した。
副次評価項目 (52週時のNYHA/Ross機能分類のベースラインからの変化):ランダム化時の修正年齢グループ、投与群及びベースライン値を固定効果とした比例累積オッズモデルを用いて解析した。NYHA/Ross機能分類のベースラインからの変化を、投与群、修正年齢グループ、及び来院時期別に要約した。Category 1のイベント発現後の規定来院時の効果は、最悪値として補完した。
副次評価項目 (52週時のPGISのベースラインからの変化):ランダム化時の修正年齢グループ、投与群及びベースライン値を固定効果とした比例累積オッズモデルを用いて解析した。PGISのベースラインからの変化を、投与群、修正年齢グループ、及び来院時期別に要約した。Category 1のイベント発現後の規定来院時の効果は、最悪値として補完した。
FAS:最大の解析対象集団、NYHA:ニューヨーク心臓協会、PGIS:Patient Global Impression of Severity
Global rank endpoint

※1:心不全の悪化は、心不全に対する治療の強化が必要になる新たな症状・徴候あるいは既にみられていた症状・徴候の悪化を示し、特定の症状・徴候を定義するものではない。
※2:心不全の悪化に対する治療には利尿薬、血管拡張薬、昇圧薬、循環作動薬の静脈内投与、機器的補助又は循環補助の施術(限外濾過、血液透析、VAD、ECMO、大動脈内バルーンポンプなど)が含まれる。経口薬の場合は、利尿薬の新規投与又は維持量の50%以上の増量が2週間以上継続する場合に該当する。
NYHA:ニューヨーク心臓協会、PGIS:Patient Global Impression of Severity、 PedsQL:Pediatric Quality of Life Inventory、ICU:集中治療室
NYHA/Ross機能分類
心不全患者の心機能を評価する信頼性の高い評価方法で1-4)、NYHA心機能分類は一般臨床で心不全の重症度分類に用いられるのに対し、Ross機能分類は乳幼児の心不全の重症度分類として用いられる。国際心肺移植学会の小児心不全ガイドライン(2014年)では、NYHA心機能分類及びRoss機能分類ともに心不全の重症度分類として記載されている5)。各クラス分類(I度~IV度)は重症度が大きく異なることから、1クラスの変化は臨床的に意味のある変化を示す2、6)。本試験での評価にあたり、ランダム化時の年齢が6歳以上ではNYHA心機能分類を、6歳未満ではRoss機能分類を用いた。
NYHA:ニューヨーク心臓協会
1)Functional capacity and objective assessment. In: Dolgin M, et al(eds).
Nomenclature and criteria for diagnosis of diseases of the heart and great vessels, 9th edition.
Boston: Little, Brown&Co, p.253-255. 1994
2)Ross RD, et al.: Pediatr Cardiol. 1992; 13(2):72-75.
3)Packer M.: J Card Fail. 2001;7(2): 176-182.
4)Rosenthal D, et al.: J Heart Lung Transplant. 2004; 23(12): 1313-1333.
5)Kirk R, et al.: J Heart Lung Transplant. 2014; 33(9): 888-909.
6)Madsen BK, et al.: Eur Heart J. 1994; 15(3): 303-310.
PGIS
心不全症状の重症度に関する全般的印象を問う患者報告アウトカムで、被験者の現在の健康状態(直近7日間)を把握するために5段階(なし/軽度/中等度/重度/極めて重度)で評価する。PGISの1ポイントの変化は、臨床的に意味のある変化を示す。
PGIS:Patient Global Impression of Severity
社内資料:小児慢性心不全患者におけるエンレストの用量探索試験及び52週投与時のエナラプリルに対する優越性検証試験
(国際共同第Ⅱ/Ⅲ相試験、B2319試験、CTD2.7.6.4.1.1)[承認時評価資料]
社内資料:小児慢性心不全患者におけるエンレストの用量探索試験及び52週投与時のエナラプリルに対する優越性検証試験
(国際共同第Ⅱ/Ⅲ相試験、B2319試験、CTD2.7.3.1.3.2)[承認時評価資料]
社内資料:小児慢性心不全患者におけるエンレストの用量探索試験及び52週投与時のエナラプリルに対する優越性検証試験
(国際共同第Ⅱ/Ⅲ相試験、B2319試験、CTD2.7.3.1.3.3)[承認時評価資料]
Shaddy R, et al.: Circ Heart Fail. 2023; 16(3): e009816.
主要評価項目の結果
Global rank endpointのMann-Whitney確率推定値(95%CI)は0.5244(0.4665、0.5817)であり統計学的な有意差は認められず、優越性は検証されなかった(両側p=0.4238、層別Wilcoxon順位和検定)。
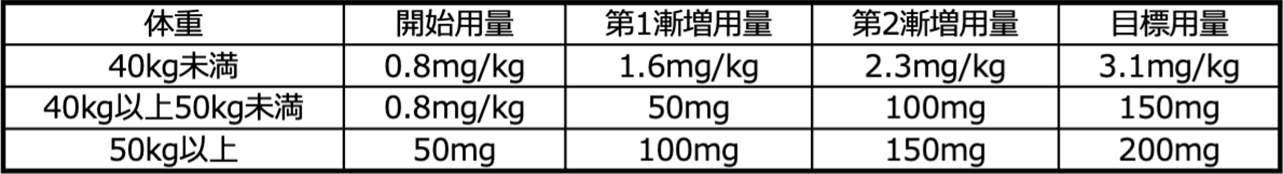
【5. 効能又は効果に関連する注意(抜粋)】 小児における用量表(1回投与量) Image
【9. 特定の背景を有する患者に関する注意(抜粋)】 |

