タフィンラー/メキニスト 悪性黒色腫(メラノーマ)
転移性もしくは根治切除不能(J. Dermatol. 2020)
BRAF V600遺伝子変異陽性進行性悪性黒色腫の日本人患者を対象としたダブラフェニブとトラメチニブ併用療法の実臨床における有効性および安全性
試験方法
目的 : 実臨床下におけるダブラフェニブ・トラメチニブ併用療法の日本人患者に対する有効性と安全性をレトロスペクティブに検討する。
対象 : 2014年2月から2019年3月までの期間、国立がん研究センター中央病院においてダブラフェニブ・トラメチニブ併用療法を行ったBRAF V600E/K遺伝子変異を有する根治切除不能な悪性黒色腫患者50例
試験方法 : ・治療開始時、全症例でダブラフェニブ1回150mgを1日2回、トラメチニブ2mgを1日1回、空腹時に経口投与した。
・治療継続困難な有害事象出現の際には適時休薬、減量を行った。
評価項目 : 奏効率(Overall response rate)、無増悪生存期間(Progression-freesurvival; PFS)、全生存期間(Overall survival; OS) 、安全性
解析計画 : PFS及びOSはKaplan-Meier法を用いたlog-rank検定により統計解析を行った。PFS、OSに関するサブグループ解析も同様にKaplan-Meier法を用いたlog-rank検定により統計解析を行った。奏効率(Overall response rate)はx2検定を用いて統計解析を行った。
Takahashi, A. et al.:J. Dermatol. 2020; 47(3): 257-264【利益相反】なし
奏効率(Overall response rate)
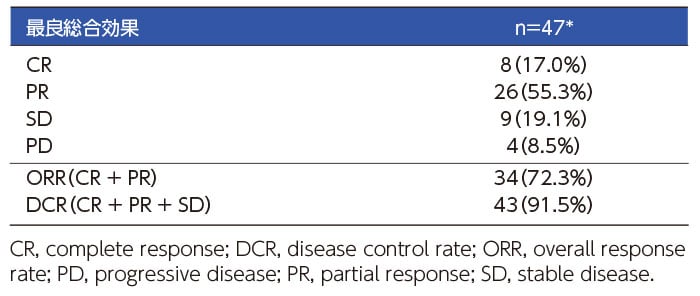
* ベムラフェニブからダブラフェニブ・トラメチニブ併用療法へ切り替えた3症例は有効性評価から除外した。
Limitation
|
Takahashi, A. et al.:J. Dermatol. 2020; 47(3): 257-264【利益相反】なし
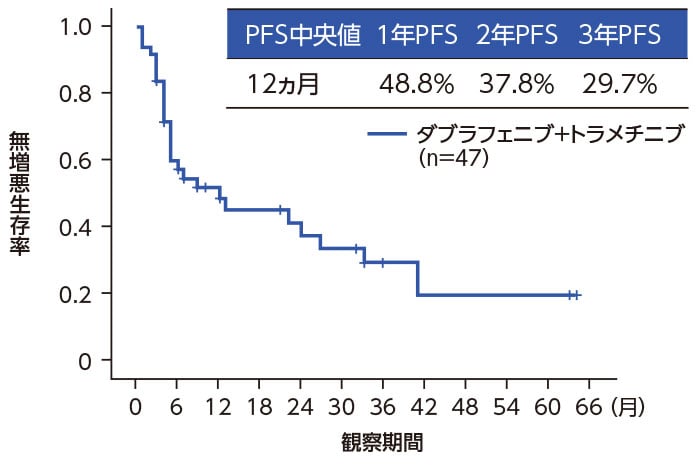
無増悪生存期間(PFS)
全生存期間(OS)
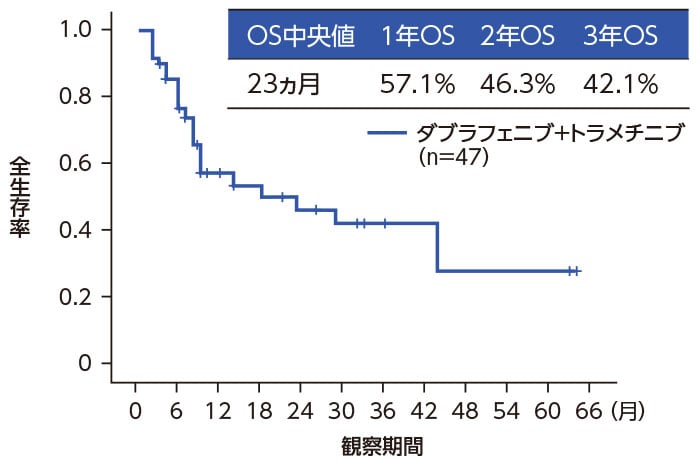
ベムラフェニブからダブラフェニブ・トラメチニブ併用療法へ切り替えた3症例は有効性評価から除外した。
Limitation
|
安全性
- 有害事象は50例中44例(88%)に認められた。主な有害事象としては、発疹28例(56%)、発熱26例(52%)、血中CPK増加12例(24%)等であった。
- 重篤な有害事象は、8例に認められた。主なものとして、血中CPK増加3例、発熱2例及び白血球数減少2例等が認められた。
- 投与中止に至った有害事象は、3例であった。論文中に投与中止に至った有害事象の事象名は記載されていなかった。
- 本試験において有害事象による死亡例は報告されなかった。
Takahashi, A. et al.:J. Dermatol. 2020; 47(3): 257-264【利益相反】なし