エンレスト 作用機序と24時間の血圧推移
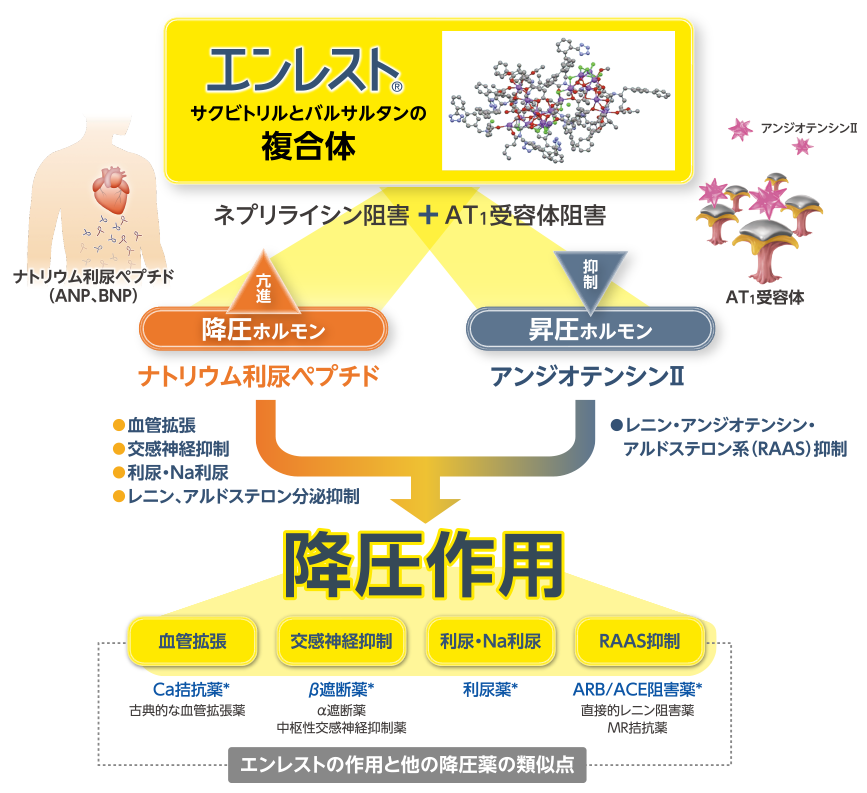
エンレストの作用機序
エンレストは、アンジオテンシンⅡの作用抑制と
ナトリウム利尿ペプチドの作用亢進を併せ持つ降圧薬です
*高血圧治療ガイドライン2019における主要降圧薬
日本高血圧学会高血圧治療ガイドライン作成委員会(編). 高血圧治療ガイドライン2019(JSH2019), p.77, ライフサイエンス出版, 2019
Langenickel TH, Dole WP: Drug Discov Today Ther Strateg. 2012; 9(4): e131-e139
[利益相反]本論文の著者はノバルティスの社員であり、ノバルティスの株式を所有する資格を有します。
Volpe M, et al.: Clin Sci (Lond). 2016; 130(2): 57-77 [利益相反]本研究および著作編集は、ノバルティスの支援を受けました。
 VIDEO
VIDEO
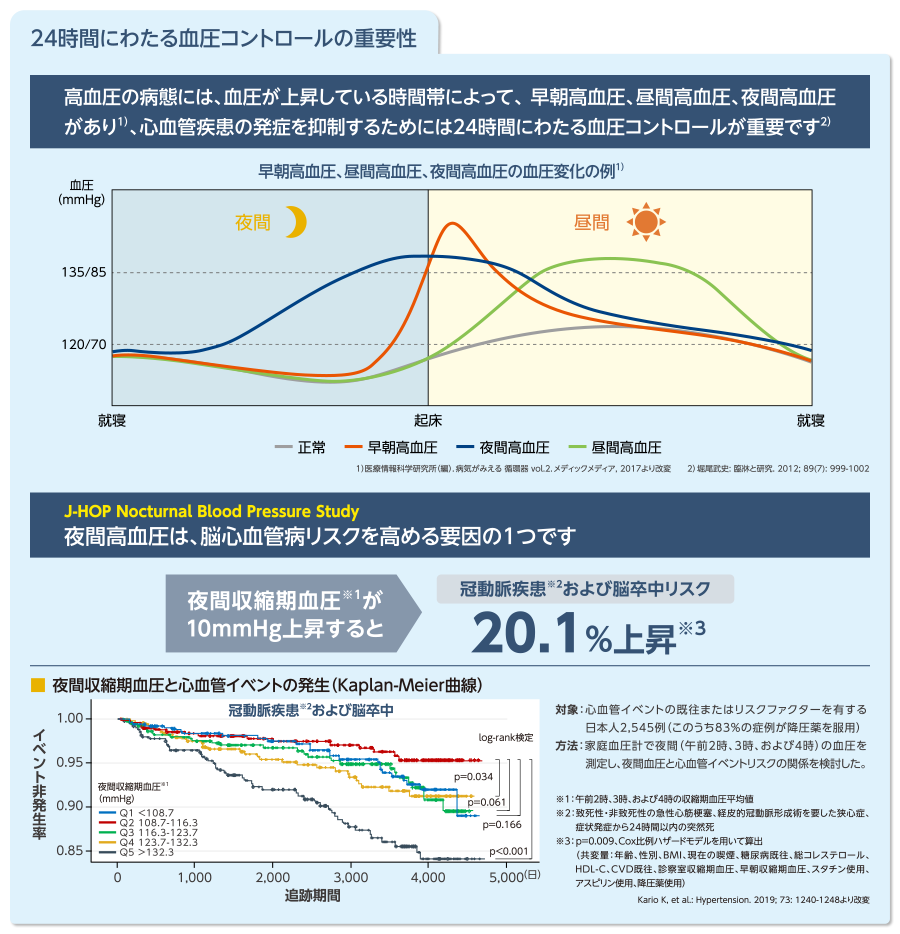
エンレスト投与による24時間の血圧推移
エンレストの投与により、24時間自由行動下血圧測定(ABPM※)による24時間平均収縮期血圧のベースラインからの変化量は、オルメサルタンに比べ有意に低下しました
※Ambulatory Blood Pressure Monitoring
■最終評価時(8週時)におけるABPMによる24時間平均収縮期血圧(maSBP)変化量〔副次評価項目〕(FAS)
最終評価時の24時間maSBPのベースラインからの変化量は、エンレスト200mg群で-13.44mmHg、400mg群で-14.99mmHgであり、 オルメサルタン20mg群の-8.78mmHgと比較し、いずれも有意に低下した(p<0.001、反復測定ANCOVA、共変量:ベースライン値、要因:投与群、投与後時間および投与群と投与後時間との交互作用)。
■最終評価時(8週時)のABPMによる平均収縮期血圧(maSBP)変化量の24時間推移(FAS)
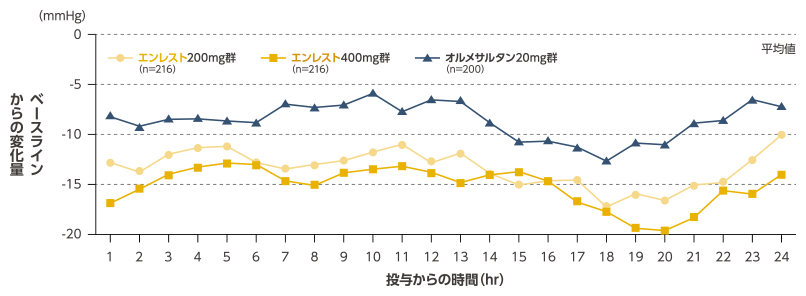
社内資料:日本人高血圧患者におけるエンレストのオルメサルタンに対する優越性検証試験(国内第Ⅲ相試験、A1306試験)[承認時評価資料]
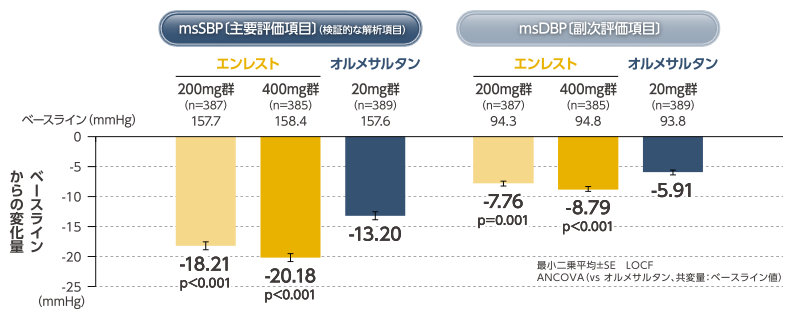
エンレストの臨床成績降圧効果 |
| 【非劣性の確認】 投与群間差(エンレスト200mg群-オルメサルタン20mg群)の最小二乗平均:-5.01mmHg〔95%信頼区間:-6.949,-3.061〕(非劣性限界値:2mmHg) |
社内資料:日本人高血圧患者におけるエンレストのオルメサルタンに対する優越性検証試験(国内第Ⅲ相試験、A1306試験)[承認時評価資料]
Rakugi H, et al.: Hypertens Res. 2022; 45(5): 824-833
[利益相反]本研究はノバルティスから資金提供を受けました。著者のうち4名はノバルティスの社員です。その他にノバルティスからコンサルティング料、講演料等の報酬を受領した著者が含まれます。
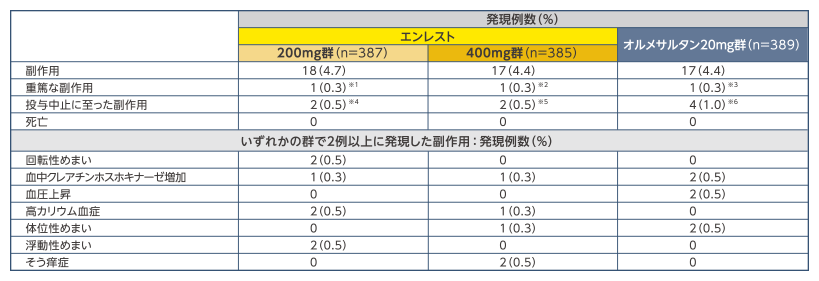
安全性
副作用発現率は、エンレスト200mg群4.7%、同400mg群4.4%、オルメサルタン群4.4%でした
副作用の発現状況(SAF)
※1:くも膜下出血1例 ※2:肝胆道系疾患1例 ※3:白内障1例 ※4:便秘、胃炎、悪心、くも膜下出血、各1例(便秘、胃炎、悪心は同一症例に発現)
※5:肝胆道系疾患、そう痒症、各1例 ※6:高血圧、不安定血圧、血圧上昇、血管浮腫、蕁麻疹、各1例(血管浮腫、蕁麻疹は同一症例に発現)
社内資料:日本人高血圧患者におけるエンレストのオルメサルタンに対する優越性検証試験(国内第Ⅲ相試験、A1306試験)[承認時評価資料]
Rakugi H, et al.: Hypertens Res. 2022; 45(5): 824-833
[利益相反]本研究はノバルティスから資金提供を受けました。著者のうち4名はノバルティスの社員です。その他にノバルティスからコンサルティング料、講演料等の報酬を受領した著者が含まれます。
目的
本態性高血圧患者を対象に、エンレスト200mgの降圧効果について、msSBPのベースラインからの変化量を指標としてオルメサルタン20mgに対する非劣性を確認し、優越性を検証する(検証試験)。
対象
未治療※1または降圧薬治療を受けている※2日本人本態性高血圧患者(FAS※3およびSAF※4ともに1,161例)
方法
多施設共同、ランダム化、二重盲検、実薬対照、並行群間比較試験
観察期(ウォッシュアウト)として、未治療患者では2週間、既治療患者では3~4週間、プラセボを投与した後、エンレスト200mg、同400mg(200mgから開始して1週後に400mgに増量)またはオルメサルタン20mgを1日1回、8週間投与。
評価項目
【主要評価項目】最終評価時(8週時)の平均座位収縮期血圧(msSBP〔トラフ値〕)のベースラインからの変化量
【副次評価項目】最終評価時の平均座位拡張期血圧(msDBP〔トラフ値〕)のベースラインからの変化量、最終評価時の 24時間、昼間および夜間の自由行動下測定による平均収縮期血圧(maSBP)および拡張期血圧(maDBP)のベースラインからの変化量、最終評価時のmsSBP、msDBPのレスポンダー率(msSBP:<140mmHgまたは低下幅≧20mmHg、msDBP: <90mmHgまたは低下幅≧10mmHg) など
解析計画
有効性評価項目はFASを主要な解析対象集団とした。また、欠損値はLOCFを用いて補完した。
【主要評価項目(msSBPのベースラインからの変化量)】オルメサルタン20mgに対するエンレスト200mgの非劣性を確認し、非劣性が確認された場合に優越性を検証した。群間差(エンレスト200mg群-オルメサルタン20mg群)=2mmHgを非劣性限界とし、投与群を要因とするANCOVA(共変量:ベースライン値)を用いて群間比較を実施した(有意水準は片側0.025)。優越性の検証は同ANCOVAを用いて群間比較を行った(有意水準は両側0.05)。
【副次評価項目】
- msDBPのベースラインからの変化量:投与群を要因とするANCOVA(共変量:ベースライン値)を用いて群間比較を実施した(有意水準は両側0.05)。
- maSBPのベースラインからの変化量:ABPMの1時間ごとの平均値を算出し、投与群、投与後時間および投与群と投与後時間との交互作用を要因とする反復測定ANCOVA(共変量:ベースライン値)を用いて群間比較を実施した。
- レスポンダー率:ロジスティック回帰モデルを用いて群間比較を行った。msSBP/msDBPおよびmsSBPの解析では、msSBPのベースライン値を共変量とした。
【事後解析】「高血圧治療ガイドライン2019(JSH2019)」で改訂された降圧目標※5のうち、年齢(75歳未満、75歳以上) 別の目標値に注目したレスポンダー率などを算出した。
※1:新たに本態性高血圧症と診断された患者または高血圧症の既往歴を有するが、少なくともスクリーニングの4週間前から降圧薬を使用していない患者で、スクリーニング時およびランダム化時の外来測定によるmsSBP がともに≧150mmHg、<180mmHg
※2:スクリーニング前4週間以内に降圧薬を使用した患者で、ランダム化時の外来測定によるmsSBPが≧150mmHg、<180mmHg、かつランダム化直前の来院時の外来測定によるmsSBPが≧140mmHg、<180mmHg
※3:ランダム化されたすべての被験者
※4:ランダム化された被験者のうち治療期に治験薬を1回以上投与されたすべての被験者
※5:msSBPは75歳未満で<130mmHg、75歳以上で<140mmHg、msDBPは75歳未満で<80mmHg、75歳以上で<90mmHg
| オルメサルタンの用法及び用量 通常、成人にはオルメサルタン メドキソミルとして10~20mgを1日1回経口投与する。なお、1日5~10mgから投与を開始し、年齢、症状により 適宜増減するが、1日最大投与量は40mgまでとする。 |
| 7. 用法及び用量に関連する注意(抜粋)〈高血圧症〉 7.3 本剤はサクビトリル及びバルサルタンに解離して作用する薬剤であるため、本邦のバルサルタンの承認用法及び用量での降圧効果、本剤の降圧効果を理解した上で、患者の状態、他の降圧薬による治療状況等を考慮し、本剤適用の可否を慎重に判断するとともに、既存治療の有無によらず1回100mgを1日1回からの開始も考慮すること。[17.1.3 参照] 7.4 慢性心不全を合併する高血圧症患者では、原則として慢性心不全の用法及び用量に従うこととするが、慢性心不全の発症に先んじて高血圧症の治療目的で本剤を使用している場合等は、患者の状態に応じて適切に用法及び用量を選択すること。 |
社内資料:日本人高血圧患者におけるエンレストのオルメサルタンに対する優越性検証試験(国内第Ⅲ相試験、A1306試験)[承認時評価資料]
Rakugi H, et al.: Hypertens Res. 2022; 45(5): 824-833
[利益相反]本研究はノバルティスから資金提供を受けました。著者のうち4名はノバルティスの社員です。その他にノバルティスからコンサルティング料、講演料等の報酬を受領した著者が含まれます。