非小細胞肺がん 臨床成績
| 「警告・禁忌を含む注意事項等情報」等はこちらをご参照ください |
タフィンラーの【用法及び用量】(抜粋)は以下の通りです。 【用法及び用量】:〈非小細胞肺癌〉 |
国際共同第Ⅱ相臨床試験(E2201試験)1-4)
1)社内資料:国際共同第II相臨床試験(E2201試験)<承認時評価資料>(2018年3月23日承認、CTD2.7.6.4.2.1.)
2)Planchard D, et al.: Lancet Oncol 17(7): 984-93(2016)
【利益相反:ノバルティス社員が著者に4名含まれている。ノバルティスより謝礼金やアドバイザリー料、研究助成を受領している著者が6名含まれている。編集及び報告書の作成費用はノバルティスが負担した。】
3)Planchard D, et al.: Lancet Oncol 18(10): 1307-16(2017)
【利益相反:本研究はノバルティスの支援で実施した。ノバルティス社員が著者に4名含まれている。ノバルティスより謝礼金やアドバイザリー料、研究助成を受領している著者が4名含まれている。メディカルライティング・編集の費用はノバルティスが負担した。】
4)Planchard D, et al.: J Thorac Oncol 17(1): 103-15(2022)
【利益相反:本研究はノバルティスの支援で実施した。ノバルティス社員が著者に4名含まれている。ノバルティスより謝礼金やアドバイザリー料、研究助成を受領している著者が8名含まれている。メディカルライティング・編集の費用はノバルティスが負担した。】
| 本試験には本邦において、承認外用法のタフィンラー単独群が含まれていますが、承認時評価資料のため、解析結果を承認の範囲内の症例群のみに限定し、一部改変の上、紹介します。 |
試験デザイン
試験デザイン
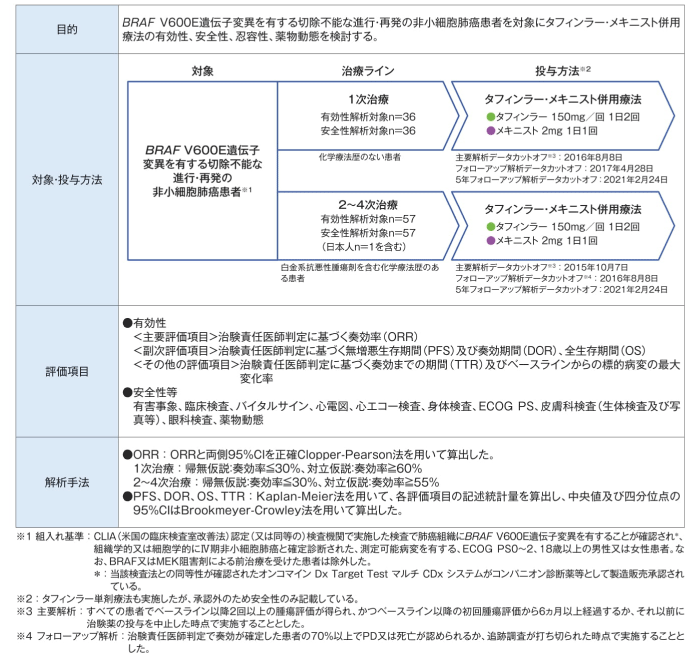
患者背景
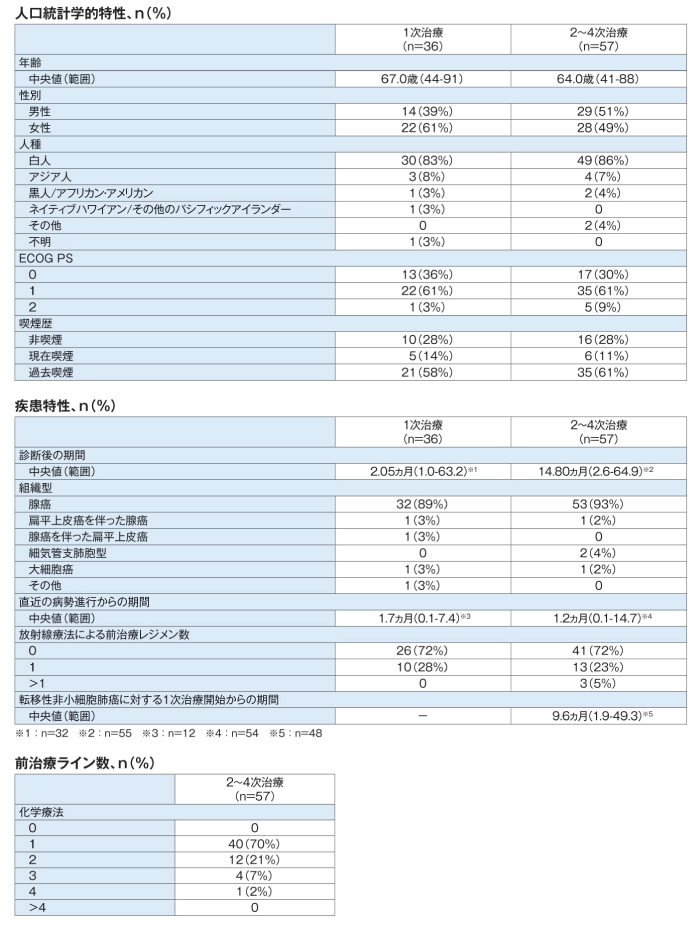
有効性
(1)奏効率(ORR)[主要評価項目]
ORR(95%CI)は、1次治療では主要解析時点で61.1%(43.5-76.9)※、フォローアップ解析時点で64%(46-79)、2~4次治療では主要解析時点で63.2%(49.3-75.6)※、フォローアップ解析時点で66.7%(52.9-78.6)であった。
※:点推定値は対立仮説より高く、95%CIの下限値は帰無仮説より高かった。
ORR
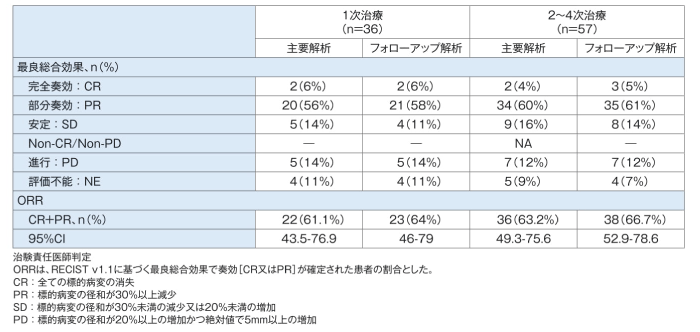
(2)標的病変のベースラインからの最大変化率[その他の評価項目]
1次治療では主要解析時点で97.1%(33/34例)で標的病変が縮小し、76.5%(26/34例)で30%以上の縮小が認められ、17.6%(6/34例)で標的病変が消失し、5年フォローアップ解析時点では30%以上の縮小が認められた患者が79.4%(27/34例)と増加した。2~4次治療では主要解析時点で88.9%(48/54例)で標的病変が縮小し、72.2%(39/54例)で30%以上の縮小が認められ、9.3%(5/54例)で標的病変が消失し、5年フォローアップ解析時点では30%以上の縮小が認められた患者が74.5%(41/55例)と増加した。
1次治療(5年フォローアップ解析時点)
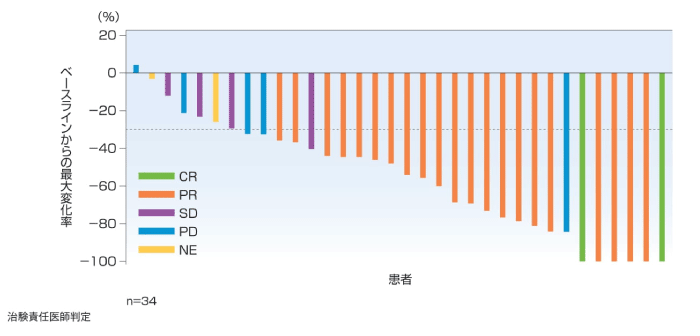
2~4次治療(5年フォローアップ解析時点)
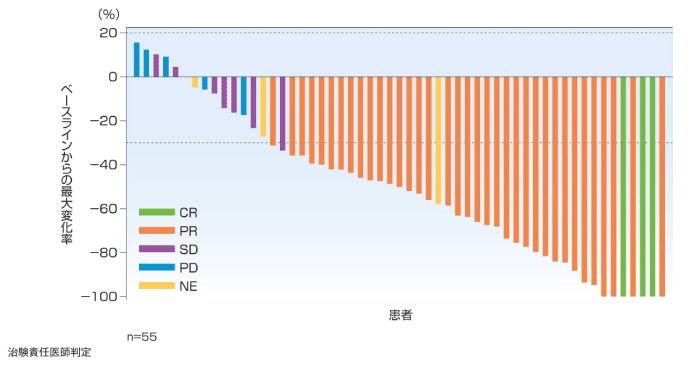
標的病変の最大変化率は、ベースライン後からPDと判定された日又は新たな抗腫瘍療法の開始日のいずれか早い時点までに認められた標的病変の最小径和のベースラインからの変化率とした。治験責任医師判定でベースライン時に測定可能病変が認められ、かつベースライン後に少なくとも1回の適切な腫瘍評価が行われた患者を対象とした。
(3)奏効期間(DOR)[副次評価項目]
1次治療の主要解析時点では主要評価項目である奏効率(ORR)の判定においてCR又はPRが確定した22例中15例で追跡調査継続中に評価打ち切りとなり、DORが推定できなかったが、5年フォローアップ解析時点ではDORの中央値(95%CI)(CR又はPRが確定した患者数)は10.2ヵ月(8.3-15.2)(n=23)であった。2~4次治療のDORの中央値(95%CI)(CR又はPRが確定した患者数)は、主要解析時点で9.0ヵ月(6.9-18.3)(n=36)、5年フォローアップ解析時点で9.8ヵ月(6.9-18.3)(n=39)であった。
DOR
1次治療(5年フォローアップ解析時点)
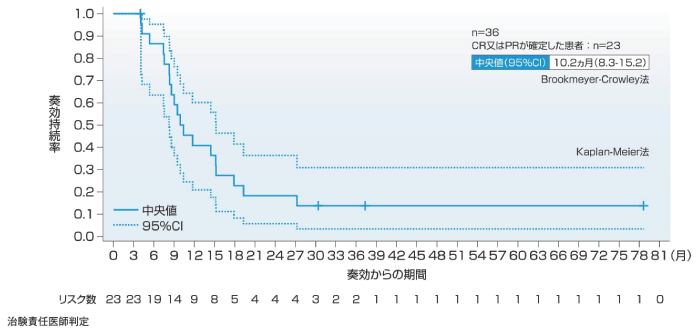
DOR
2~4次治療(5年フォローアップ解析時点)
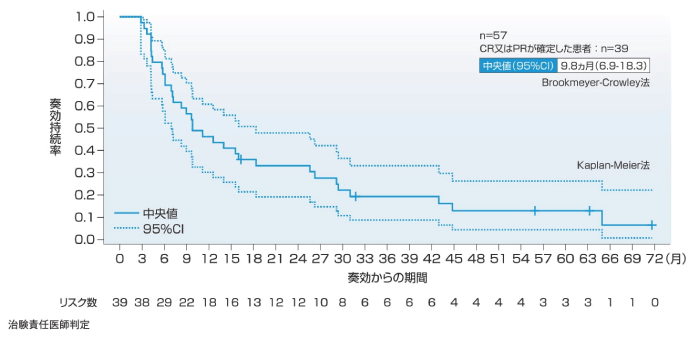
DORは、奏効が確定した患者を対象とし、総合効果で最初に奏効と判定された日からPDと判定された日又は死亡日(死因を問わない)のいずれか早い時点までの期間とした。
(4)奏効までの期間(TTR)[その他の評価項目]
TTRの中央値(95%CI)は、1次治療では主要解析時点で1.4ヵ月(1.4-1.5)、2~4次治療では主要解析時点で1.4ヵ月(1.3-1.5)であった。
TTR(主要解析時点)

(5)無増悪生存期間(PFS)[副次評価項目]
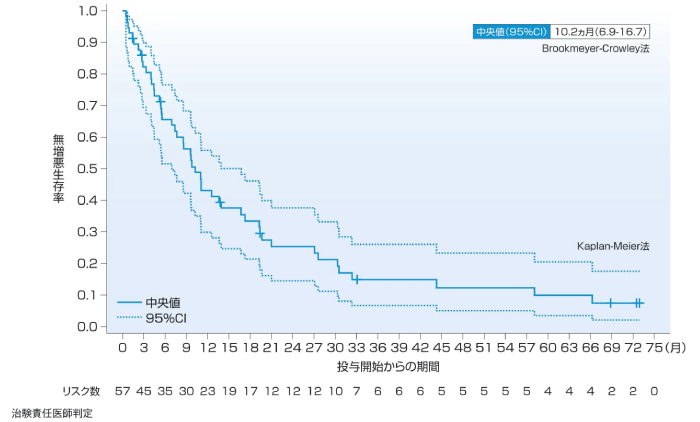
1次治療の主要解析時点では主要評価項目である奏効率(ORR)の判定においてCR又はPRと確定した36例中23例で追跡調査継続中に評価打ち切りとなり、PFSが推定できなかったが、5年フォローアップ解析時点のPFSの中央値(95%CI)は10.8ヵ月(7.0-14.5)であった。2~4次治療のPFSの中央値(95%CI)は、主要解析時点で9.7ヵ月(6.9-19.6)、5年フォローアップ解析時点で10.2ヵ月(6.9-16.7)であった。
PFS

PFS
1次治療(5年フォローアップ解析時点)
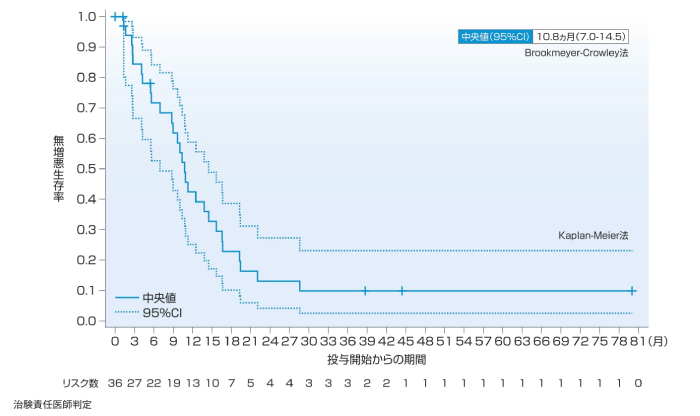
PFS
2~4次治療(5年フォローアップ解析時点)
(6)全生存期間(OS)[副次評価項目]
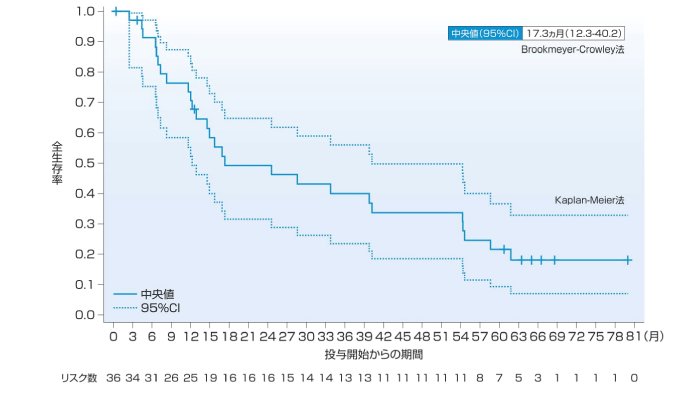
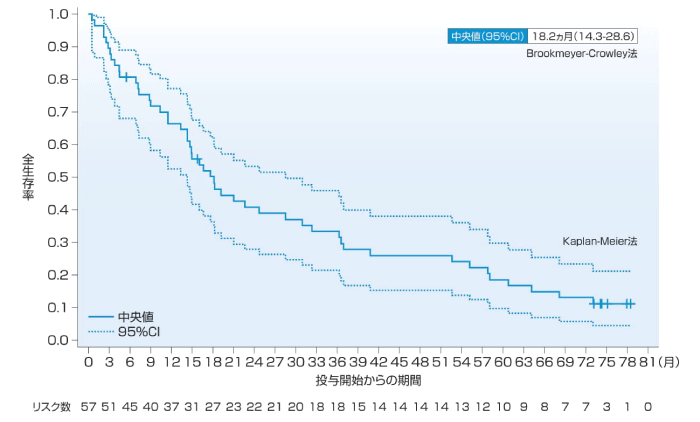
OSの中央値(95%CI)は、1次治療では主要解析時点で24.6ヵ月(11.7-NE)、5年フォローアップ解析時点で17.3ヵ月(12.3-40.2)、4年生存率は34%、5年生存率は22%であった。2~4次治療のOSの中央値(95%CI)は、主要解析時点で17.6ヵ月(14.3-NE)、5年フォローアップ解析時点で18.2ヵ月(14.3-28.6)、4年生存率は26%、5年生存率は19%であった。
OS

OS
1次治療(5年フォローアップ解析時点)
OS
2~4次治療(5年フォローアップ解析時点)
安全性
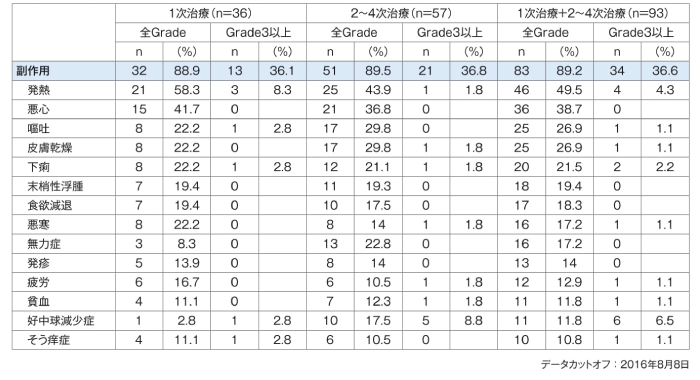
副作用は、1次治療32/36例(88.9%)、2~4次治療51/57例(89.5%)に認められた。主な副作用は、1次治療で発熱21例(58.3%)、悪心15例(41.7%)、嘔吐、皮膚乾燥、下痢、悪寒が各8例(22.2%)等、2~4次治療で発熱25例(43.9%)、悪心21例(36.8%)、嘔吐及び皮膚乾燥が各17例(29.8%)等であった。
1次治療及び2〜4次治療においては、死亡に至った副作用は認められなかった。重篤な有害事象(因果関係を問わない事象)は、1次治療21例(58.3%)、2~4次治療35例(61.4%)に認められた。主なものは、1次治療ではアラニンアミノトランスフェラーゼ増加及び発熱が各4例、アスパラギン酸アミノトランスフェラーゼ増加及び駆出率減少が各3例等、2~4次治療では発熱9例、駆出率減少4例、貧血及び悪心が各3例等であった。投与中止に至った有害事象(因果関係を問わない事象)は、1次治療7例(19.4%)、2~4次治療12例(21.1%)に認められた。主なものは、1次治療では発熱2例等、2~4次治療では駆出率減少及び呼吸窮迫が各2例等であった。
(データカットオフ:2016年8月8日)
なお、タフィンラー単剤療法※における副作用は77/84例(91.7%)に認められた。主な副作用は、過角化23例(27.4%)、悪心21例(25.0%)、皮膚乳頭腫20例(23.8%)等であった。
タフィンラー単剤療法における死亡に至った副作用として、頭蓋内出血が1例に認められた。重篤な有害事象(因果関係を問わない事象)は、タフィンラー単剤療法で36例(42.9%)に認められ、主なものは、皮膚有棘細胞癌8例、発熱5例、基底細胞癌4例等であった。投与中止に至った有害事象(因果関係を問わない事象)は、タフィンラー単剤療法で6例(7.1%)に認められ、主なものは、水疱、悪寒、全身健康状態低下、頭蓋内出血、倦怠感及び手掌・足底発赤知覚不全症候群が各1例であった。
(データカットオフ:2015年10月7日)
※:承認外用法・用量
副作用(1次治療及び2〜4次治療で10%以上に発現)
タフィンラーの【用法及び用量】(抜粋)は以下の通りです。 【用法及び用量】:〈非小細胞肺癌〉 |