Sobre leucemia mieloide aguda
Sanz MA, Carreras E. Manual Práctico de hematología Clínica. Capítulo 3.3. Leucemia mieloide aguda (6ª edición). 2019. Disponible en: https://www.go-space.es/hematologia/C03leucemiamieloide2019.pdf
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30.
Visser O, Trama A, Maynadie M, et al. Incidence, survival and prevalence of myeloid malignancies in Europe. Eur J Cancer. 2012;48(17):3257-66.
Juliusson G, et al. Blood 2009;113(18): 4179-4187
Alteraciones cromosómicas congénitas: síndrome de Down, síndrome de Klinefelter y síndromes de roturas cromosómicas (síndrome de Bloom, anemia de Fanconi).
Enfermedades hematológicas pre-leucémicas: síndromes mielodisplásicos (SMD), neoplasias mieloproliferativas crónicas (NMPC), y aplasia medular.
Exposición a radiaciones ionizantes o a productos químicos (benceno, disolventes).
Tratamiento previo con agentes alquilantes, inhibidores de las topoisomerasas, epipodofilotoxinas y a cualquier citostático.
Tratamiento previo con otros fármacos (inmunomoduladores/inmunosupresores cloranfenicol, fenilbutazona…).
Causa hereditaria (4% de los casos).
Sanz MA, Carreras E. Manual Práctico de hematología Clínica. Capítulo 3.3. Leucemia mieloide aguda (6ª edición). 2019. Disponible en: https://www.go-space.es/hematologia/C03leucemiamieloide2019.pdf
Sanz MA, Carreras E. Manual Práctico de hematología Clínica. Capítulo 3.3. Leucemia mieloide aguda (6ª edición). 2019. Disponible en: https://www.go-space.es/hematologia/C03leucemiamieloide2019.pdf
Reacciones adversas a medicamentos.
Hábitos tóxicos.
Comorbilidades.
Antecedentes de propios y familiares de neoplasia.
Hemorragias e infecciones.
Apoyo familiar/social.
Medicamentos que toma el paciente.
Sanz MA, Carreras E. Manual Práctico de hematología Clínica. Capítulo 3.3. Leucemia mieloide aguda (6ª edición). 2019. Disponible en: https://www.go-space.es/hematologia/C03leucemiamieloide2019.pdf
Hwang SM. Classification of acute myeloid leukemia. Blood Res. 2020;55(S1):S1-S4. doi:10.5045/br.2020.S001
Paes, R.D., da Costa, D.C.R., Viana, J.F., Watanabe, H.M. (2022). Hematological Diseases. In: Schmidt, C.W.P., Otoni, K.M. (eds) The Golden Guide to Oncologic Pharmacy. Springer, Cham. https://doi.org/10.1007/978-3-030-98596-7_3
Sanz MA, Carreras E. Manual Práctico de hematología Clínica. Capítulo 3.3. Leucemia mieloide aguda (6ª edición). 2019. Disponible en: https://www.go-space.es/hematologia/C03leucemiamieloide2019.pdf
Döhner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017;129(4):424-447.
Concepto e Incidencia
Concepto
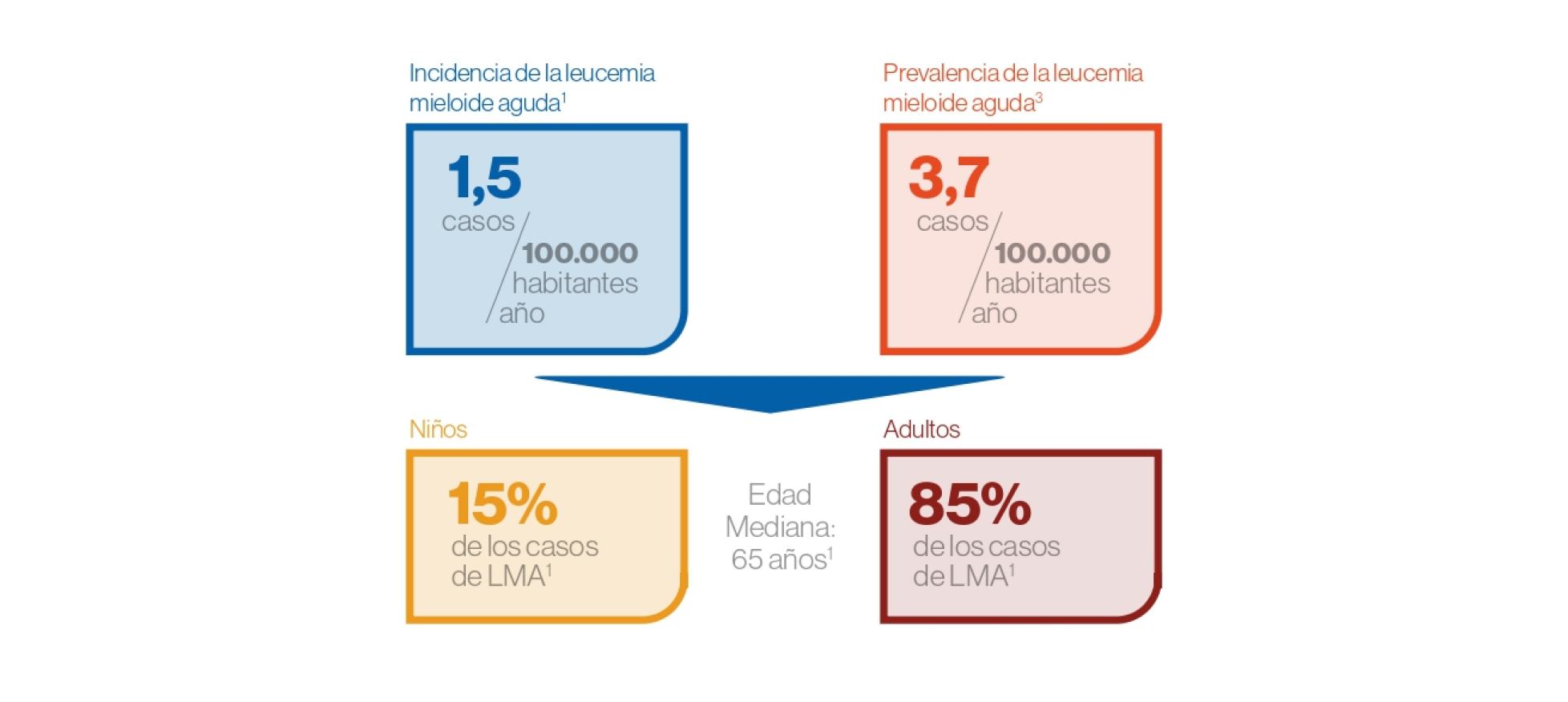
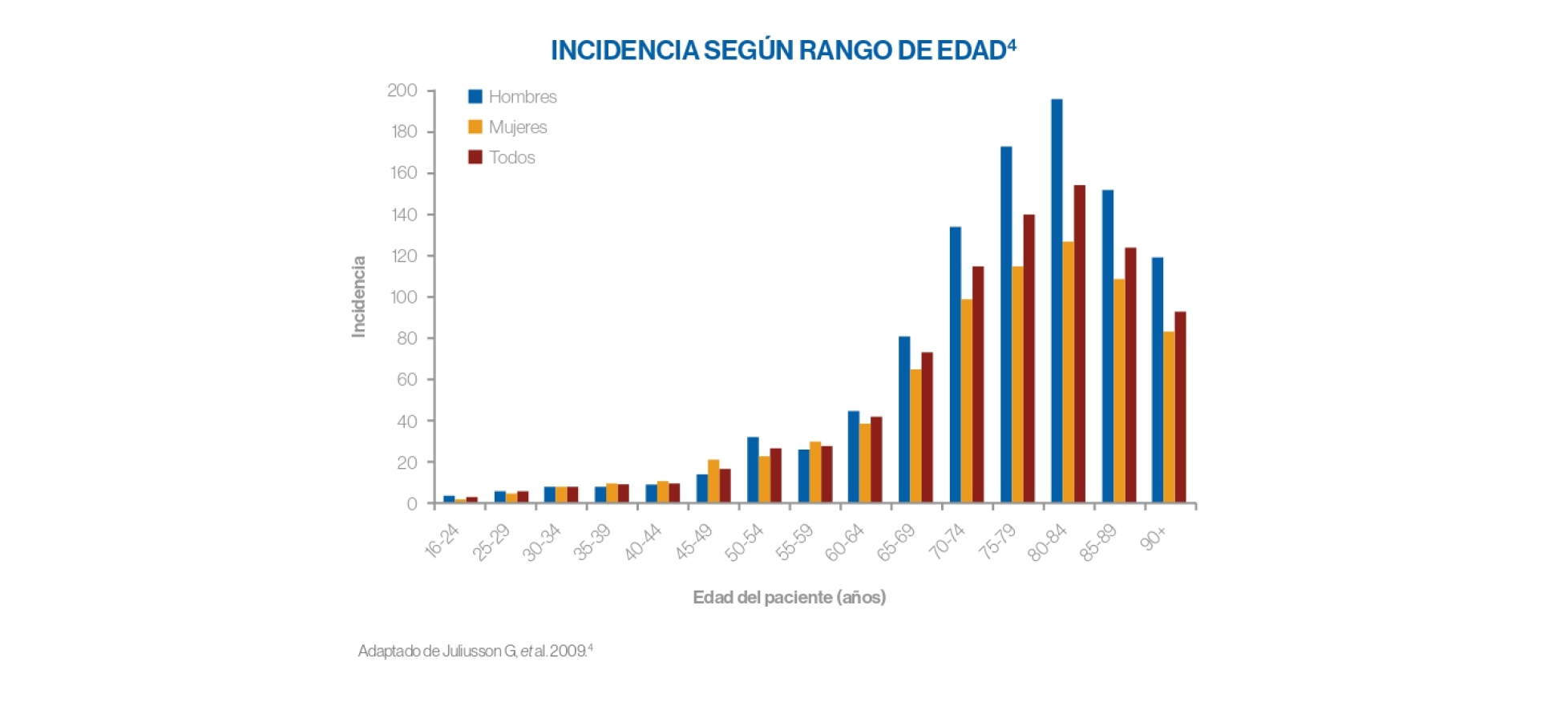
Epidemiología
Referencias
Fisiopatología
Patogenia
La LMA se desarrolla como consecuencia de una serie de cambios genéticos en los precursores mieloides que alteran su proliferación y diferenciación. Existe la hipótesis de los dos “hits” que implica que la LMA se desarrolla a consecuencia de al menos dos mutaciones:1
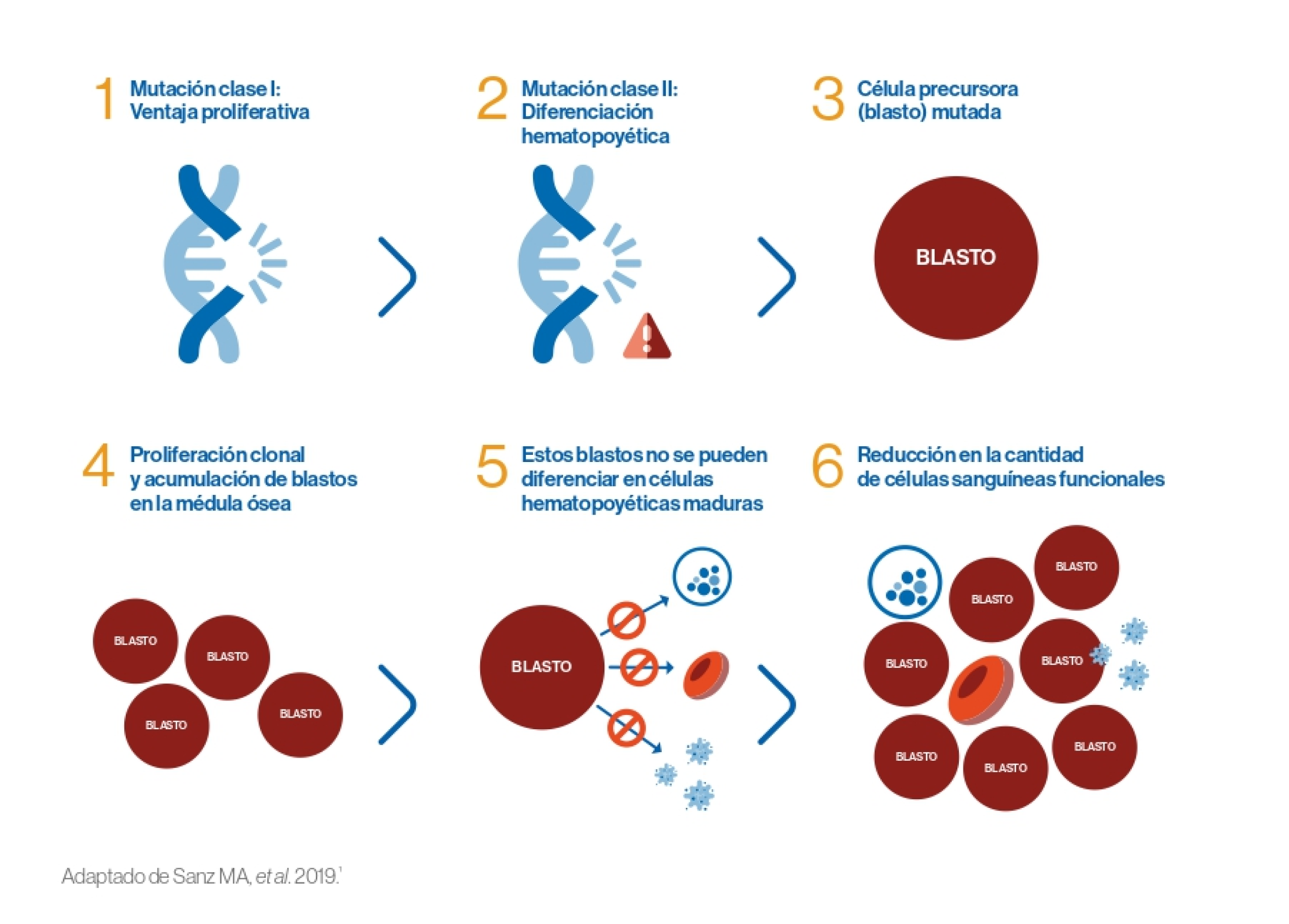
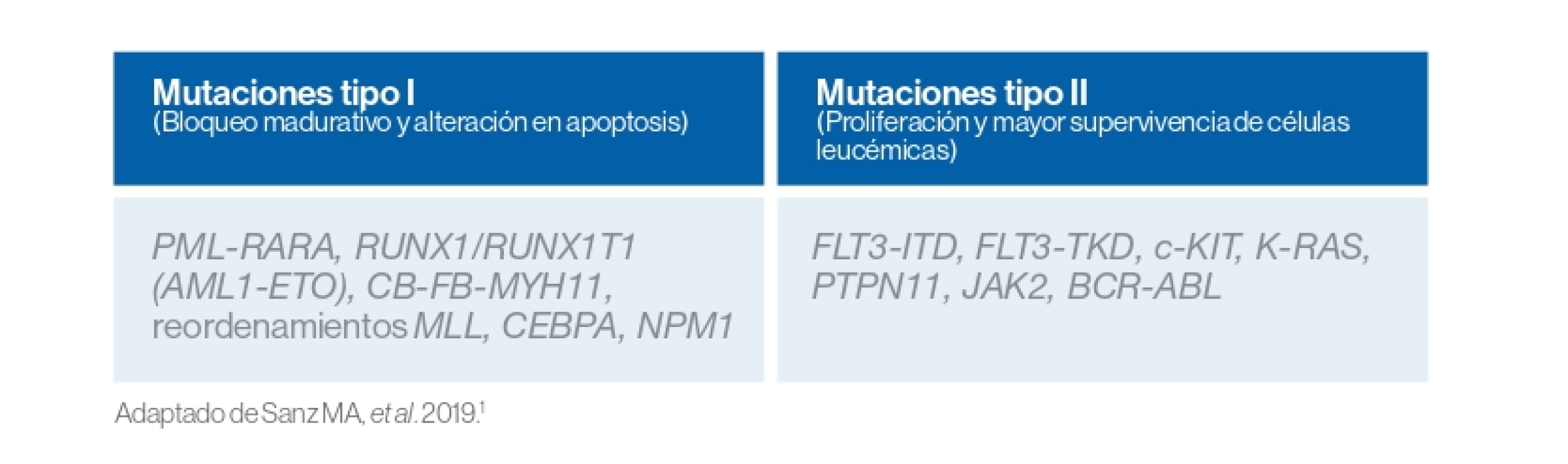
Los dos tipos de mutaciones implicadas en estos dos “hits” se pueden clasificar de la siguiente manera:1
Etiología
La etiología de la LMA es desconocida, aunque se han descrito diversos factores que contribuyen a la aparición de esta enfermedad:1
Referencia
Presentación clínica
Se pueden distinguir, por sus implicaciones terapéuticas, dos grupos de pacientes con LMA con diferentes características:1
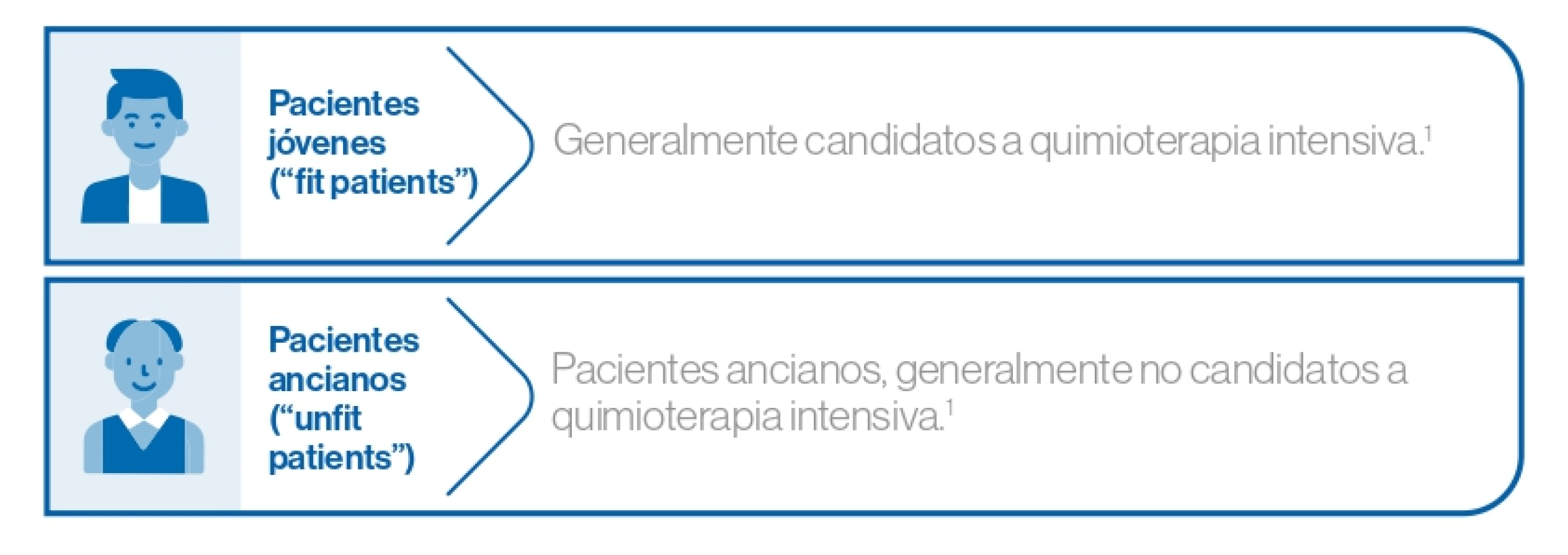
Cuanto mayores los pacientes, más frecuentes son las comorbilidades, peor el estado general (ECOG) y más frecuente es el antecedente de neoplasia previa (>30% en pacientes ancianos).1
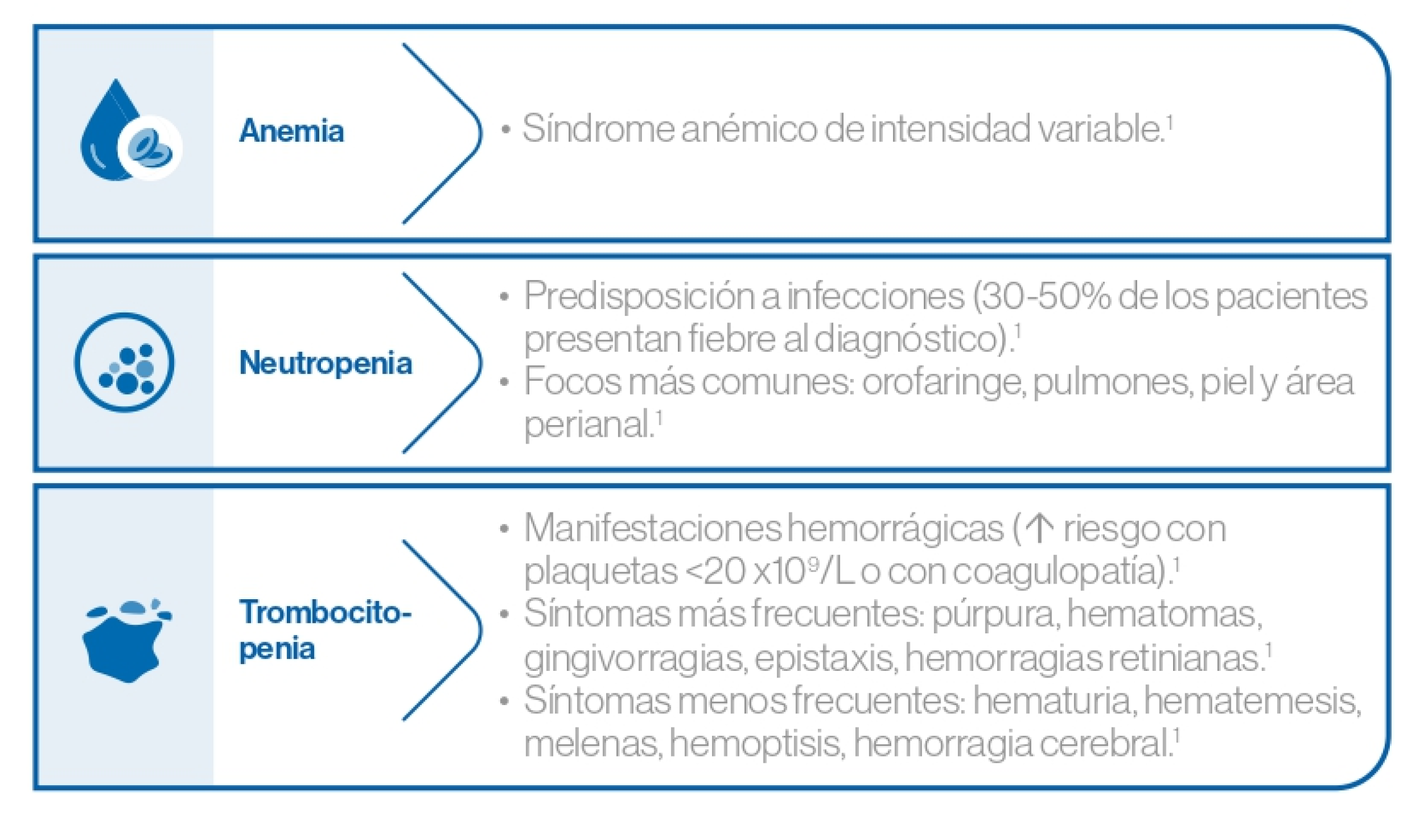
Manifestaciones clínicas relacionadas con la insuficiencia medular
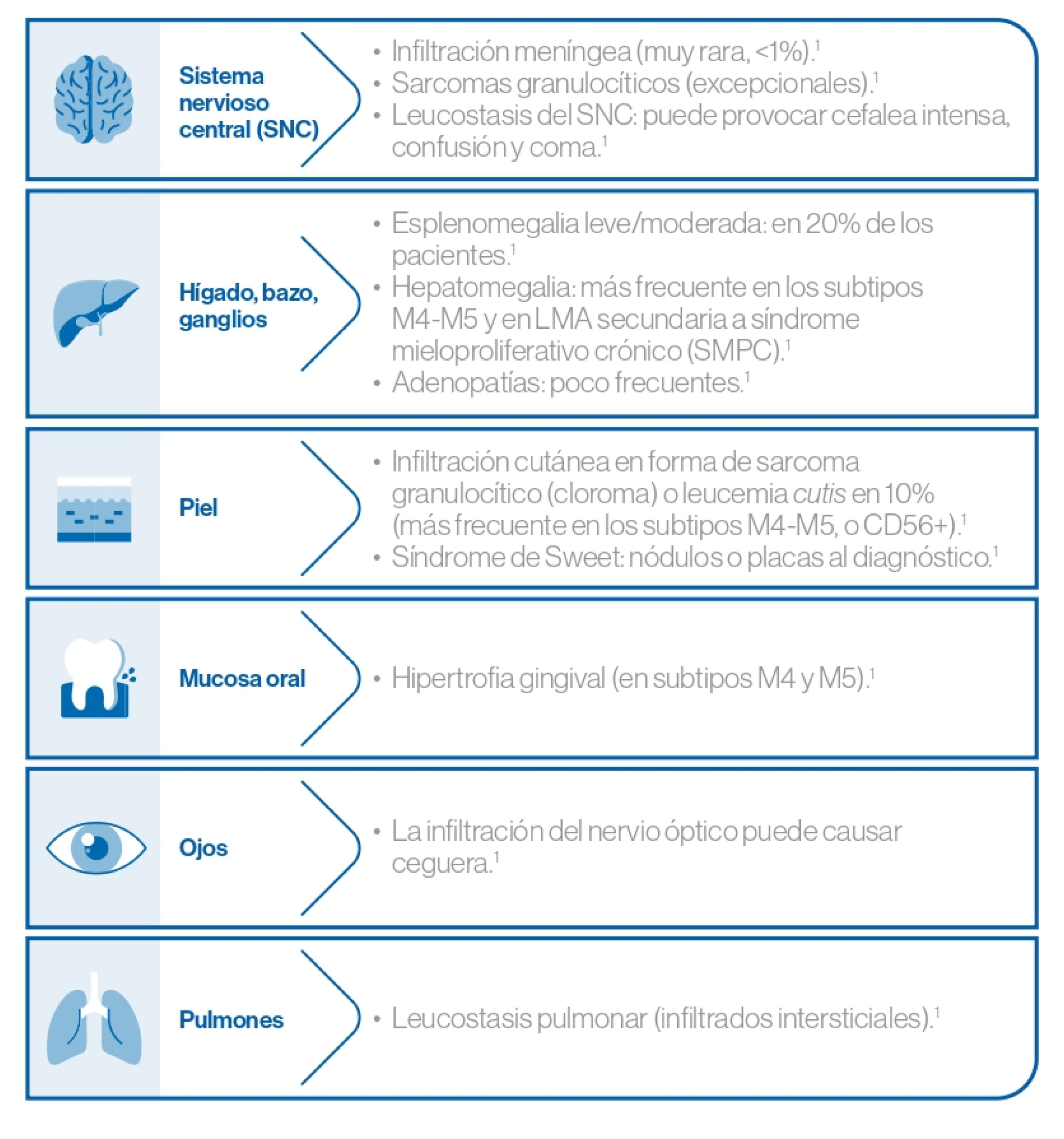
Manifestaciones clínicas relacionadas con la infiltración extramedular
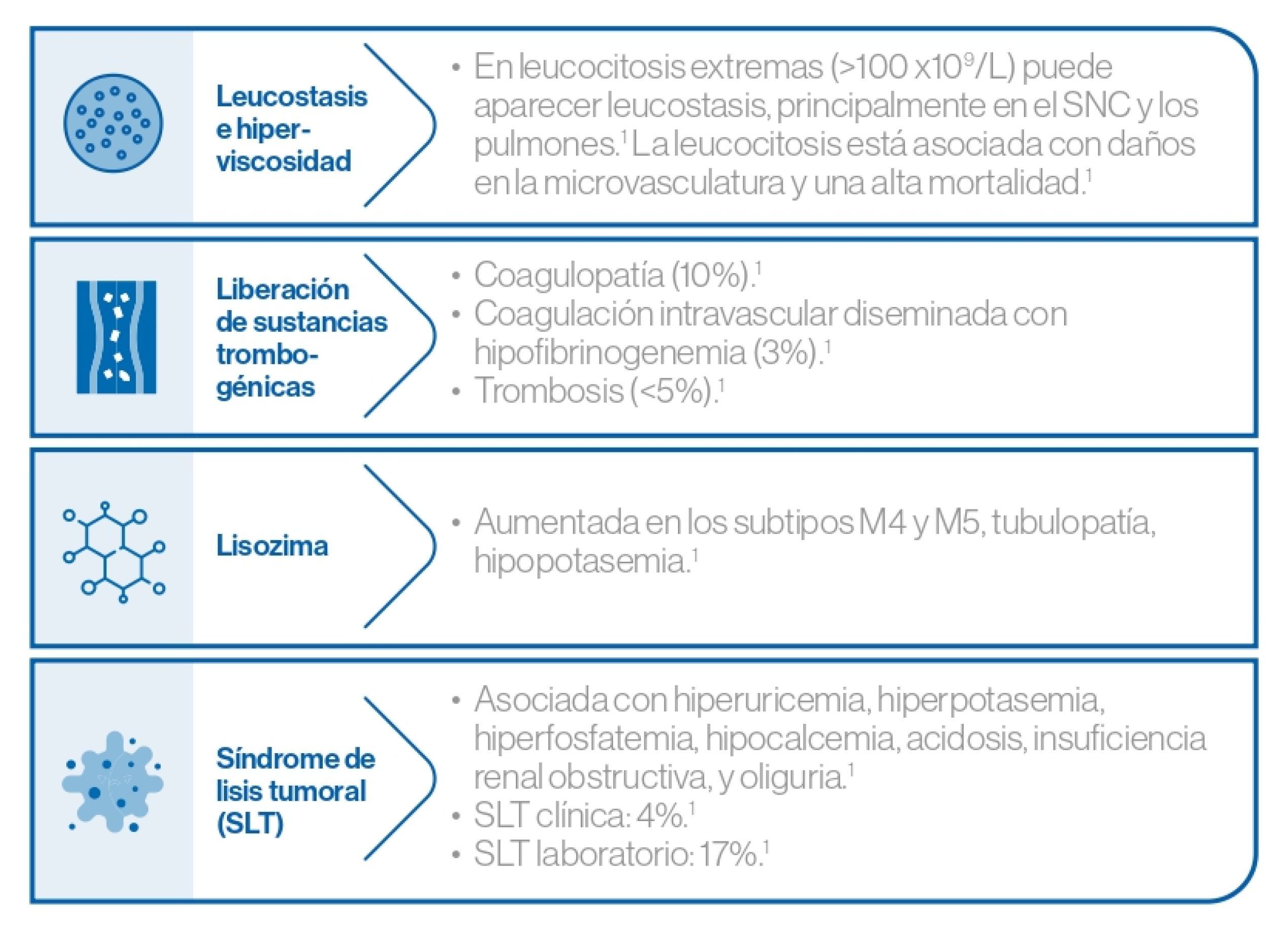
Manifestaciones metabólicas y vasculares
Referencia
Diagnóstico
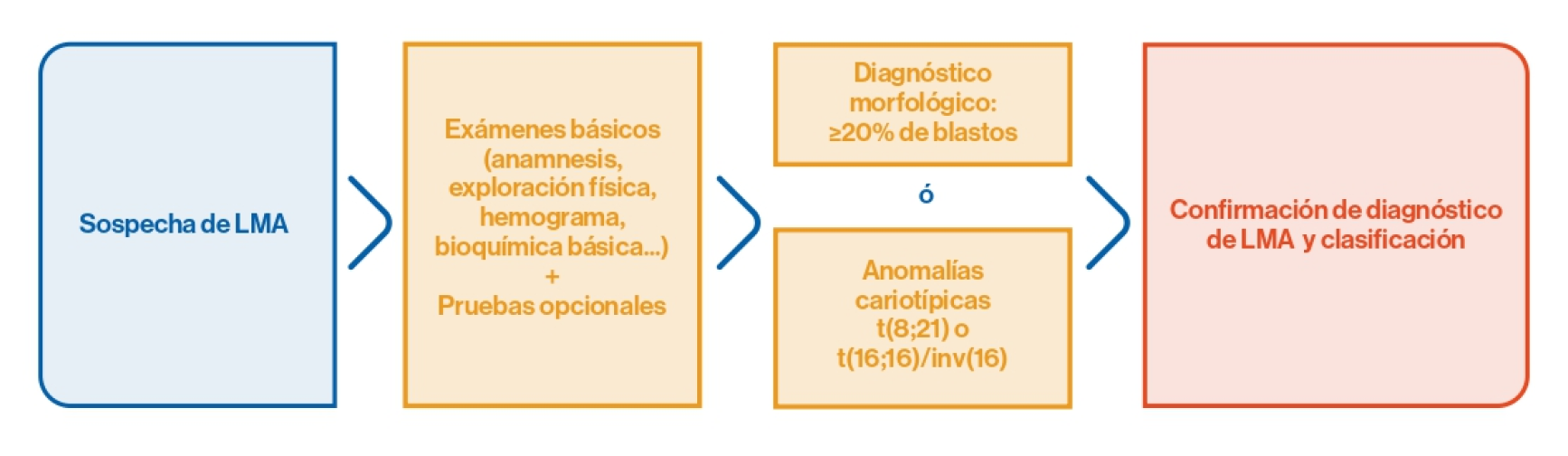
Recomendaciones para el diagnóstico
Anamnesis
Realizar un proceso de anamnesis en el paciente que incluya:1
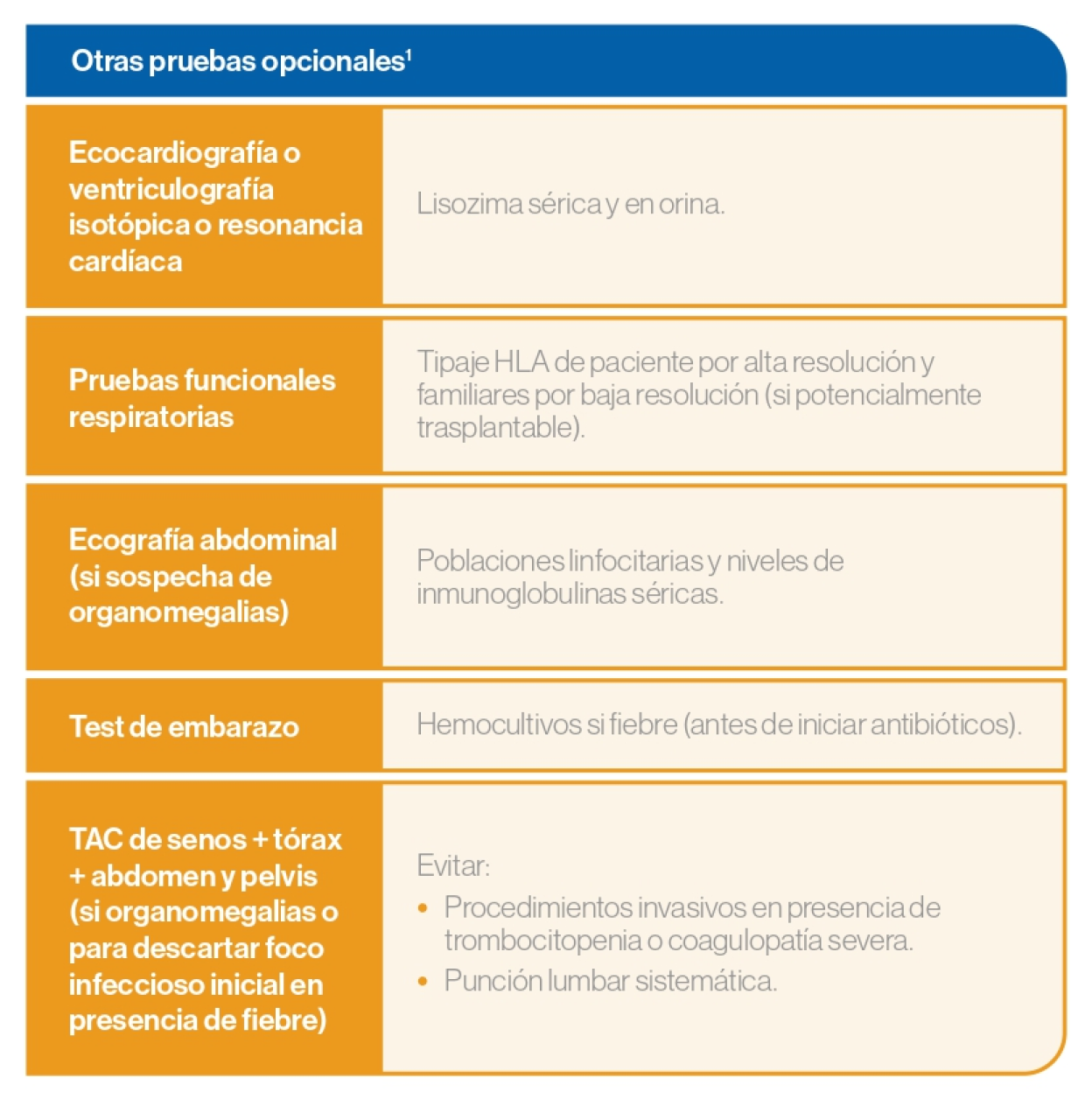
Análisis y exámenes
Referencia
Pronóstico y clasificación
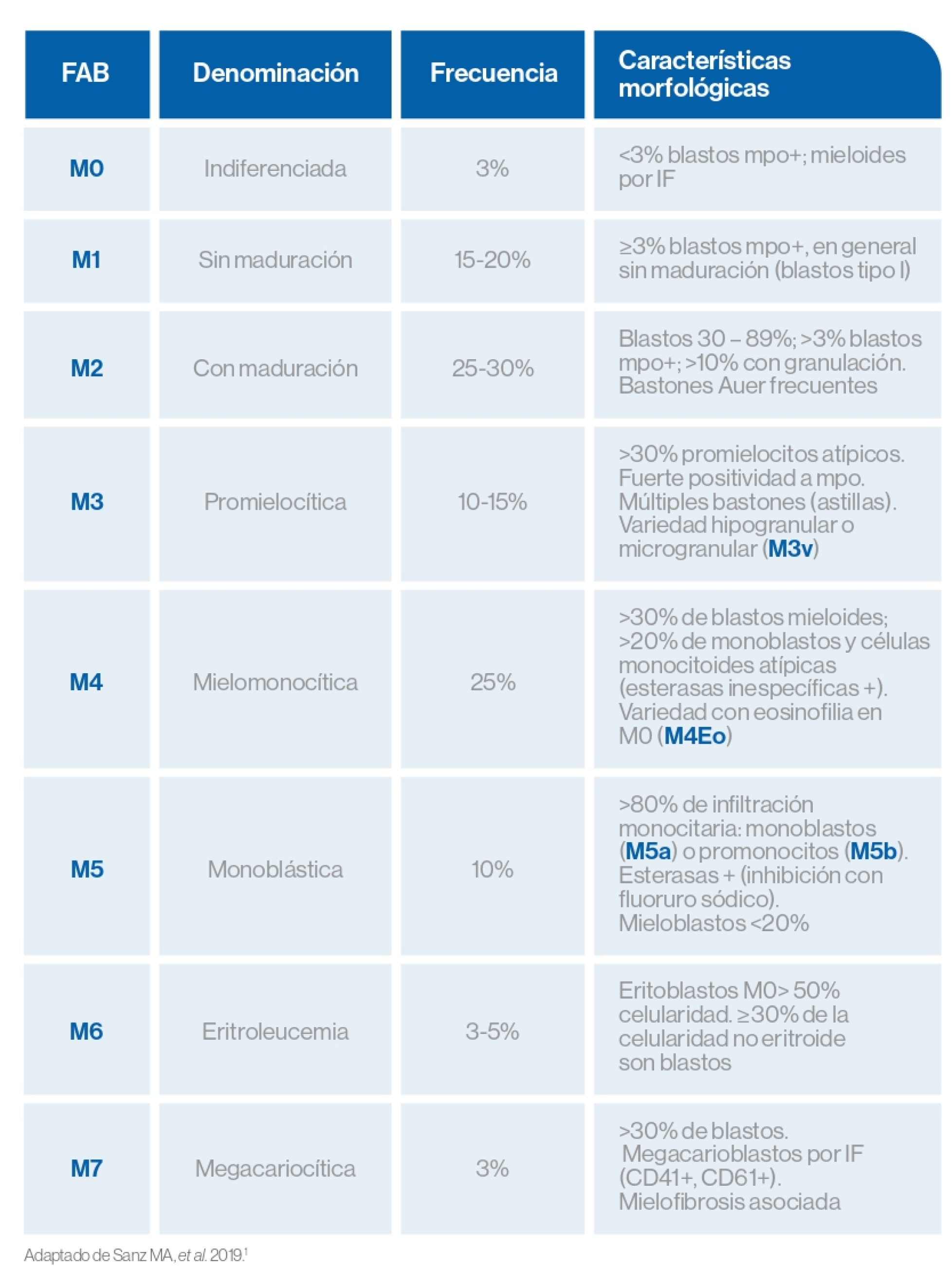
Clasificación
Pronóstico
Referencias
Döhner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017;129(4):424-447.
Sanz MA, Carreras E. Manual Práctico de hematología Clínica. Capítulo 3.3. Leucemia mieloide aguda (6ª edición). 2019. Disponible en: https://www.go-space.es/hematologia/C03leucemiamieloide2019.pdf
DiNardo CD, Wei AH. How I treat acute myeloid leukemia in the era of new drugs. Blood. 2020 Jan 9;135(2):85-96.
Sanz MA, Carreras E. Manual Práctico de hematología Clínica. Capítulo 3.3. Leucemia mieloide aguda (6ª edición). 2019. Disponible en: https://www.go-space.es/hematologia/C03leucemiamieloide2019.pdf
DiNardo CD, Wei AH. How I treat acute myeloid leukemia in the era of new drugs. Blood. 2020 Jan 9;135(2):85-96.
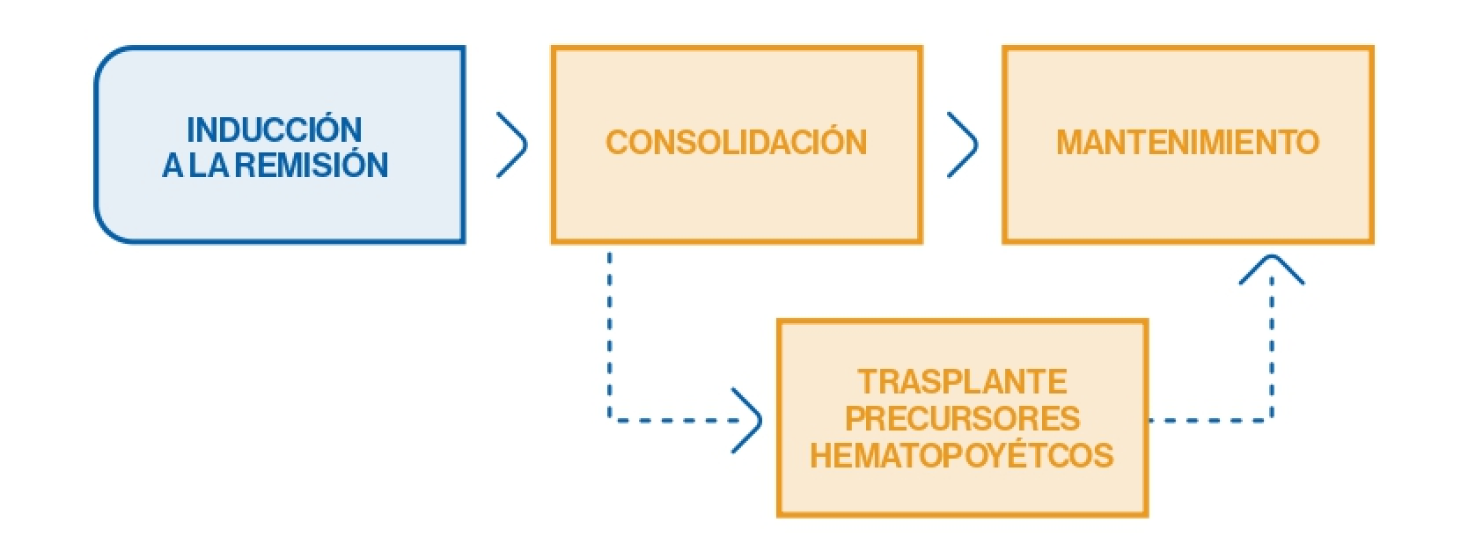
Tratamiento
Tratamiento de soporte
Tratamiento de 1ª línea
Tratamiento de 1ª línea – Pacientes ancianos
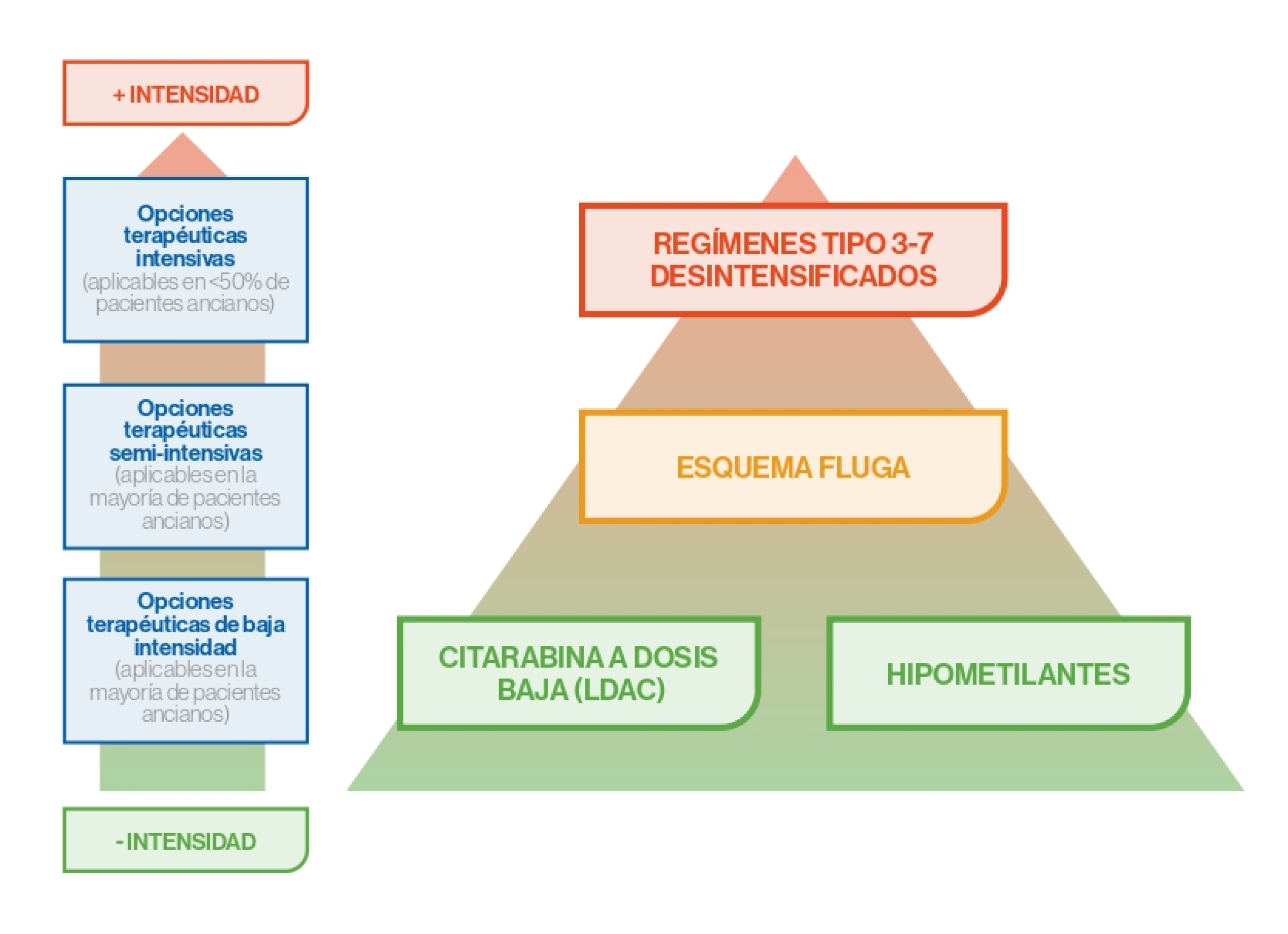
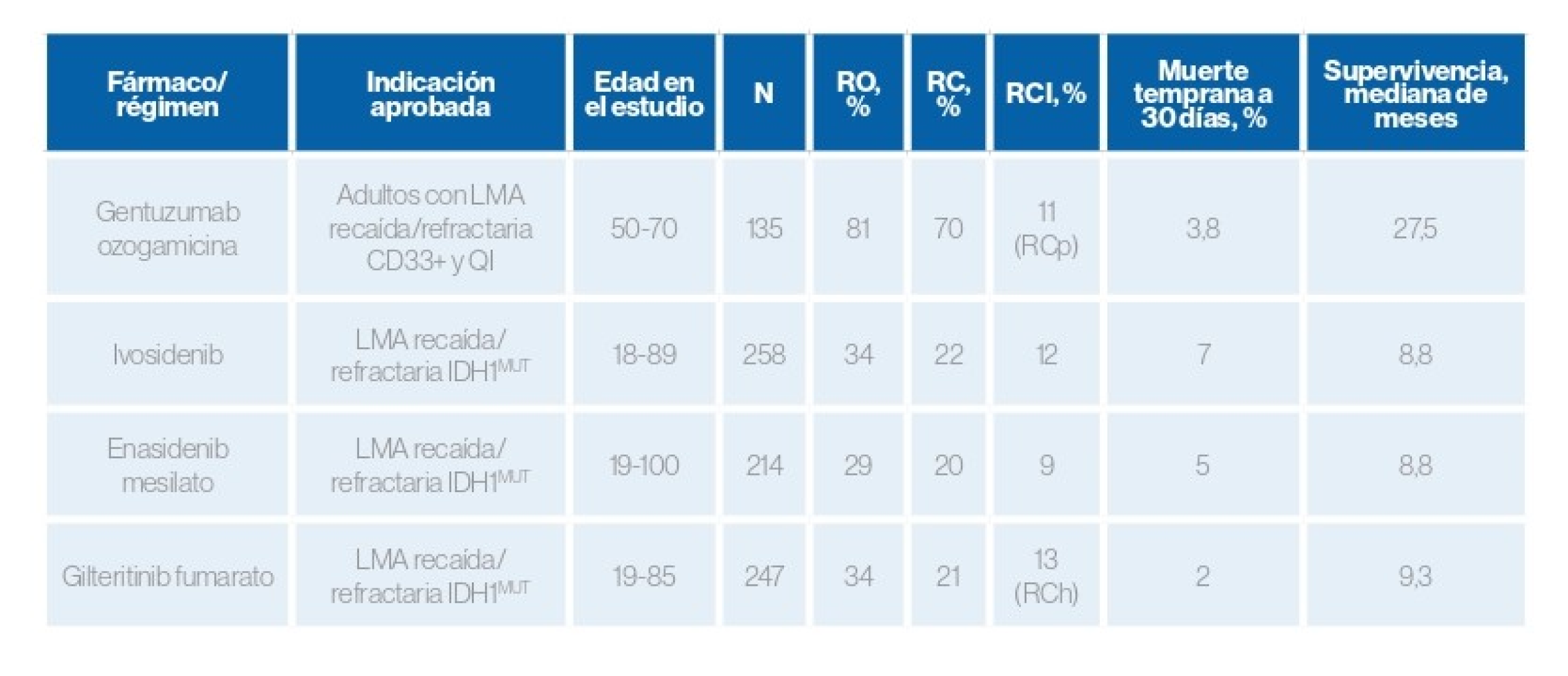
Tratamientos aprobados recientemente por la FDA3
Indicados para pacientes ancianos y LMA de nuevo diagnóstico:3
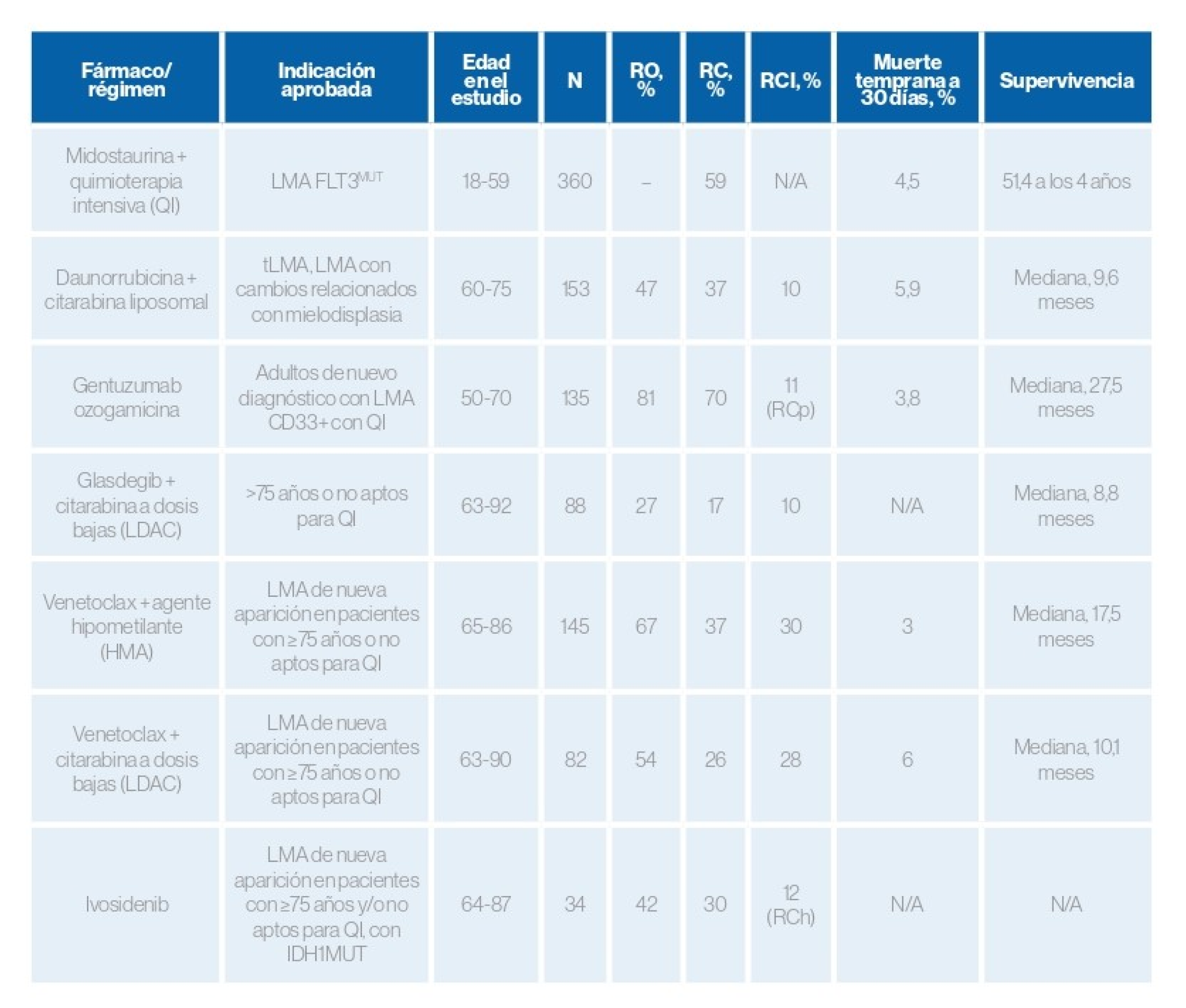
Referencias
Seguimiento y evaluación de la respuesta
A la hora de hacer el seguimiento del paciente, de debe realizar una evaluación principal de la respuesta no más allá del día 28-35 desde la inducción y/o cuando se detecte recuperación de parámetros hematológicos en sangre periférica. La valoración de la respuesta debe basarse en el examen citomorfológico de la médula ósea y la sangre periférica. En caso de duda, repetirla al cabo de una semana.1
Según los resultados, los pacientes podrán presentar uno de los siguientes tipos de respuesta:1

Tratamiento de la LMA recaída o refractaria a primera línea (1)
Tratamientos aprobados recientemente por la FDA (2)
Indicados para pacientes con LMA recaída o refractaria:2