Revolade en AMG
Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
Incluyó a 43 pacientes ≥12 años de edad con AMG refractaria después de al menos un tratamiento inmunosupresor previo y con un recuento de plaquetas ≤ 30.000/μL.
La variable principal fue la respuesta hematológica valorada después de 12-16 semanas de tratamiento con REVOLADE®.
Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-1825.
Ficha técnica de REVOLADE®.
Olnes MJ, et al. Prevalence and treatment of chronic idiopathic thrombocytopenic purpura of childhood in Sweden. Acta Paediatr. 1997;86(2):226-7.
Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-1825.
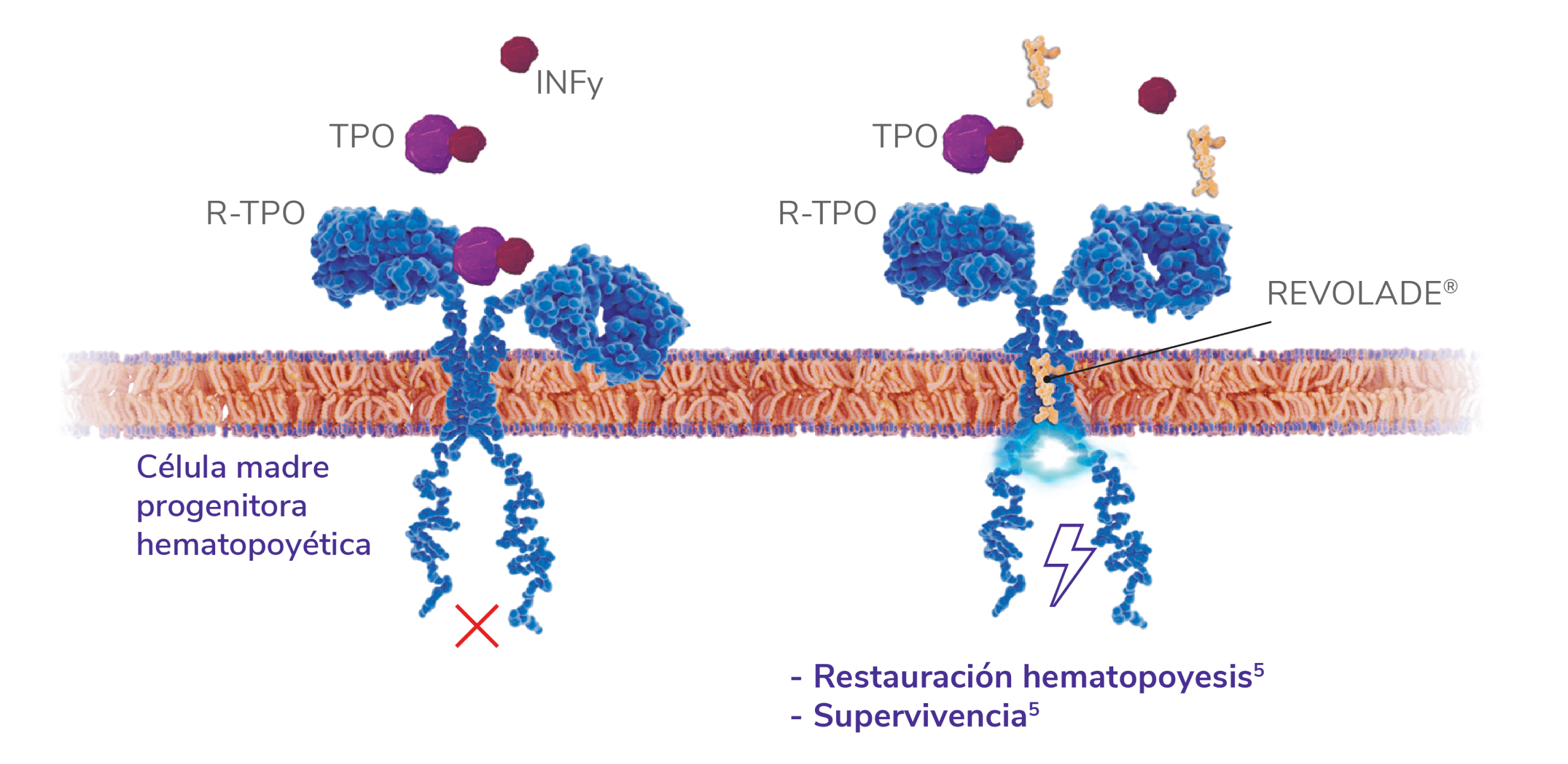
A pesar de los altos niveles de TPO circulante en AMG, hay una actividad ineficiente de la misma en las células progenitoras hematopoyéticas. Los datos de un estudio in vitro sugieren que la TPO se une directamente al interferon gamma (INFγ) para formar complejos heteroméricos que no permiten que la TPO se una a sus receptores (R-TPO)5
Los resultados preliminares de un estudio in vitro sugieren que REVOLADE® puede evadir el bloqueo del INFγ uniéndose selectivamente al receptor de la TPO, lo cual explica por qué REVOLADE® tiene actividad clínica en casos de aplasia medular, a pesar de haber niveles de TPO endógena elevados.5
McCormack PL. Eltrombopag: a review of its use in patients with severe aplastic anemia. Drugs. 2015;75(5):525-31.
Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-25.
Ficha técnica de REVOLADE®.
McCormack PL. Eltrombopag: a review of its use in patients with severe aplastic anemia. Drugs. 2015;75(5):525-31.
Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-25.
Ficha técnica de REVOLADE®.
Ficha técnica de REVOLADE®.
Bao W, et al. Improved regulatory T-cell activity in patients with chronic immune thrombocytopenia treated with thrombopoietic agents. Blood. 2010;116(22):4639-45.
Ghadaki B, et al. Sustained remissions of immune thrombocytopenia associated with the use of thrombopoietin receptor agonists. Transfusion. 2013;53(11):2807-12.
Liu X, et al. Thrombopoietin receptor agonists shift the balance of Fcγ receptors toward inhibitory receptor IIb on monocytes in ITP. Blood. 2016;128(6):852-61.
Eficacia
Adultos
En pacientes con aplasia medular grave (AMG) adquirida refractaria.
REVOLADE® proporciona una respuesta multilínea1
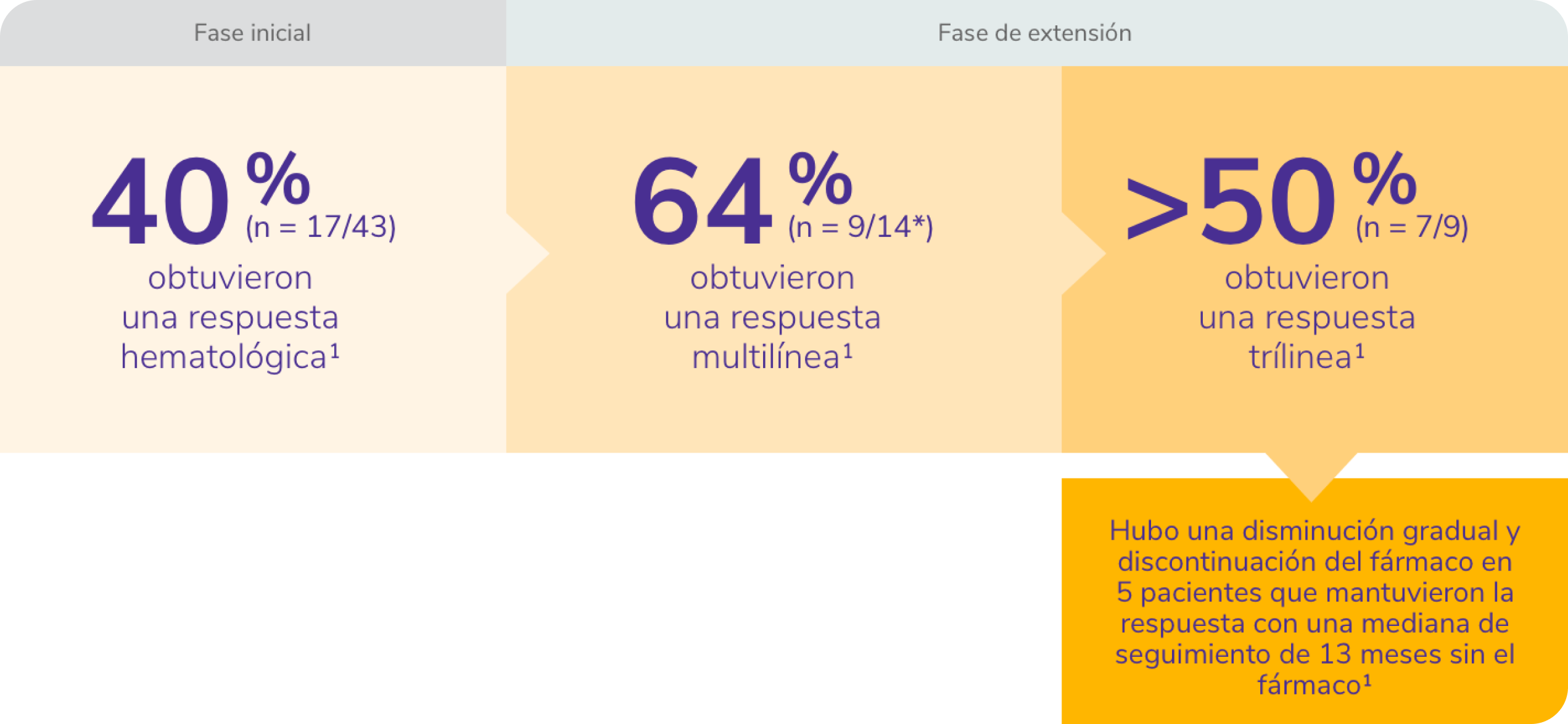
*Tres de los 17 pacientes aptos no iniciaron la fase de extensión.1

La respuesta hematológica se definió como el cumplimiento de uno o más de los siguientes criterios:
Incremento de ≥20.000/μL plaquetas respecto a valores iniciales
o
Independencia transfusional ≥8 semanas en pacientes inicialmente dependientes.
Incremento del nivel de hemoglobina (si el nivel inicial <9 g/dL) de ≥1,5 g/dL sin transfusiones
o
Reducción del número de concentrados de hematíes transfundidos de ≥4 concentrados en 8 semanas consecutivas, comparado con los requerimientos de las 8 semanas anteriores al inicio del estudio.
Incremento del ≥100 % en el RAN en pacientes con un valor inicial basal de <500/μL.
o
Un incremento de RAN de >500/μL en pacientes con un RAN de ≥500/μL inicial.
Los pacientes que respondieron podrían continuar la terapia en una fase de extensión.
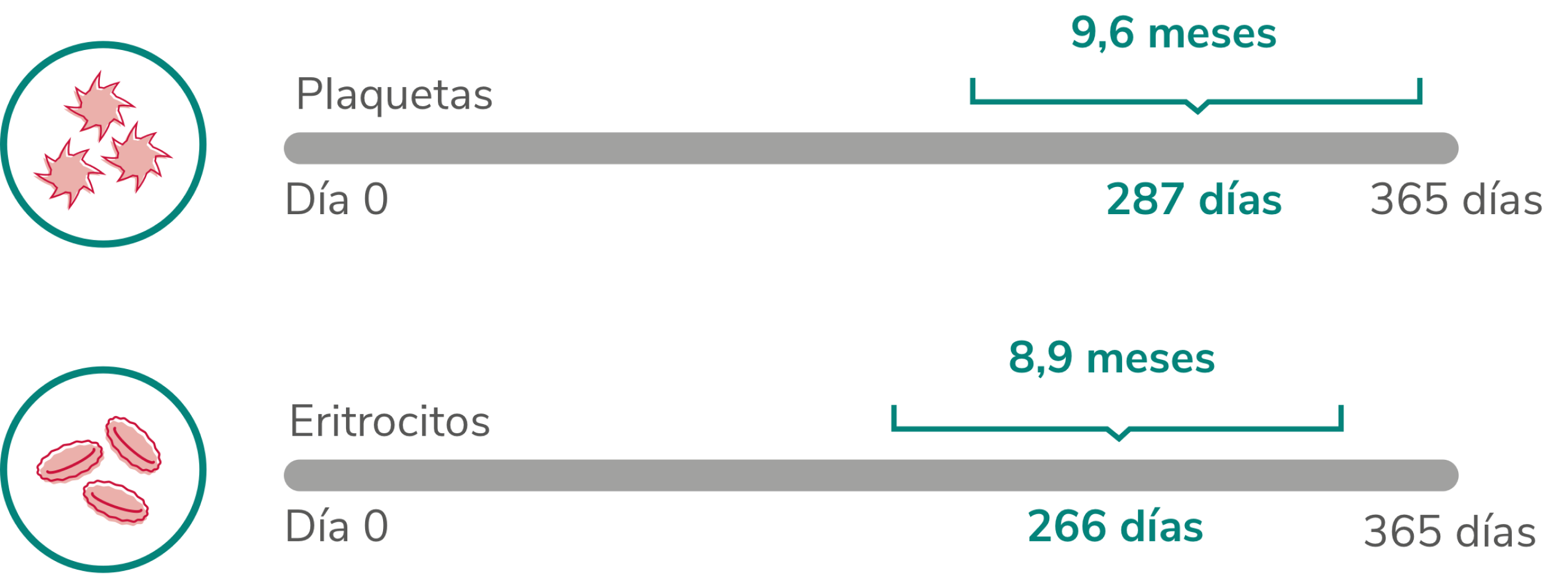
El tratamiento con REVOLADE® se asoció a independencia transfusional de plaquetas y hematíes2

*El 91 % de los pacientes eran dependientes de transfusiones de plaquetas al inicio del estudio (39/43).
†El 86 % de los pacientes eran dependientes de transfusiones de hematíes al inicio del estudio (37/43).

Mediana del periodo sin transfusiones en respondedores2
Diseño de estudios
Estudios de REVOLADE® en aplasia medular grave (AMG)
Estudio en AMG refractaria2-4
Estudio fase 2, pivotal no aleatorizado iniciado por investigador (n = 43) para evaluar la seguridad y respuesta hematológica en pacientes con AMG refractaria y describir la duración y calidad de las respuestas, el impacto de la discontinuación en respondedores robustos y la incidencia de evolución clonal.
La respuesta hematológica se definió como el cumplimiento de uno o más de los siguientes criterios:
Incremento de ≥20.000/μL plaquetas respecto a valores iniciales
o
Independencia transfusional ≥8 semanas en pacientes inicialmente dependientes.
Incremento del nivel de hemoglobina (si el nivel inicial <9 g/dL) de ≥1,5 g/dL sin transfusiones
o
Reducción del número de concentrados de hematíes transfundidos de ≥4 concentrados en 8 semanas consecutivas, comparado con los requerimientos de las 8 semanas anteriores al inicio del estudio.
Incremento del ≥100 % en el RAN en pacientes con un valor inicial basal de <500/μL.
o
Un incremento de RAN de >500/μL en pacientes con un RAN de ≥500/μL inicial.
Los pacientes que respondieron podrían continuar la terapia en una fase de extensión.
Referencias
REVOLADE® ha demostrado proporcionar una respuesta trilínea1,4
REVOLADE® puede evadir el bloqueo del INFγ5
 VIDEO
VIDEO
AMG: aplasia medular grave; EPO: eritropoyetina; G-CSF: factor estimulador de colonias de granulocitos; INFy: interferón gamma; R-TPO: receptor de la tromboyetina; TPO: trombopoyetina.
Seguridad
REVOLADE® presenta una buena tolerabilidad1
Recomendaciones en el seguimiento de pacientes con AMG tratados con REVOLADE®3
AMG: aplasia medular grave; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa.
Referencias
Dosis y administración
Dosis y administración
REVOLADE® debe ajustarse según la respuesta del paciente
Posología de REVOLADE® en AMG1
La pauta posológica de REVOLADE® en AMG debe individualizarse en base a la respuesta plaquetaria del paciente1
Con REVOLADE® los pacientes pueden lograr una respuesta sostenida2 con una dosificación adaptada a sus rutinas1
REVOLADE® ofrece un horario de dosificación flexible que se adapta al estilo de vida de los pacientes.1
No requiere administración hospitalaria semanal. Los pacientes pueden tomar su tratamiento en vacaciones.

Presentaciones
Comprimidos y suspensión oral.
REVOLADE® está disponible en comprimidos y polvo para suspensión oral.3
Presentaciones

Descubra cómo preparar y administrar REVOLADE® polvo para suspensión oral3
 VIDEO
VIDEO

*Descartar la suspensión, si no se administra en los 30 minutos tras la preparación.
Referencias
Pautas dietéticas

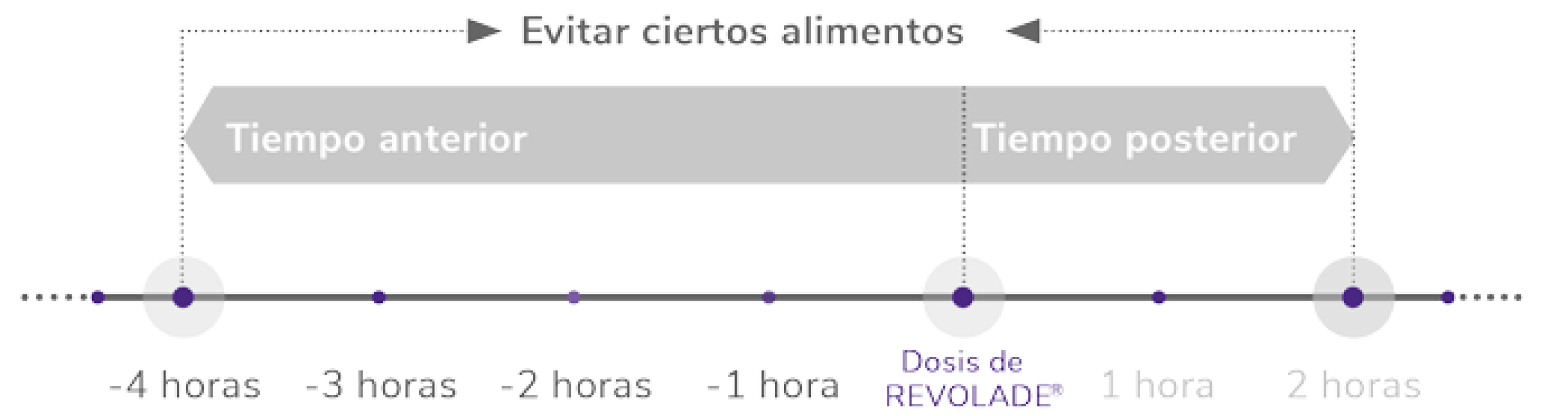
Administración de REVOLADE® y consideraciones de la ingesta de alimentos
REVOLADE® se debe administrar al menos 2 horas antes y 4 horas después de ingerir estos productos:1

*Como hierro, calcio, aluminio, magnesio, selenio y zinc.
Referencia
Referencias
Perfil de seguridad a más largo plazo estudiado en PTI (hasta 8,8 años): estudio EXTEND.6
El estudio EXTEND demuestra que incluso utilizando REVOLADE® durante años, puede ser no solo consistente en eficacia, sino tolerable y seguro en la mayoría de los pacientes.6
The Lancet Haematology
Blood
Lancet
European journal of haematology
Platelets
Ficha técnica de REVOLADE®.
EPAR REVOLADE®: https://www.ema.europa.eu/en/documents/variation-report/revolade-h-c-111....
EPAR NPLATE®: https://www.ema.europa.eu/en/documents/variation-report/nplate-h-c-942-i....
Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015; 2(8): e315-e325.
Grainger JD, et al.Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015; 386 (10004): 1649-1658.
Wong RSM, et al. Safety and effcacy of long term treatment of chronic/persistent ITP with eltrombopag :final results of the EXTEND study. Blood . 2017;130(23):2527 2536. Blood. 2018;131(6):709.
Resultados en PubMed. Último acceso: septiembre 2023. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/?term=eltrombopag+AND+((immune+thrombocytopenia)+OR+(severe+aplastic+anemia))
Bussel JB, et al. Eltrombopag for the treatment of chronic idiopathic thrombocytopenic purpura. N Engl J Med. 2007 Nov 29;357(22):2237-47.
Bussel JB, et al. Effect of eltrombopag on platelet counts and bleeding during treatment of chronic idiopathic thrombocytopenic purpura: a randomised, double-blind, placebo-controlled trial. Lancet. 2009 Feb 21;373(9664):641-8.
Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6 month, randomised , phase 3 study. Lancet. 2011;377(9763):393 402.
Bussel JB, et al. Repeated short-term use of eltrombopag in patients with chronic immune thrombocytopenia (ITP). Br J Haematol. 2013 Feb;160(4):538-46.
Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536. Brynes RK, et al. Acta Haematol. 2017;137:66-72.
Brynes RK, et al. Acta Haematol. 2017;137:66-72.
Olnes MJ, et al. Eltrombopag and improved hematopoiesis in refractory aplastic anemia. N Engl J Med. 2012 Jul 5;367(1):11-9.
Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-1825.
Afdhal NH, et al. Eltrombopag increases platelet numbers in thrombocytopenic patients with HCV infection and cirrhosis, allowing for effective antiviral therapy. Gastroenterology. 2014;146(2):442-452.e1.
FDA 2008.
Decisión de la Comisión 2010.
Comercialización en España 2010.
EMA 2019
Comercialización en España 2019
Gonzalez-Porras JR, Bastida JM. Eltrombopag in immune thrombocytopenia: efficacy review and update on drug safety. Ther Adv Drug Saf. 2018;9(6):263-285.
Bussel JB, et al. Eltrombopag for the treatment of chronic idiopathic thrombocytopenic purpura. N Engl J Med. 2007;357(22):2237-2247.
Bussel JB, et al. Effect of eltrombopag on platelet counts and bleeding during treatment of chronic idiopathic thrombocytopenic purpura: a randomised, double-blind, placebo-controlled trial. Lancet. 2009;373(9664):641-648.
Bussel JB, et al. Repeated short-term use of eltrombopag in patients with chronic immune thrombocytopenia (ITP). Br J Haematol. 2013;160(4):538-546.
Cheng G, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. Lancet. 2011;377(9763):393-402.
Olnes MJ, et al. Eltrombopag and improved hematopoiesis in refractory aplastic anemia. N Engl J Med. 2012;367(1):11-19.
Desmond R, et al. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood. 2014;123(12):1818-1825.
Bussel JB, et al. Eltrombopag for the treatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlled study. Lancet Haematol. 2015;2(8):e315-e325.
Grainger JD, et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015;386(10004):1649-1658.
Wong RSM, et al. Safety and efficacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(23):2527-2536.
REVOLADE® es único porque TÚ lo haces posible
 VIDEO
VIDEO
Aprobado para 4 indicaciones
El único AR-TPO aprobado para 4 indicaciones1
1. Trombocitopenia inmune primaria en paciente adulto
Revolade está indicado en pacientes adultos para el tratamiento de la trombocitopenia inmune primaria (PTI) que son refractarios a otros tratamientos (por ejemplo, corticosteroides, inmunoglobulinas).
2. Trombocitopenia inmune primaria en paciente pediátrico
REVOLADE® está indicado en pacientes pediátricos de 1 año o más de edad para el tratamiento de la trombocitopenia inmune primaria (PTI) de 6 meses o más de duración desde el diagnóstico y que son refractarios a otros tratamientos (por ejemplo, corticosteroides, inmunoglobulinas).
3. Trombocitopenia asociada a la infección crónica por virus de la hepatitis C
REVOLADE® está indicado para el tratamiento de la trombocitopenia en pacientes adultos con infección crónica por el virus de la hepatitis C (VHC), cuando el grado de trombocitopenia es el principal factor que impide el inicio o limita la capacidad de mantener un tratamiento basado en interferón de forma óptima.
4. Aplasia medular grave (AMG)
REVOLADE® está indicado en pacientes adultos con AMG adquirida que han sido refractarios a un tratamiento inmunosupresor previo o muy pretratados y que no son candidatos a un trasplante de progenitores hematopoyéticos.
Trombocitopenia inmune primaria (PTI adultos y PTI pediatría)
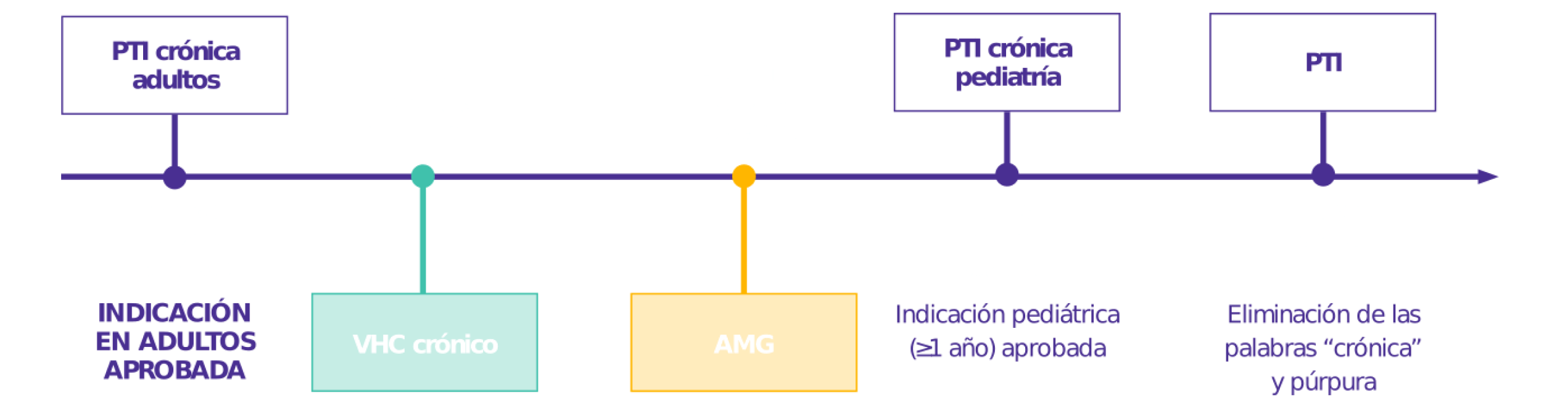
Las fechas de la primera aprobación global se muestran arriba. Eltrombopag Global Data Sheet. Version 14. November 2016.
El primer AR-TPO aprobado para el tratamiento de niños de +1 año con PTI2,3
Para sus pacientes pediátricos (≥ 1 año de edad) con PTI que son refractarios a un tratamiento previo REVOLADE® proporciona una reducción de las hemorragias y la medición concomitante1,4

Para sus pacientes pediátricos (≥1 año de edad) con PTI que son refractarios a un tratamiento previo REVOLADE® tiene una buena tolerabilidad
Perfil de seguridad sólido en en el estudio PETIT4
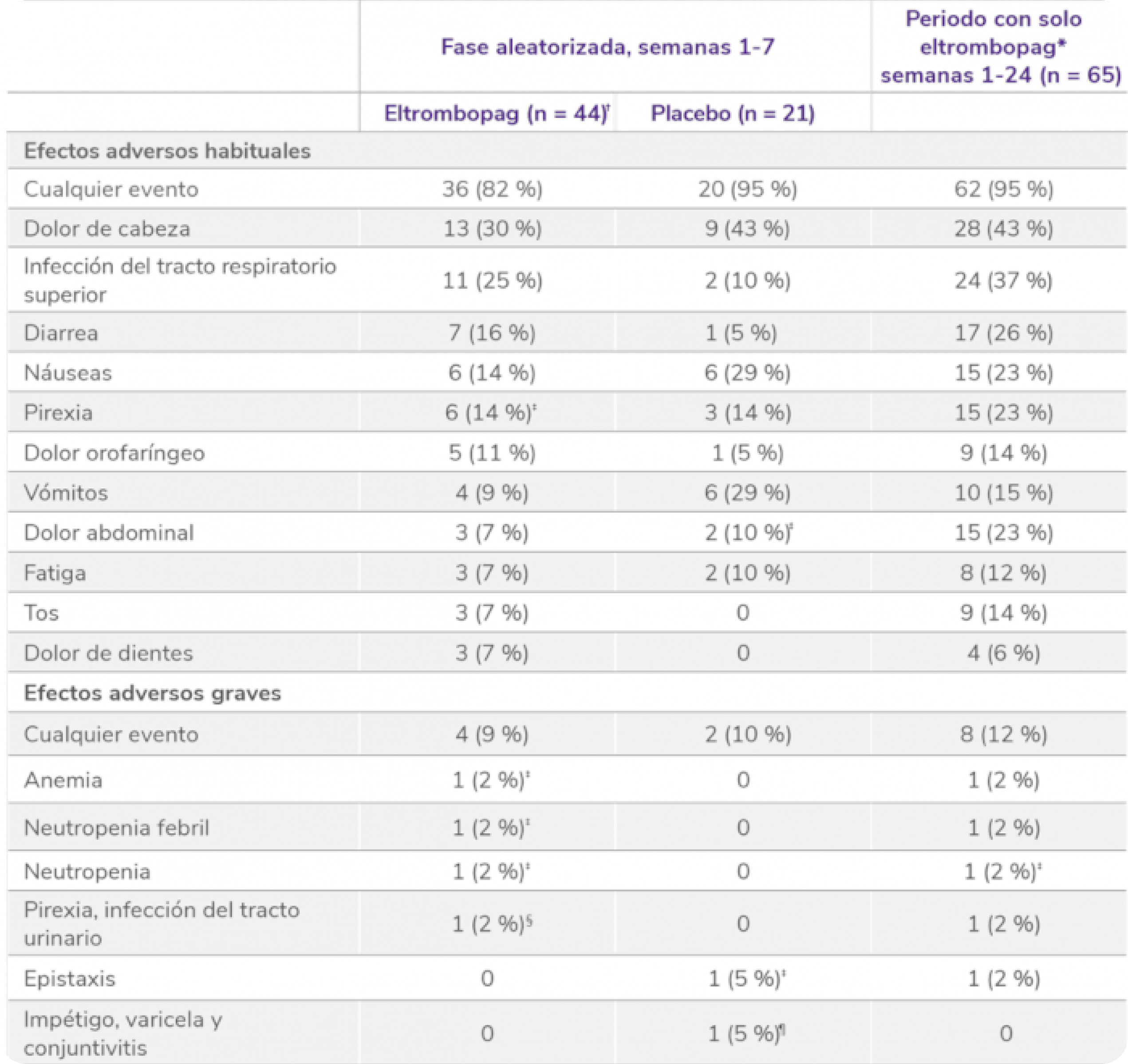
Los datos son n(%). Como efectos adversos se consideraron el número de eventos ocurridos en al menos el 5% de los pacientes que recibieron eltrombopag durante el período de doble ciego. Los pacientes podían experimentar más de un efecto adverso. *La población del periodo con solo eltrombopag incluye a todos los pacientes asignados a recibir eltrombopag que recibieron la medicación del estudio. † La población de seguridad incluye a un paciente asignado a placebo que recibió eltrombopag. ‡Incluye un efecto adverso de grado 3-4. § Ambos de grado 3. ¶Incluye impetigo y varicela de grado 3.
Perfil de seguridad sólido en la fase doble ciego aleatorizada del PETIT25
Efectos adversos en la fase doble ciego aleatorizada5
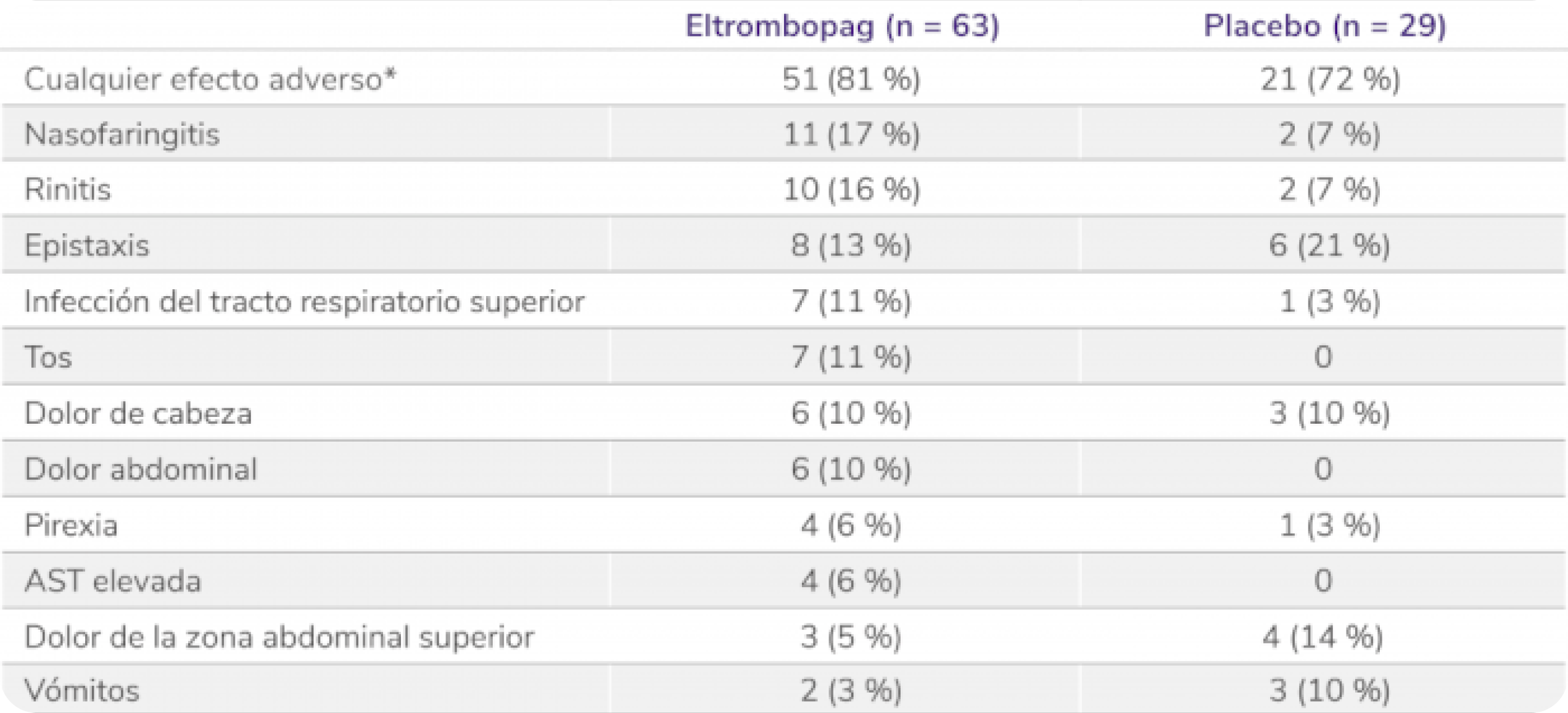
Los datos son n(%). Se han considerado efectos adversos ocurridos en ≥ 5% de los pacientes durante el periodo de doble ciego. Los pacientes podían experimentar más de un efecto adverso. AST: aspartato aminotransferasa. *Efectos adversos ocurridos con cualquier frecuencia.
Efectos adversos graves en la fase doble ciego aleatorizada5
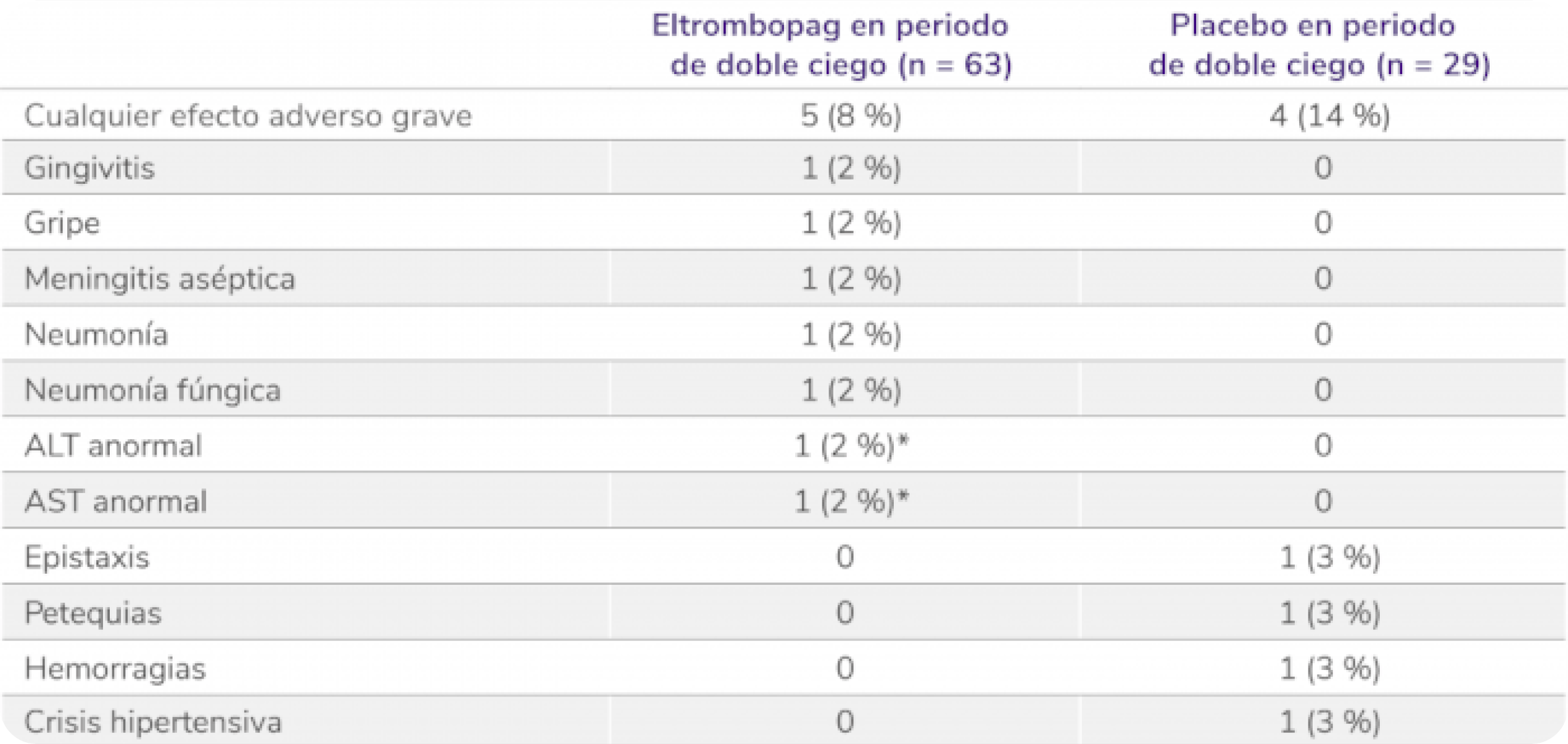
Los datos son n(%). Las frecuencias se basan en el número de pacientes que experimentan el evento. Los pacientes podían experimentar más de un efecto adverso, ALT: alanina aminotransferasa; AST: aspartato aminotransferasa. *Considerado por el investigador como relacionado con el tratamiento.
Amplia experiencia demostrada
Con un estudio de extensión de casi 9 años, evaluando la seguridad y eficacia a largo plazo en PTI adultos6
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo REVOLADE® proporciona una reducción de las hemorragias y la medicación concomitante en el estudio EXTEND6
En pacientes adultos con trombocitopenia inmune primaria (PTI) que son refractarios a un tratamiento previo REVOLADE® tiene el perfil de seguridad a más largo plazo demostrado
REVOLADE® es bien tolerado en pacientes con PTI, incluso en el tratamiento a largo plazo.6
Con una evidencia científica demostrada por +700 publicaciones en PTI y AMG7
Publicaciones en revistas como:
Con una evidencia científica demostrada por +700 publicaciones en PTI y AMG7
PTI adultos
PTI pediatría
AMG
AMG14,15
Nº de pacientes con EPAG/total: 43/43
Estudio fase 2, pivotal, no aleatorizado, iniciado por investigador, para evaluar la seguridad y respuesta hematológica en pacientes con AMG refractaria y describir la duración y calidad de las respuestas, el impacto de la discontinuación en respondedores robustos y la incidencia de evolución clonal. Incluyó a 43 pacientes ≥12 años con AMG refractaria después de al menos un tratamiento inmunosupresor previo y con un recuento de plaquetas ≤30.000/μL.
El 40% (17/43) de los pacientes alcanzaron la respuesta hematológica en ≥1 línea tras 12-16 semanas de tratamiento con REVOLADE®, 7 pacientes lograron una respuesta trilínea y en 5 de ellos hubo una disminución gradual y discontinuación del fármaco manteniendo la respuesta, con una mediana de seguimiento de 13 meses sin el fármaco. 8 (19%) pacientes desarrollaron una nueva anomalía citogenética.
Trombocitopenia asociada a la infección crónica por VHC*
Con un gran número de pacientes reclutados en sus ensayos pivotales1

*en pacientes que van a recibir un tratamiento basado en interferón1
En sus pacientes adultos con PTI que son refractarios a un tratamiento previo REVOLADE® proporciona una reducción de las hemorragias y la medicación concomitante (estudio RAISE10)
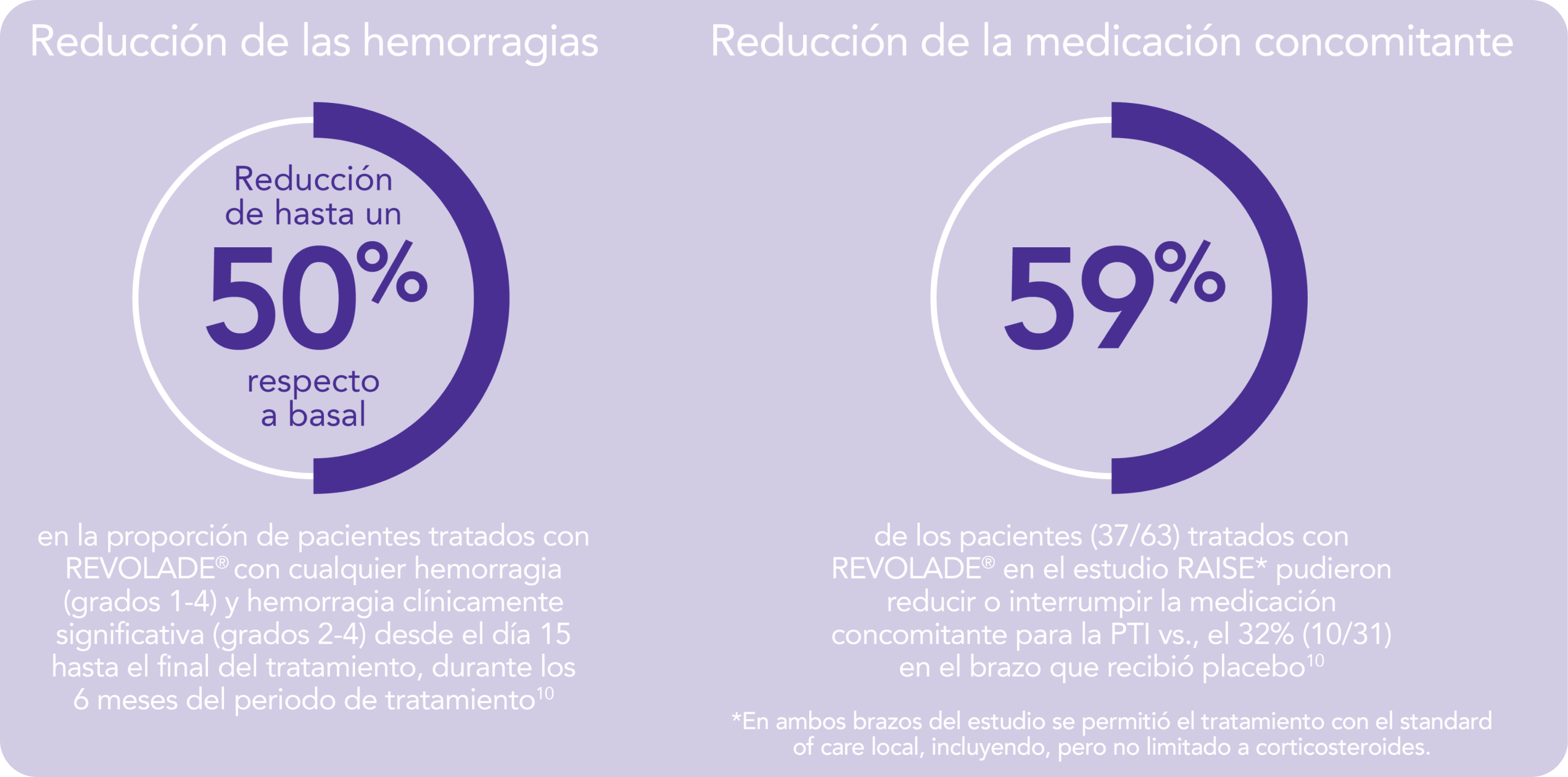
REVOLADE® proporciona una reducción de las hemorragias y la medicación concomitante en niños con PTI4,5
Reducción de hemorragias:

Comodidad para el paciente
El único AR-TPO disponible en comprimidos y polvo para suspensión oral1
REVOLADE® disponible en 2 formas farmacéuticas.
Discontinuación tratamiento
Proporciona la posibilidad de discontinuar el tratamiento manteniendo la respuesta en AMG refractaria15
REVOLADE® restaura la hematopoyesis trilinear en AMG refractaria que puede mantenerse tras la discontinuación del fármaco15
En pacientes con aplasia medular grave refractaria REVOLADE® proporcionó una respuesta multilínea.
En el estudio de Fase II para evaluar la seguridad y respuesta hematológica de pacientes con AMG refractaria se observó:
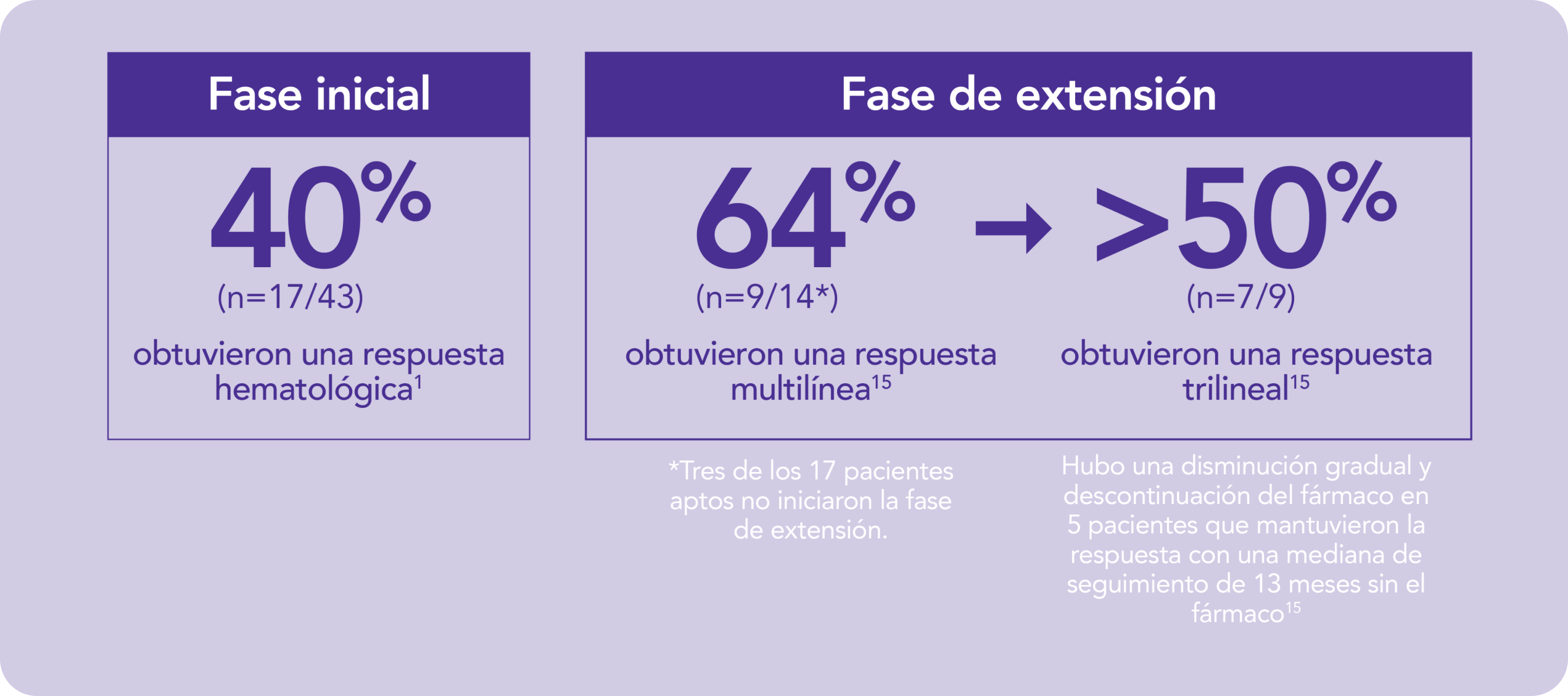
AR-TPO: agonista del receptor de la trombopoyetina; BSL: basal; IQR: rango intercuartílico; PTI: Trombocitopenia inmune primaria; HCV: virus de la hepatitis C; AAG: anemia aplásica grave.
Referencias

2006
TRA100773A² y TRA100773B³
Estudios aleatorizados, doble ciego controlados con placebo, de 6 semanas de duración (88/117 y 76/114 pacientes tratados con REVOLADE®, respectivamente) para adultos con PTI ≥6 meses, ≥1 tratamiento previo.
2007
TRA100773A² y TRA100773B³
2010
PTIc adultos
2013
AMG6,7
Estudio fase 2, pivotal, no aleatorizado, iniciado por investigador, para evaluar la seguridad y respuesta hematológica en pacientes con AMG refractaria (43 pacientes ≥12 años tratados con REVOLADE®).
2014
PETIT⁸ y PETIT2⁹
2015
2016
2019
PTI ≥6 meses del diagnóstico
2020
REVOLADE® en polvo para suspensión oral
DESCUBRA CÓMO PREPARAR Y ADMINISTRAR REVOLADE® POLVO PARA SUSPENSIÓN ORAL.
Referencias
Revolade polvo para suspensión oral
Con receta Médica. Uso hospitalario. Reembolsado por el SNS. PVLn REVOLADE 25 MG 28 COMPRIMIDOS 843,62 €. PVLn REVOLADE 50 MG 28 COMPRIMIDOS 1.687,24 €. PVLn REVOLADE 25 MG 30 SOBRES SUSPENSION ORAL 903,4 €.
Ficha técnica de REVOLADE®



























